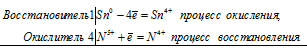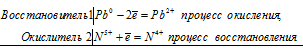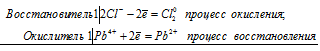Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1529d49ece009f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются — оловянная кислота H2SnO3 и оксид азота (IV) NO2:
Sn 0 + 4N 5+ = Sn 4+ + 4N4 +
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
Pb 0 + 2N 5+ = Pb 2+ + 2N 4+
Задание 366
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2
Sn 2+ + 2Hg 2+ = Sn 4+ + 2Hg +
б) Реакция РЬО2 с НСl (конц.).
Pb 4+ + 2Cl — = Pb 2+ + Cl2 0
Задание 367
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а) Sn +2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH – + 4H2O = [Sn(OH)6] 2- + 2H2↑ (ионно-молекулярная форма)
б) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH — = [Pb(OH)4] 2- (ионно-молекулярная форма).
Нитрат свинца: состав, свойства, получение, применение.
Нитрат свинца: состав, свойства, получение, применение. — Наука
Содержание:
В нитрат свинца или нитрат свинца (II) — это неорганическое соединение, образованное элементами свинца (Pb), азота (N) и кислорода (O). Свинец находится в виде иона Pb 2+ азот и кислород образуют нитрат-ион NO3 – .
Его химическая формула — Pb (NO3)2. Это белое кристаллическое твердое вещество, хорошо растворимое в воде, где оно образует ионы Pb. 2+ и нет3 – . Он также известен как нитрат плюмбозы, потому что свинец находится в самой низкой степени окисления.
Он обладает сильными окислительными свойствами, поэтому его используют там, где это требуется, например, при получении различных органических соединений и в качестве лабораторного реагента.
В прошлом он широко использовался для приготовления красок на основе свинца, где он также действовал как закрепитель цвета в тканях. От этого приложения отказались из-за токсичности свинца.
Он использовался в металлургической промышленности по-разному, и недавно было обнаружено, что он полезен для образования вместе с другими соединениями материалов с высокой способностью поглощать свет и превращать его в электричество.
Однако это опасное вещество, поскольку оно может способствовать возникновению пожаров. Он также токсичен для людей, животных и растений, поэтому его нельзя выбрасывать в окружающую среду.
Состав
Это ионное соединение, образованное катионом Pb. 2+ и два аниона NO3 – . В нитрат-анионе атомы кислорода расположены симметрично вокруг азота, и двойная связь чередуется с ним.
Свинец в этом соединении имеет следующую электронную конфигурацию:
[Xe] 4F 14 5d 10 6s 2 6п 0 , где было замечено, что он потерял 2 электрона последней оболочки.
Номенклатура
- Нитрат свинца
- Нитрат свинца (II)
- Нитрат свинцовый
- Свинец динитрат
Свойства
Физическое состояние
Белое или бесцветное кристаллическое твердое вещество. Кубические кристаллы.
Молекулярный вес
Температура плавления
470 ° С. По некоторым данным, при этой температуре он разлагается.
Плотность
Растворимость
Хорошо растворим в воде: 59,7 г / 100 мл воды при 25 ° C. Слабо растворим в этаноле. Нерастворим в азотной кислоте (HNO3) концентрированный.
pH
Водный раствор с 20% Pb (NO3)2 он имеет pH 3,0-4,0.
Химические свойства
Это окислитель. Реагирует бурно с горючими материалами и восстановителями.
Он не горюч, но может ускорить горение материалов. При нагревании до разложения выделяет токсичные газы оксида азота:
При растворении в воде ионизирует:
Получение
Его можно получить путем реакции металлического свинца, монооксида свинца (PbO) или карбоната свинца PbCO.3 с азотной кислотой. Желательно использовать избыток кислоты, чтобы избежать образования основных нитратов.
Приложения
В органическом синтезе
Его окислительная способность находит применение при получении различных соединений.
Он был использован для синтеза каликсаренов, которые представляют собой органические соединения, молекула которых имеет форму корзины, которая позволяет вмещать другие вещества в зависимости от того, как они будут использоваться.
Он используется для получения изотиоцианатов (R-NCS), исходя из аминов (R-NH2).
Он используется в промышленных масштабах для получения бензальдегида путем окисления бензилхлорида. Он также служит катализатором этерификации органических соединений, например, при производстве сложных полиэфиров.
В химическом анализе
Он используется как реагент при определении алюминия и свинца в минералах и горных породах.
При окраске текстильных волокон
Некоторые хромовые красители требуют использования Pb (NO3)2 чтобы получить это. Например, чтобы окрасить хлопок в желтый цвет, хлопок покрывают нитратом свинца и обрабатывают сульфатом натрия для получения сульфата свинца.
Затем наносят разбавленный раствор дихромата натрия для образования хромата свинца (PbCrO4), который представляет собой желтый пигмент.
Однако в настоящее время производство свинцовых пигментов прекращено из-за их токсичности.
Он также действует как протрава для фиксации красителей во время окрашивания или печати других типов волокон.
В ветеринарной медине
Ранее он использовался как едкое средство при лечении язвы или гангрены у лошадей.
В металлургической промышленности
Нитрат свинца используется при электролитическом рафинировании свинца в качестве агента, способствующего флотации при удалении титана из определенных глин, он позволяет извлекать драгоценные металлы из цианидных растворов и используется при электроосаждении PbO.2 на никелевых анодах.
В солнечных батареях
Он использовался в виде водного раствора для изготовления солнечных элементов на основе перовскита, минерала оксида титана.
Синтезированный материал представляет собой металлоорганический перовскит или перовскит из иодида свинца, который привлек внимание исследователей, так как обладает высокой способностью поглощать свет и большой длиной диффузии носителей заряда.
Эти характеристики делают его отличным кандидатом для фотоэлектрических устройств, которые преобразуют свет в электрический ток.
Другие приложения
- при производстве спичек, некоторых взрывчатых и пиротехнических материалов,
- в фотографии как сенсибилизирующий агент для покрытия бумаги в фототермографии,
- в текстильной промышленности для улучшения вискозы и стабилизации нейлона,
- в уничтожении грызунов.
Риски
Пожар и взрыв
Хотя это не горючий состав, при воздействии огня или тепла он может взорваться, образуя токсичные оксиды азота.
Поскольку это сильно окислитель, существует опасность возгорания при контакте с органическими материалами.
На здоровье
Вызывает раздражение глаз, дыхательных путей и пищеварительного тракта. Он токсичен при вдыхании и проглатывании. Наиболее частыми симптомами интоксикации этим соединением являются желудочно-кишечные расстройства, колики, запоры и слабость, которые, в частности, могут перерасти в паралич некоторых мышц.
Проглатывание также может вызвать боль, судороги, депрессию, кому и смерть.
Для окружающей среды
Он токсичен для водных и наземных организмов, кроме того, его повреждения являются стойкими, и он биоаккумулируется в живых существах, поэтому считается опасным загрязнителем и не должен выбрасываться в окружающую среду.
При случайном попадании в воду его необходимо нейтрализовать оксидом кальция (CaO), карбонатом кальция (CaCO3) или бикарбонат натрия (NaHCO3).
Было подтверждено, что он канцерогенный для животных и, возможно, для человека.
Ссылки
- НАС. Национальная медицинская библиотека. (2019). Нитрат свинца (II). Получено с pubchem.ncbi.nlm.nih.gov.
- Се, Т. и другие. (2015). Эффективный перовскитовый солнечный элемент, изготовленный с использованием водного предшественника нитрата свинца. Chem Commun (Camb). 2015 4 сентября; 51 (68): 13294-7. Восстановлено с ncbi.nlm.nih.gov.
- Вратны, Ф. и Гуглиотта, Ф. (1963). Термическое разложение нитрата свинца. J. Inorg. Nucl. Chem., 1963, т. 25, стр. 1129-1132. Восстановлено с sciencedirect.com.
- Чакраборти, Дж. (2014). Окрашивание минеральными красками. В основах и практиках окрашивания текстиля. Восстановлено с sciencedirect.com.
- Кумари, Х. и Этвуд, Дж. (2017). Каликсарены в твердом состоянии. В справочном модуле по химии, молекулярным наукам и химической инженерии. Восстановлено с sciencedirect.com.
- Джеффри, П.Г. и Хатчисон Д. (1981). Алюминий. В химических методах анализа горных пород (третье издание). Получено с sciencedirect.com
- Сандлер, С. и Каро В. (1992). Цианаты, изоцианаты, тиоцианаты и изотиоцианаты. В сборнике материалов по передовым органическим лабораторным препаратам. Восстановлено с sciencedirect.com.
- Смит, П.У.Г. и другие. (1969). Ароматические галогенные соединения. В ароматической химии. Восстановлено с sciencedirect.com.
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертый выпуск. Джон Вили и сыновья.
- Лиде, Д. (редактор) (2003). CRC Справочник по химии и физике. 85 th CRC Press.
- Фонд Викимедиа (2020). Нитрат свинца (II). Восстановлено с en.wikipedia.org.
- Шинде, Д.В. и другие. (2017). Повышенная эффективность и стабильность металлоорганического перовскита на основе водного раствора нитрата свинца. ACS Appl. Mater. Интерфейсы 2017, 9, 14023-14030. Восстановлено с pubs.acs.org.
Глобозиды: строение, биосинтез, функции и патологии
http://buzani.ru/zadachi/khimiya-shimanovish/979-olovo-i-svinets-zadaniya-361-364
http://ru1.warbletoncouncil.org/nitrato-de-plomo-1603