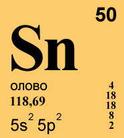Олово: степени окисления и реакции с ним
Химические свойства олова
Олово – это легкий металл с атомным номером 50, который находится в 14-й группе периодической системы элементов. Этот элемент был известен еще в древности и считался одним из самых редких и дорогих металлов, поэтому изделия из олова могли позволить себе самые богатые жители Римской Империи и Древней Греции. Из олова изготавливали специальную бронзу, которой пользовались еще в третьем тысячелетии до нашей эры. Тогда бронза была самым прочным и популярным сплавом, а олово служило одной из примесей и использовалось более двух тысяч лет.
На латыни этот металл называли словом «stannum», что означает стойкость и прочность, однако таким названием ранее обозначался сплав свинца и серебра. Только в IV веке этим словом начали называть само олово. Само же название «олово» имеет множество версий происхождения. В Древнем Риме сосуды для вина делались из свинца. Можно предположить, что оловом называли материал свинец, из которого изготавливали сосуды для хранения напитка оловина, употребляемого древними славянами.
В природе этот металл встречается редко, по распространенности в земной коре олово занимает всего лишь 47-е место и добывается из касситерита, так называемого оловянного камня, который содержит около 80 процентов этого металла.
Применение в промышленности
Так как олово является нетоксичным и весьма прочным металлом, он применяется в сплавах с другими металлами. По большей части его используют для изготовления белой жести, которая применяется в производстве банок для консервов, припоев в электронике, а также для изготовления бронзы.
Физические свойства олова
Этот элемент представляет собой металл белого цвета с серебристым отблеском.
Если нагреть олово, можно услышать потрескивание. Этот звук обусловлен трением кристалликов друг о друга. Также характерный хруст появится, если кусок олова просто согнуть.
Олово весьма пластично и ковко. В классических условиях этот элемент существует в виде «белого олова», которое может модифицироваться в зависимости от температуры. Например, на морозе белое олово превратится в серое и будет иметь структуру, схожую со структурой алмаза. Кстати, серое олово очень хрупкое и буквально на глазах рассыпается в порошок. В связи с этим в истории есть терминология «оловянная чума».
Раньше люди не знали о таком свойстве олова, поэтому из него изготавливались пуговицы и кружки для солдат, а также прочие полезные вещи, которые после недолгого времени на морозе превращались в порошок. Некоторые историки считают, что именно из-за этого свойства олова снизилась боеспособность армии Наполеона.
Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Химические свойства олова
При комнатной температуре олово довольно устойчиво к воздействию воздуха или воды. Это объясняется тем, что на поверхности металла возникает тонкая оксидная пленка.
На воздухе олово начинает окисляться только при температуре свыше 150 °С:
Если олово нагреть, этот элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4 (она более характерна для этого элемента):
Взаимодействие олова и концентрированной соляной кислоты протекает довольно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, тогда как с разбавленной в реакцию не вступает вообще.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты, H₂SnO₃, которая представляет собой белый аморфный порошок:
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если же олово смешать с разбавленной азотной кислотой, этот элемент будет проявлять металлические свойства с образованием нитрата олова:
4Sn + 10HNO₃ = 4Sn(NO₃)₂ + NH₄NO₃ + 3H₂O
Нагретое олово нагреть может реагировать со щелочами с выделением водорода:
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете безопасные и очень красивые эксперименты с оловом.
Степени окисления олова
В простом состоянии степень окисления олова равняется нулю. Также Sn может иметь степень окисления +2: оксид олова(II) SnO, хлорид олова(II) SnCl₂, гидроксид олова(II) Sn(OH)₂. Степень окисления +4 наиболее характерна для оксида олова(IV) SnO₂, галогенидах(IV), например хлорид SnCl₄, сульфид олова(IV) SnS₂, нитрид олова(IV) Sn₃N₄.
Олово
Общие сведения и методы получения
Олово ( Sn )—серебристо-белый блестящий металл с голубоватым оттенком. Известно с глубокой древности, начало промышленного применения относится к XIV в.
Содержание олова в земной коре 4*10 —3 % (по массе). Всего известно 16 оловосодержащих минералов, представленных оксидами, сульфидами, силикатами, тиостаннатами, боратами, танталитами. Промышленное значение имеют касситерит (оловянный камень) Sn 02 и станнин (оловянный колчедан) CuS — FeS — SnS 2 .
Олово получают нз руд, содержащих касситерит; руды, содержащие олово в виде станнина, в промышленном масштабе не разрабатываются. Руду обогащают методами гравитационного разделения, флотации и магнитной сепарации. Концентрат подвергают предварительной очистке от примесей обжигом (для удаления серы н мышьяка), выщелачиванием соляной кислотой (для удаления железа, висмута, сурьмы, мышьяка) с последующим отделением магнетита и вольфрамита. Очищенный концентрат, содержащий 40—70 % Sn , плавят в смеси с углем н флюсами, получая черновой металл.
Восстановительную плавку ведут в условиях, при которых оксид олова ( Sn 02) восстанавливается до металла, а оксид железа (III) —до оксида (II), переходящего в шлак. Из бедных концентратов олово извлекают хлорированием, основанным на летучести хлоридов олова.
Для получения нз чернового олова металла стандартных сортовых марок его подвергают рафинированию. Наиболее распространенные методы рафинирования — пирометаллургическое (огневое), вакуумное, электролитическое.
Огневое рафинирование состоит из ряда последовательных операций, в каждой из которых удаляется одна-две примеси. От железа черное олово очищают медленным охлаждением расплава и отфильтрованием выпадающих в осадок интерметаллидов, от меди — добавлением в расплав серы и отделением всплывающих ее сульфидов, от мышьяка и сурьмы — введением в расплав алюминия и удалением всплывающих интерметаллидов AlSb и AlAs , от свинца — присадкой хлористого олова, которое взаимодействует со свинцом, образуя удаляемый хлористый свинец. Огневым рафинированием получают металл марки 01, повторением цикла рафинирования —металл марки 01пч.
Вакуумная дистилляция позволяет наиболее эффективно удалять свинец, висмут, а также заметное количество алюминия, кальция, индия.
Прн электролитическом рафинировании достигается высокое прямое извлечение олова в катодный металл, основная масса примесей концентрируется при этом в одном продукте — шламе. Олово высокой чистоты (99,999 %) получают зонной плавкой в кварцевых или графитовых кюветах
Олово всех марок изготавливают в виде чушек, олово марки ОВЧ-000— также в слитках, в виде прутков, а марок 01пч н 01—в виде блоков, пригодных для механизированной транспортировки. Олово следует хранить в закрытом помещении при температуре не ниже 12 «С. В случае обнаружения на олове признаков «оловянной чумы» все слитки направляют на переплавку.
Атомные характеристики. Атомный номер 50, атомная масса 118,69 а. е. м, атомный объем 16,29-10^ 6 м 3 /моль, атомный раднус 0,158 п v , ионный радиус Sn 2+ 0,093 им, Sn ‘ ,+ 0,071 нм. Конфигурация внешних электронных оболочек атома олова 5 s 2 5р 2 . Электроотрица-телыюсть 1,8. Природное олово состоит из десяти изотопов: 112 Sn (0,95%), 1,4 Sn (0,65%), «» Sn (0,34%), 116 Sn (14,24%), ‘» Sn (7,57%), ,18 Sn (24,01%), «» Sn (8,58%), 120 Sn (32,97 %), 122 Sn (4,71%), ,2 » Sn (5,98 %). Последний изотоп слабо радиоактивен.
В соединениях проявляет степень окисления +2 и +4. Нормальный электродный потенциал реакции Sn —2 e ** Sn 2 +ф0=—0,136 В, окислительно-восстановительный потенциал +0,15. Электрохимический эквивалент олова составляет 0,61388 мг/Кл (степень окисления +2); 0,30833 мг/Кл (степень окисления +4).
В атмосферных условиях олово устойчиво, скорость коррозии в закрытом помещении 0,0004 г/(м 2 -сут), в промышленной атмосфере 0,0067 г/(м 2 -сут), в морской атмосфере 0,011 г/(см 2 -сут).
В мягкой пресной н дистиллированной воде олово не корродирует, в жесткой воде при рН = 7,4 и 8,6 скорость коррозии соответственно равна 0,001 н 0,0045 г/(м 2 -сут). В минеральных и галогеноводородных кислотах олово в присутствии кислорода и при повышенной температуре корродирует быстро. Плавиковая и циаинсто-водородная (синильная) кислоты действуют на олово медленно; в лимонной и уксусной кислотах при концентрации их
0,75 % и комнатной температуре скорость коррозии 0,05—0,1 г/(м 2 -сут). В молочной и масляной кислотах концентрацией
1 % при комнатной температуре коррозия незначительна. Олеиновая, стеариновая и щавелевая кислоты сильно действуют иа олово при высоких температурах. Коррозия олова под воздействием фруктовых соков при комнатной температуре составляет 0,1—2,5 г/(м 2 -сут), при температуре кипения возрастает более чем в 10 раз. Смазочные масла, бензин, керосин на олово практически не влияют. Олово сильно корродирует в хлоре, броме и иоде при комнатной температуре, а во фторе при температуре выше 100 °С.
Разбавленные соляная и серная кислоты слабо взаимодействуют с оловом. В концентрированных растворах этих кислот, особенно при нагреве, олово быстро растворяется.
При взаимодействии олова с соляной кислотой образуется хлорид олова (II), а с серной — сульфат олова (IV). С азотной кислотой олово взаимодействует тем интенсивнее, чем выше концентрация кислоты и температура; в случае разбавленной кислоты образуется нитрат олова (II) [ Sn ( N 03)2], а в случае концентрированной — соединения олова (IV), в основном нерастворимая 6-оловянная кислота ( H 2 Sn 03).
Концентрированные щелочи также растворяют олово, прн этом образуются станниты — соли оловянистой кислоты H 2 Sn 02.
На воздухе при комнатной температуре олово не окисляется, благодаря наличию поверхностной пленки Sn 02. Выше 150°С окисляемость увеличивается с образованием SnO и Sn 02.
Оксид олова (II) SnO черного цвета, плотность 6,446 Мг/м 3 , температура плавления 1040″С, температура кипения 1425°С. При нагреве до 400—500 °С SnO легко переходит к оксид олова (IV) Sn 02. Оксид олова (IV) представляет собой белый порошок плотностью 7,009 Мг/м 3 ; температура плавления около 2000 °С.
Сера, сероводород и сернистый газ образуют с оловом сульфиды SnS , Sn 2 S 3 ; SnS 2 .
Сульфид олова (II) SnS получают нагреванием олова с серой и углем примерно до 900 °С. SnS — твердое вещество синевато-черного цвета, плотность 5,080 Мг/м 3 , температура плавления 880 °С, температура кипения 1270°С.
Сульфид олова (IV) SnS 2 получают в виде золотисто-желтых пластинок нагреванием амальгамы олова с серным цветом и хлористым аммонием до
300°С, а аморфный — нагреванием в инертном газе аморфного SnS с серой при —450 °С.
Сульфид олова Sn 2 S 3 — синевато-черные кристаллы; выше 640 °С разлагаются на SnS и S .
Хлорид олова (II) SnCls получают растворением олова в концентрированной соляной кислоте; из растворов оно кристаллизуется в виде белых кристаллов SnCl 2 -2 H 2 0. Плотность SnCl 2 3,950 Мг/м 3 ; температура плавления 247°С, температура кипения 652°С. Хлорид олова (IV) SnCl 4 —бесцветная жидкость, сильно дымящая на воздухе, температура кипения Н4°С, температура плавления —33 °С, плотность 2,230 Мг/м 3 ; хлорид олова (IV) получают действием сухого хлора на жидкое олово.
Другие галогениды Sn (II) и Sn (IV) по способам получения и свойствам во многом сходны с хлоридами.
Гидрид олова SnH 4 можно получить, воздействуя на кислые растворы солей Sn (II) цинком. Это бесцветный ядовитый газ; он сжижается при —52 °С, а при комнатной температуре постепенно разлагается на олово н водород.
С азотом и аммиаком олово ие реагирует, поэтому карбиды олова получают косвенным путем.
С фосфором олово образует белые кристаллические нерастворимые в воде фосфиды: SnP , SnP 3 , Sn 4 P 3 плотностью 6,560, 4,100 и 5,181 Мг/м 3 соответственно.
С углеродом, бором, молибденом, осмием, рением и вольфрамом олово не взаимодействует. С алюминием, висмутом, кадмием, галлием, германием, индием, свинцом, кремнием, таллием и цинком образует простые эвтектические смеси. В твердом состоянии заметно растворяются в олове висмут, кадмий, индий, свинец, сурьма и цинк. Многие металлы в твердом олове практически не растворяются, но образуют металлические соединения.
Олово хорошо поддается выдавливанию ка прутки и проволоку, а также прокатке и ковке. Волочение и вытяжка затруднены, так как олово не упрочняется при комнатной температуре, что приводит к обрывам в местах уменьшенного сечения При изготовлении фольги для улучшения обрабатываемости давлением добавляют сурьму. Линейная усадка олова 2,7 %, объемная усадка 2,8 %, жидкотекучесть 80 см. Обрабатываемость резанием олова удовлетворительная, свариваемость хорошая, возможна пайка мягким припоем.
Рекристаллизация деформированного олова начинается при комнатной температуре; температура рекристаллизации олова при наличии примесей сурьмы, свинца, висмута, меди и алюминия повышается в порядке последовательности перечисления этих элементов.
Олово применяют главным образом дли производства белой жести, различных припоев, баббитов, предохранительных легкоплавких сплавов, бронз, латуней, для изготовления фольги и типографских сплавов. Олово высокой чистоты используют в полупроводниковой технике.
Олово имеет высокую химическую стойкость, соли его безвредны, поэтому этот металл широко применяют для лужения консервных банок и пищевой посуды. Оксид олова (IV) используют в производстве эмалей и глазурей, для полирования стекла. Оксид олова (II) применяют для получения рубинового стекла. Кристаллическое SnS 2 («сусальное золото») входит в состав красок, имитирующих позолоту. Олово является основной легирующей добавкой к серебряным сплавам, применяемым в медицине.
Sn Олово
ОЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710. О происхождении слов «stannum» и «олово» существуют различные догадки. Латинское «stannum», которое иногда производят от саксонского «ста» прочный, твердый, первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Возможно, русское название связано со словами «ол», «оловина» пиво, брага, мед: сосуды из олова использовались для их хранения. В англоязычной литературе для названия олова используется слово tin. Химический символ олова Sn читается «станнум».
Природное олово состоит из девяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124 Sn b -излучатель, его период полураспада очень велик и составляет T1/2 = 10 16 10 17 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s 2 5p 2 . В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn 2+ 0,118 нм и иона Sn 4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
Физические и химические свойства: простое вещество олово полиморфно. В обычных условиях оно существует в виде b -модификации (белое олово), устойчивой выше 13,2°C. Белое олово это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a = 0.5831, c = 0.3181 нм. Координационное окружение каждого атома олова в нем октаэдр. Плотность b -Sn 7,228 г/см 3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в a -модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома тетраэдр, координационное число 4. Фазовый переход b -Sn a -Sn сопровождается увеличением удельного объема на 25,6% (плотность a -Sn составляет 5,75 г/см 3 ), что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность. (Подробнее об «оловянной чуме» см. интересные факты об олове, ссылка внизу этой страницы).
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, b -Sn металл, а a -Sn относится к числу полупроводников. Ниже 3,72 К a -Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E °Sn 2+ /Sn равен 0.136 В, а E пары °Sn 4+ /Sn 2+ 0.151 В.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
С концентрированной соляной кислотой олово медленно реагирует:
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно.
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b -SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова (II):
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn (II), например:
Гидрид олова станнан SnH4 можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C.
Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:
При сильном нагреве оксид олова (II) диспропорционирует:
При хранении на воздухе монооксид SnO постепенно окисляется:
При гидролизе растворов солей олова (IV) образуется белый осадок так называемая a -оловянная кислота:
Свежеполученная a -оловянная кислота растворяется в кислотах и щелочах:
При хранении a -оловянная кислота стареет, теряет воду и переходит в b -оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HOSn группировок при стоянии и замене их на более инертные мостиковые SnOSn связи.
При действии на раствор соли Sn (II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
История открытия: когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы, по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры.
Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе: олово редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10 4 до 8·10 3 % по массе. Основной минерал олова касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) Cu2FeSnS4 (27,5 % Sn).
Получение: для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Применение: важное применение олова лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. Олово способно прокатываться в тонкую фольгу станиоль, такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»).
Искусственный радионуклид олова 119 Sn источник v -излучения в мессбауэровской спектроскопии.
Физиологическое действие: о роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)·10 4 % олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м 3 , ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках 100 мг/кг. Токсическая доза олова для человека 2 г.
http://ibrain.kz/ru/himiya-svoystva-elementov/olovo
http://webelements.narod.ru/elements/Sn.htm