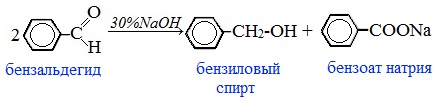
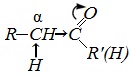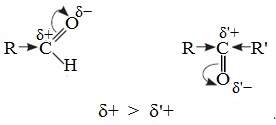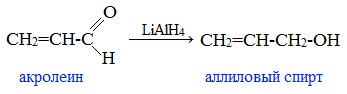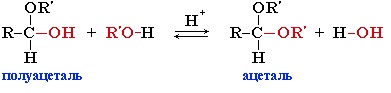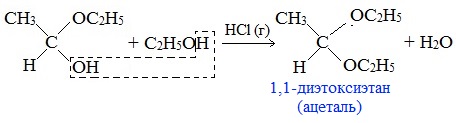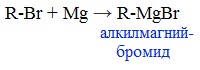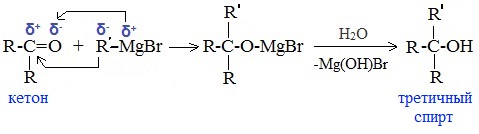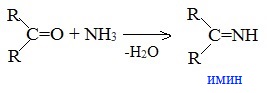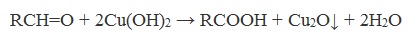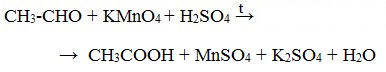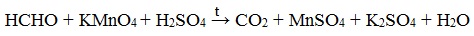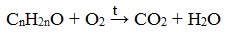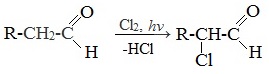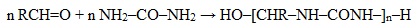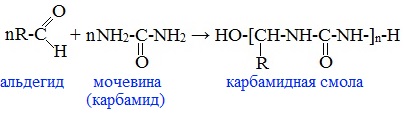Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
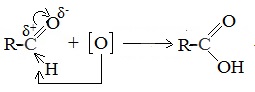
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Формула взаимодействия этаналя с водородом?
Химия | 10 — 11 классы
Формула взаимодействия этаналя с водородом.
СН3СОН + Н2 = С2Н5ОН
Этанола и водород.
Во — первых не формула, а уравнение
СH3COH + H2 = CH3CH2OH из этаналя получится этанол.
) Какова структурная формула алкина, образующего при взаимодействии с бромистым водородом 2 — бром — 1гексен?
) Какова структурная формула алкина, образующего при взаимодействии с бромистым водородом 2 — бром — 1гексен.
2. Напишите реакции : 1) взаимодействия этаналя с водородом ; 2) взаимодействия пропаналя с гидроксидом меди(2) ; 3) дегидрирования метанола ; 4) дегидрирования пентанола — 1?
2. Напишите реакции : 1) взаимодействия этаналя с водородом ; 2) взаимодействия пропаналя с гидроксидом меди(2) ; 3) дегидрирования метанола ; 4) дегидрирования пентанола — 1.
Какой объем водорода необходимо взять для гидрирования 55г этаналя?
Какой объем водорода необходимо взять для гидрирования 55г этаналя.
Напишите уравнение реакции этаналя с водородом?
Напишите уравнение реакции этаналя с водородом.
Взаимодействия этаналя с аммиачным раствором оксида серебра — 1 ( уравнение реакции)?
Взаимодействия этаналя с аммиачным раствором оксида серебра — 1 ( уравнение реакции).
Напишите пожалуйста уравнение реакции взаимодействия этаналя и этилового спирта?
Напишите пожалуйста уравнение реакции взаимодействия этаналя и этилового спирта.
Помогите решить задачу?
Помогите решить задачу.
Массовая доля водорода в смеси этаналя и этанола равна 12.
Найти мольную долю этаналя в смеси?
20 баллов Составьте уравнения реакций, укажите условия их протекания, назовите органические продукты : а) взаимодействие этаналя с водородом ; б) взаимодействие этановой кислоты с пропанолом — 2 ; в) ?
20 баллов Составьте уравнения реакций, укажите условия их протекания, назовите органические продукты : а) взаимодействие этаналя с водородом ; б) взаимодействие этановой кислоты с пропанолом — 2 ; в) взаимодействие триолеин глицерина с водородом.
Отдам 20 Составьте уравнения реакций, укажите условия их протекания, назовите органические продукты : а) взаимодействие этаналя с водородом б) взаимодействие этановой кислоты с пропанолом — 2 в) взаим?
Отдам 20 Составьте уравнения реакций, укажите условия их протекания, назовите органические продукты : а) взаимодействие этаналя с водородом б) взаимодействие этановой кислоты с пропанолом — 2 в) взаимодействие триолеин глицерина с водородом.
1. С какими веществами может реагировать муравьиный альдегид?
1. С какими веществами может реагировать муравьиный альдегид?
А) с кислородом и водородомБ) с водородом и этаналем В) с кислородом и уксусной кислотойГ) с уксусной кислотой и этаналем.
Вы находитесь на странице вопроса Формула взаимодействия этаналя с водородом? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
FeCl3 + NaOH = FeOH + NaCl3 K2CO3 + HNO3 = K2NO3 + H2CO3 BaCl2 + Na2SO4 = BaSO4 + NaCl2.
Селен назван в честь Луны.
HCl ; H2SO4 ; — кислоты ; Cu(NO3)2 ; FeCl3 ; — соли ; Na2O ; BaO ; Mg(OH)2 — основные оксиды ; СО2 — кислотный оксид ; KOH — основание( гидроксид калия).
Ответ второй и четвертый.
BaCl2 + 2H2O — > Cl2 + H2 + Ba(OH)2 Ba(OH)2 + H2SO4 — > BaSO4 + 2H2O.
Рассчитывается по числу молекул. Здесь будет 5 ионов.
CO2 + H2O H2CO3 (реакция обратимая, так как кислота неустойчива) Не уверена.
Уравнение реакции взаимодействия этаналя с водородом реакция
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью >C=O.
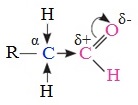
1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (C δ+ ), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву π-связи и образованию более прочной σ-связи.
2. Высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой (α-углеродном атоме), повышенную полярность связи С-Н α-углеродного атома. Это характеризует данные соединения как СН-кислоты.
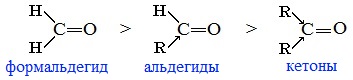
Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN).
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Самый активный из альдегидов – формальдегид Н2СО.
Сравнение реакционной способности альдегидов и кетонов
При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный.
Альдегиды более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жестких условиях, чем альдегиды, а в некоторые реакции даже и не вступают.
Электронный фактор связан с величиной положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R’.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R’, а в молекулах альдегидов одного радикала R, поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.
Пространственный фактор связан с доступностью реакционного центра (C δ+ ) для нуклеофильной атаки, а это зависит от размеров заместителей R и R’.
В молекулах альдегидов (содержат один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами, поэтому нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда δ + на атоме углерода в карбонильной группе. Чем этот заряд больше, тем выше химическая активность карбонильного соединения.
- Углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп.
- Углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на атоме углерода карбонильной группы, что затрудняет присоединение нуклеофильного реагента.
Для карбонильных соединений характерны реакции:
- присоединение по карбонильной группе;
- реакции замещения у α-углеродного атома;
- полимеризация;
- поликонденсация;
- окисление.
Реакции присоединения
Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN.
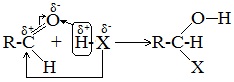
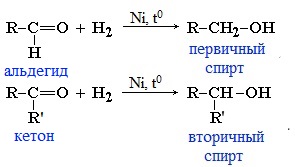
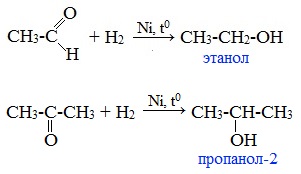
1. Гидрирование (восстановление)
Реакцию восстановления альдегидов и кетонов широко используют для получения спиртов. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов (Ni, Pt, Pd).
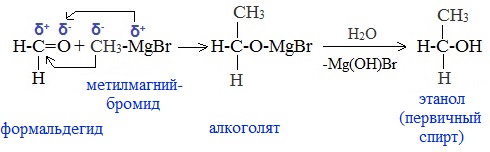
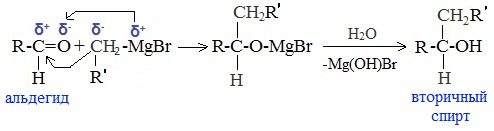
В результате образуются спирты соответствующего строения. Гидрирование альдегидов приводит к образованию первичных спиртов, гидрирование кетонов – ко вторичным.
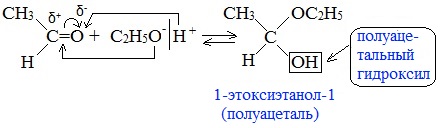
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, а при гидрировании ацетона – пропанол-2:
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития (тетрагидроалюминат лития) LiAlH4:
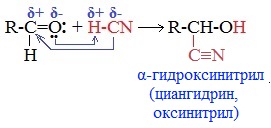
2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу 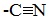
Присоединение идет в соответствии с распределением электронной плотности в молекулах:
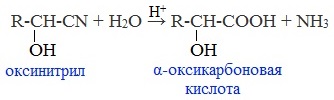
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи. А также для получения α-гидроксикислот R-CH (COOH) OH:
Циангидрин CH3— CH(CN) — OH — яд! Он содержится в ядрах косточек вишен, слив, персика.
Циангидрины используют как промежуточные соединения в синтезах окси- и аминокислот. Некоторые циангидрины встречаются в растениях. Употребление таких растений в пищу может привести к тяжелым отравлениям вследствие высвобождения синильной кислоты в организме.
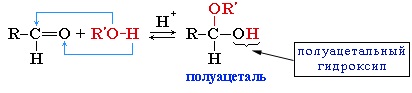
3. Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора)
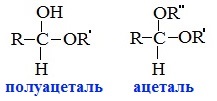
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали или ацетали.
Полуацетали — соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (ОR) группы.
Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы.
Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
Ацетали обладают приятным цветочным ароматом. Именно образованием ацеталей обусловлен букет выдержанных вин.
Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол.
Кетоны в этих условиях кетали не образуют.
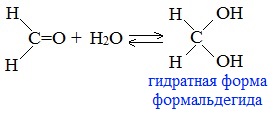
4. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
Эта реакция возможна только для формальдегида и уксусного альдегида.
Кетоны не реагируют с водой.
5. Присоединение реактива Гриньяра — образование спиртов
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют с водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
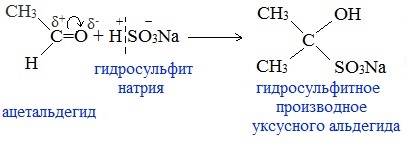
6. Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов
Качественная реакция на альдегидную группу!
Альдегиды при встряхивании с концентрированным раствором гидросульфита натрия образуют кристаллические соединения:
С помощью этой реакции выделяют альдегиды из смесей с другими веществами и для получения их в чистом виде.
7. Взаимодействие с аммиаком
При взаимодействии с аммиаком образуются имины:
Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С-Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению.
Альдегиды легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(ОН)=О.
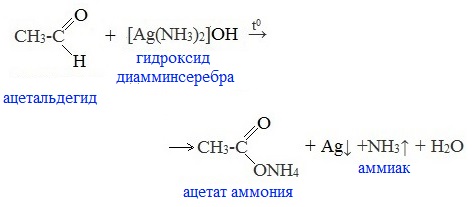
1. Реакция «серебряного зеркала» — окисление аммиачным раствором оксида серебра (реактив Толленса)
Качественная реакция на альдегидную группу!
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
Видеоопыт «Реакция «серебряного зеркала»
Реакцию «серебряного зеркала» широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Кетоны не вступают в эту реакцию.
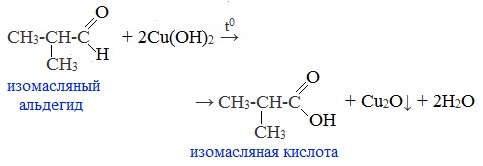
2. Окисление гидроксидом меди (II)
Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):
Альдегид окисляется до соответствующей ему карбоновой кислоты.
Видеоопыт «Качественная реакция на альдегиды с гидроксидом меди (II)»
Кетоны в эту реакцию не вступают.
3. Реакция на альдегиды с фуксиносернистой кислотой
Качественная реакция на альдегидную группу!
Краситель красного цвета — фуксин, при насыщении его раствора газообразным сернистым ангидридом (SO2) образует бесцветный раствор фуксиносернистой кислоты. Этот реактив при взаимодействии с альдегидами дает красно-фиолетовое окрашивание, что является качественной реакцией на альдегидную группу.
Видеоопыт «Качественная реакция на альдегиды с фуксинсернистой кислотой»
Кетоны не вступают в эту реакцию.
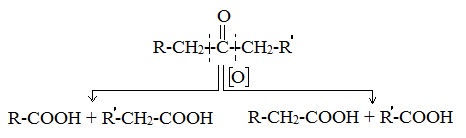
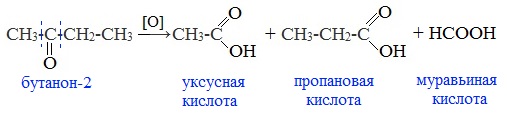
Кетоны окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот с более короткой углеродной цепью:
4. Окисление перманганатом калия
Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании:
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой кислоты.
Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому что соответствующая ему муравьиная кислота неустойчива к действию сильных окислителей:
Для кетонов эта реакция не имеет практического значения, так как происходит разрушение молекулы и в результате получается смесь продуктов.
5. Горение (полное окисление)
Альдегиды и кетоны сгорают до углекислого газа и воды:
Реакции замещения
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.
Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами.
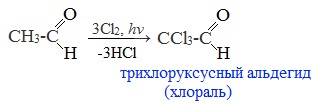
При избытке галогена замещению подвергаются все атомы водорода при ɑ-углеродном атоме:
Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также различные гербициды.
При растворении хлораля в воде образуется хлоралгидрат ССl3CH (OH)2.
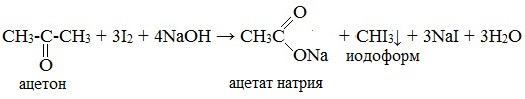
2. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на метилкетоны и ацетальдегид!
Иодоформная реакция – обработка карбонильного соединения избытком иода в присутствии щелочи. Выпадение желтого осадка иодоформа указывает на наличие в исходном соединении метильной группы, связанной с карбонилом:
Иодоформ широко используется как антисептик в медицине и ветеринарии.
Реакции полимеризации
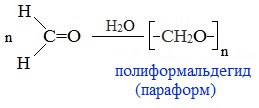
Полимеризация — частный случай реакций присоединения — характерна в основном для альдегидов.
1. Линейная полимеризация
При испарении или длительном стоянии 40% водного раствора формальдегида (формалина) образуется полимер формальдегида в виде белого осадка с невысокой молекулярной массой – параформ:
Параформ используют для изготовления волокон, пленок и других изделий.
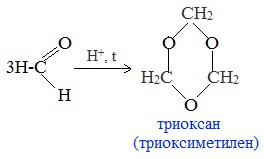
2. Циклическая полимеризация (тримеризация, тетрамеризация)
При взаимодействии молекул альдегидов возможно также образование циклических соединений.
а) Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Триоксан используется для получения полиформальдегида (полиоксиметилена) с высокой молекулярной массой, обладающего повышенной стабильностью и механической прочностью.
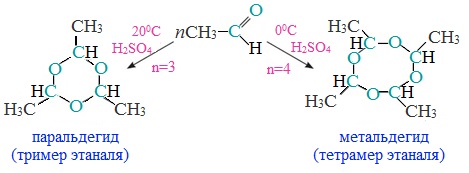
б) Полимеризация ацетальдегида в присутствии следов серной кислоты приводит к образованию в зависимости от условий двух циклических продуктов — паральдегида и метальдегида. Паральдегид образуется, если реакцию проводить при 20 0 С, а метальдегид — при 0 0 С:
Паральдегид — жидкость (т. кип. 128 0 С), метальдегид — твердое вещество, используется в быту как сухое горючее под названием «сухой спирт».
Реакции поликонденсации
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула. Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.
1. Конденсация с фенолами
Практическое значение имеет реакция формальдегида с фенолом (катализаторы — кислоты или основания).
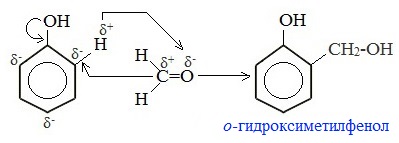
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолспирта:
Для фенола эта реакция электрофильного замещения (SE), а для формальдегида – нуклеофильного присоединения (АN).
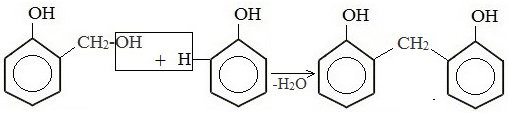
Образовавшееся соединение взаимодействует далее с фенолом с выделением молекулы воды:
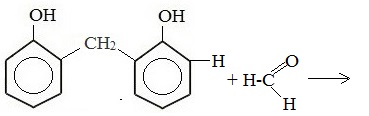
Новое соединение взаимодействует с формальдегидом:
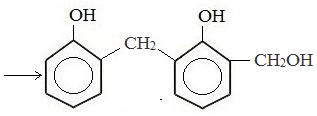
Это соединение конденсируется с фенолом, затем снова с формальдегидом и т.д.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы – фенопласты.
Фенопласты – важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливают большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
2. Конденсация альдегидов с карбамидом (мочевиной) (NH2)2C=O — получение карбамидных (мочевино-формальдегидных) смол
Видеоопыт «Поликонденсация формальдегида и мочевины (получение пенопласта)»
3. Конденсация формальдегида с меламином С3Н6N6 (меламино-формальдегидные смолы)
Меламино-формальдегидные смолы применяют для пропитки бумаги, картона и тканей с целью придания им водостойкости, несминаемости и снижения усадки.
Важно! Посуда, изготовленная из меламино-формальдегидных полимеров (неправильно называемых «меламином»), обычно ярко оформлена, токсична и очень опасна для здоровья.
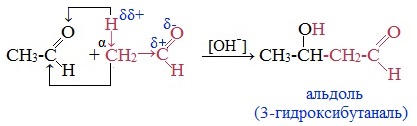
4. Альдольно-кротоновая конденсация
При альдольной конденсации происходит присоединение одной молекулы карбонильного соединения к другой молекуле, образуется альдегидоспирт (альдоль) или кетоноспирт (кетол).
Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль:
Альдольная конденсация широко используется в промышленности для получения синтетических каучуков, смол, лаков и различных душистых веществ.
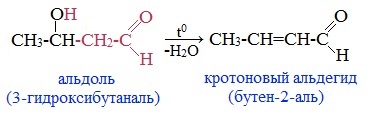
При кротоновой конденсации образуется молекула непредельного альдегида или кетона. Химическая реакция сопровождается выделением молекулы воды.
Реакция проводится в более жестких условиях (при нагревании или в присутствии кислоты) альдоль дегидратируется с образованием кротонового альдегида:
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в α-звене, на которое действует –I-эффекты двух групп (ОН и С=О).
Соединения, содержащие третичный углеродный атом возле карбонильной группы не вступают в реакцию альдольной конденсации.
Впервые эти конденсации осуществили одновременно (1872 г.) и независимо друг от друга А.П. Бородин и Ш.А. Вюрц.
Реакции диспропорционирования
Реакция Канниццаро
Важной в промышленности реакцией самоокисления-самовосстановления является реакция Канниццаро.
Альдегиды, не содержащие атом водорода у α-углеродного атома, в щелочной среде способны вступать в окислительно-восстановительную реакцию (диспропорционирования):
Одна молекула альдегида при этом окисляется до карбоновой кислоты, а другая молекула восстанавливается до спирта.
http://himia.my-dict.ru/q/5002240_formula-vzaimodejstvia-etanala-s-vodorodom/
http://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/ximicheskie-svojstva-aldegidov-i-ketonov.html