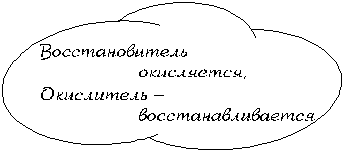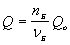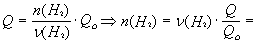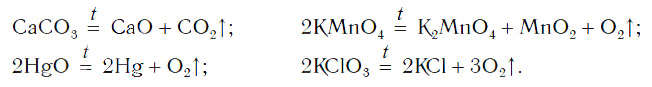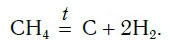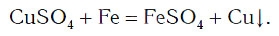Уравнение реакции замещения в химии
9.1. Какие бывают химические реакции
Вспомним, что химическими реакциями мы называем любые химические явления природы. При химической реакции происходит разрыв одних и образование других химических связей. В результате реакции из одних химических веществ получаются другие вещества (см. гл. 1).
Выполняя домашнее задание к § 2.5, вы познакомились с традиционным выделением из всего множества химических превращений реакций четырех основных типов, тогда же вы предложили и их названия: реакции соединения, разложения, замещения и обмена.
| Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. |
Примеры реакций соединения:
| Реакции разложения – химические реакции, в которых из одного сложного по элементному составу вещества получаются два или несколько менее сложных веществ. |
Примеры реакций разложения:
2Ag2O 
CaCO3 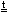
(NH4)2Cr2O7 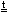
| Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе. |
Примеры реакций замещения:
CuSO4 + Fe = FeSO4 + Cu ; (7)
2NaI + Cl2 = 2NaCl + I2; (8)
CaCO3 + SiO2 = CaSiO3 + CO 2 . (9)
| Реакции обмена – химические реакции, в которых исходные вещества как бы обмениваются своими составными частями. |
Примеры реакций обмена:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10)
HCl + KNO2 = KCl + HNO2; (11)
AgNO3 + NaCl = AgCl + NaNO3. (12)
Традиционная классификация химических реакций не охватывает все их разнообразие – кроме реакций четырех основных типов существует еще и множество более сложных реакций.
Выделение двух других типов химических реакций основано на участии в них двух важнейших нехимических частиц: электрона и протона.
При протекании некоторых реакций происходит полная или частичная передача электронов от одних атомов к другим. При этом степени окисления атомов элементов, входящих в состав исходных веществ, изменяются; из приведенных примеров это реакции 1, 4, 6, 7 и 8. Эти реакции называются окислительно-восстановительными.
| Окислительно-восстановительные реакции (ОВР) – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ. |
В другой группе реакций от одной реагирующей частицы к другой переходит ион водорода (Н + ), то есть протон. Такие реакции называют кислотно-основными реакциями или реакциями с передачей протона.
| Кислотно-основные реакции (КОР) – химические реакции, сопровождающиеся передачей протона. |
Среди приведенных примеров такими реакциями являются реакции 3, 10 и 11. По аналогии с этими реакциями окислительно-восстановительные реакции иногда называют реакциями с передачей электрона. С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах.

а) HgO Hg + O2
(t); б) Li2O + SO2
Li2SO3; в) Cu(OH)2
CuO + H2O
(t);
г) Al + I2 AlI3; д) CuCl2 + Fe
FeCl2 + Cu
; е) Mg + H3PO4
Мg3(PO4)2 + H2
;
ж) Al + O2 Al2O3 (t); и) KClO3 + P P2O5 + KCl (t); к) CuSO4 + Al
Al2(SO4)3 + Cu
;
л) Fe + Cl2 FeCl3 (t); м) NH3 + O2
N2 + H2O (t); н) H2SO4 + CuO
CuSO4 + H2O.
Укажите традиционный тип реакции. Отметьте окислительно-восстановительные и кислотно-основные реакции. В окислительно-восстановительных реакциях укажите, атомы каких элементов меняют свои степени окисления.
Рассмотрим окислительно-восстановительную реакцию, протекающую в доменных печах при промышленном получении железа (точнее, чугуна) из железной руды:
Определим степени окисления атомов, входящих в состав как исходных веществ, так и продуктов реакции
+III –II
+II –II
+IV –II
3CO
Как видите, степень окисления атомов углерода в результате реакции увеличилась, степень окисления атомов железа уменьшилась, а степень окисления атомов кислорода осталась неизменной. Следовательно, атомы углерода в этой реакции подверглись окислению, то есть потеряли электроны (окислились), а атомы железа – восстановлению, то есть присоединили электроны (восстановились) (см. § 7.16). Для характеристики ОВР используют понятия окислитель и восстановитель.
| Атомы-окислители – атомы, принимающие электроны в ходе данной ОВР. |
| Атомы-восстановители – атомы, отдающие электроны в ходе данной ОВР. |
Таким образом, в нашей реакции атомами-окислителями являются атомы железа, а атомами-восстановителями – атомы углерода.
| Вещество-окислитель – исходное вещество данной ОВР, содержащее атомы-окислители |
| Вещество-восстановитель – исходное вещество данной ОВР, содержащее атомы-восстановители. |
В нашей реакции веществом-окислителем является оксид железа(III), а веществом-восстановителем – оксид углерода(II).
В тех случаях, когда атомы-окислители и атомы-восстановители входят в состав одного и того же вещества (пример: реакция 6 из предыдущего параграфа), понятия » вещество-окислитель» и » вещество-восстановитель» не используются.
Таким образом, типичными окислителями являются вещества, в состав которых входят атомы, склонные присоединять электроны (полностью или частично), понижая свою степень окисления. Из простых веществ это прежде всего галогены и кислород, в меньшей степени сера и азот. Из сложных веществ – вещества, в состав которых входят атомы в высших степенях окисления, не склонные в этих степенях окисления образовывать простые ионы: HNO3 (N +V ), KMnO4 (Mn +VII ), CrO3 (Cr +VI ), KClO3 (Cl +V ), KClO4 (Cl +VII ) и др.
Типичными восстановителями являются вещества, в состав которых входят атомы, склонные полностью или частично отдавать электроны, повышая свою степень окисления. Из простых веществ это водород, щелочные и щелочноземельные металлы, а также алюминий. Из сложных веществ – H2S и сульфиды (S –II ), SO2 и сульфиты (S +IV ), йодиды (I –I ), CO (C +II ), NH3 (N –III ) и др.
В общем случае почти все сложные и многие простые вещества могут проявлять как окислительные, так и восстановительные свойства. Например:
SO2 + Cl2 = S + Cl2O2 (SO2 – сильный восстановитель);
SO2 + C = S + CO2 (t) (SO2 – слабый окислитель);
C + O2 = CO2(t) (C – восстановитель);
C + 2Ca = Ca2C (t) (С – окислитель).
Вернемся к реакции, разобранной нами в начале этого параграфа.
+III -II
+II -II
+IV -II
3CO
Обратите внимание, что в результате реакции атомы-окислители (Fe +III ) превратились в атомы-восстановители (Fe 0 ), а атомы-восстановители (C +II ) превратились в атомы-окислители (C +IV ). Но CO2 в любых условиях очень слабый окислитель, а железо, хоть и является восстановителем, но в данных условиях значительно более слабым, чем CO. Поэтому продукты реакции не реагируют друг с другом, и обратная реакция не протекает. Приведенный пример является иллюстрацией общего принципа, определяющего направление протекания ОВР:
Окислительно-восстановительные реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя.
Окислительно-восстановительные свойства веществ можно сравнивать только в одинаковых условиях. В некоторых случаях это сравнение может быть проведено количественно.
Выполняя домашнее задание к первому параграфу этой главы, вы убедились, что подобрать коэффициенты в некоторых уравнениях реакций (особенно ОВР) довольно сложно. Для упрощения этой задачи в случае окислительно-восстановительных реакций используют следующие два метода:
а) метод электронного баланса и
б) метод электронно-ионного баланса.
Метод электронного баланса вы изучите сейчас, а метод электронно-ионного баланса обычно изучается в высших учебных заведениях.
Оба эти метода основаны на том, что электроны в химических реакциях никуда не исчезают и ниоткуда не появляются, то есть число принятых атомами электронов равно числу электронов, отданных другими атомами.
Число отданных и принятых электронов в методе электронного баланса определяется по изменению степени окисления атомов. При использовании этого метода необходимо знать состав как исходных веществ, так и продуктов реакции.
Рассмотрим применение метода электронного баланса на примерах.
Пример 1. Составим уравнение реакции железа с хлором. Известно, что продуктом такой реакции является хлорид железа(III). Запишем схему реакции:
Fe + Cl2 FeCl3.
Определим степени окисления атомов всех элементов, входящих в состав веществ, участвующих в реакции:
+III –I
FeCl3.
Атомы железа отдают электроны, а молекулы хлора их принимают. Выразим эти процессы электронными уравнениями:
Fe – 3e – = Fe +III ,
Cl2 + 2e – = 2Cl –I .
Чтобы число отданных электронов было равно числу принятых, надо первое электронное уравнение умножить на два, а второе – на три:
2
3
Cl2 + 2e – = 2Cl –I
3Cl2 + 6e – = 6Cl –I .
Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции:
2Fe + 3Cl2 = 2FeCl3.
Пример 2. Составим уравнение реакции горения белого фосфора в избытке хлора. Известно, что в этих условиях образуется хлорид фосфора(V):
0
Молекулы белого фосфора отдают электроны (окисляются), а молекулы хлора их принимают (восстанавливаются):
| P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | 1 10 | 2 20 | P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | P4 – 20e – = 4P +V 10Cl2 + 20e – = 20Cl –I |
Полученные первоначально множители (2 и 20) имели общий делитель, на который (как будущие коэффициенты в уравнении реакции) и были разделены. Уравнение реакции:
Пример 3. Составим уравнение реакции, протекающей при обжиге сульфида железа(II) в кислороде.
+II –II
0
FeS
Fe2O3
В этом случае окисляются и атомы железа(II), и атомы серы(– II). В состав сульфида железа(II) атомы этих элементов входят в отношении 1:1 (см. индексы в простейшей формуле).
Электронный баланс:
| 4 | Fe +II – e – = Fe +III S –II – 6e – = S +IV | Всего отдают 7е – |
| 7 | O2 + 4e – = 2O –II |
Пример 4. Составим уравнение реакции, протекающей при обжиге дисульфида железа(II) (пирита) в кислороде.
0
FeS2
Fe2O3
Как и в предыдущем примере, здесь тоже окисляются и атомы железа(II), и атомы серы, но со степенью окисления – I. В состав пирита атомы этих элементов входят в отношении 1:2 (см. индексы в простейшей формуле). Именно в этом отношении атомы железа и серы вступают в реакцию, что и учитывается при составлении электронного баланса:
4
2S –I – 10e – = 2S +IV
11
Встречаются и более сложные случаи ОВР, с некоторыми из них вы познакомитесь, выполняя домашнее задание.

2.Составьте уравнения ОВР, обнаруженных вами при выполнении задания к § 1 этой главы. На этот раз для расстановки коэффициентов используйте метод электронного баланса. 3.Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам: а) Na + I2 NaI;
б) Na + O2 Na2O2;
в) Na2O2 + Na Na2O;
г) Al + Br2 AlBr3;
д) Fe + O2 Fe3O4 (t);
е) Fe3O4 + H2 FeO + H2O (t);
ж) FeO + O2 Fe2O3 (t);
и) Fe2O3 + CO Fe + CO2 (t);
к) Cr + O2 Cr2O3 (t);
л) CrO3 + NH3 Cr2O3 + H2O + N2 (t);
м) Mn2O7 + NH3 MnO2 + N2 + H2O;
н) MnO2 + H2 Mn + H2O (t);
п) MnS + O2 MnO2 + SO2 (t)
р) PbO2 + CO Pb + CO2 (t);
с) Cu2O + Cu2S Cu + SO2 (t);
т) CuS + O2 Cu2O +SO2 (t);
у) Pb3O4 + H2 Pb + H2O (t).
Почему происходят химические реакции?
Для ответа на этот вопрос вспомним, почему отдельные атомы объединяются в молекулы, почему из изолированных ионов образуется ионный кристалл, почему при образовании электронной оболочки атома действует принцип наименьшей энергии. Ответ на все эти вопросы один и тот же: потому, что это энергетически выгодно. Это значит, что при протекании таких процессов выделяется энергия. Казалось бы, что и химические реакции должны протекать по этой же причине. Действительно, можно провести множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
| Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. |
Если при экзотермической реакции теплота не успевает отводиться, то реакционная система нагревается.
Например, в реакции горения метана
выделяется столько теплоты, что метан используется как топливо.
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравнении реакции:
Это так называемое термохимическое уравнение. Здесь символ «+Q» означает, что при сжигании метана выделяется теплота. Эта теплота называется тепловым эффектом реакции.
Откуда же берется выделяющаяся теплота?
Вы знаете, что при химических реакциях рвутся и образуются химические связи. В данном случае рвутся связи между атомами углерода и водорода в молекулах СН4, а также между атомами кислорода в молекулах О2. При этом образуются новые связи: между атомами углерода и кислорода в молекулах СО2 и между атомами кислорода и водорода в молекулах Н2О. Для разрыва связей нужно затратить энергию (см. «энергия связи» , «энергия атомизации» ), а при образовании связей энергия выделяется. Очевидно, что, если «новые» связи более прочные, чем «старые» , то энергии выделится больше, чем поглотится. Разность между выделившейся и поглощенной энергией и составляет тепловой эффект реакции.
Тепловой эффект (количество теплоты) измеряется в килоджоулях, например:
Такая запись означает, что 484 килоджоуля теплоты выделится, если два моля водорода прореагируют с одним молем кислорода и при этом образуется два моля газообразной воды (водяного пара).
Таким образом, в термохимических уравнениях коэффициенты численно равны количествам вещества реагентов и продуктов реакции.
| Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
От чего зависит тепловой эффект каждой конкретной реакции?
Тепловой эффект реакции зависит
а) от агрегатных состояний исходных веществ и продуктов реакции,
б) от температуры и
в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении.
Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов:
(г) – газ,
(ж) – жидкость,
(т) или (кр) – твердое или кристаллическое вещество.
Зависимость теплового эффекта от температуры связана с различиями в теплоемкостях исходных веществ и продуктов реакции.
Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме.
Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 25 ° С и обозначают символом Qo.
Если энергия выделяется только в виде теплоты, а химическая реакция протекает при постоянном объеме, то тепловой эффект реакции (QV) равен изменению внутренней энергии (D U) веществ-участников реакции, но с противоположным знаком:
QV = – U.
Под внутренней энергией тела понимают суммарную энергию межмолекулярных взаимодействий, химических связей, энергию ионизации всех электронов, энергию связей нуклонов в ядрах и все прочие известные и неизвестные виды энергии, » запасенные» этим телом. Знак » – » обусловлен тем, что при выделении теплоты внутренняя энергия уменьшается. То есть
U = – QV .
Если же реакция протекает при постоянном давлении, то объем системы может изменяться. На совершение работы по увеличению объема также уходит часть внутренней энергии. В этом случае
U = – (QP + A) = –(QP + P V),
где Qp – тепловой эффект реакции, протекающей при постоянном давлении. Отсюда
QP = – U – P V .
Величина, равная U + P V получила название изменение энтальпии и обозначается D H.
H = U + P V.
QP = – H.
Таким образом, при выделении теплоты энтальпия системы уменьшается. Отсюда старое название этой величины: » теплосодержание» .
В отличие от теплового эффекта, изменение энтальпии характеризует реакцию независимо от того, протекает она при постоянном объеме или постоянном давлении. Термохимические уравнения, записанные с использованием изменения энтальпии, называются термохимическими уравнениями в термодинамической форме. При этом приводится значение изменения энтальпии в стандартных условиях (25 °С, 101,3 кПа), обозначаемое Hо. Например:
2Н2(г) + О2(г) = 2Н2О(г) Hо = – 484 кДж;
CaO(кр) + H2O(ж) = Сa(OH)2(кр) Hо = – 65 кДж.
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (Qo) и количества вещества (nБ) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
Здесь Б – количество вещества Б, задаваемое коэффициентом перед формулой вещества Б в термохимическом уравнении.
Задача
Определите количество вещества водорода, сгоревшего в кислороде, если при этом выделилось 1694 кДж теплоты.
Решение
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
(Н2) = 2 моль,
Qo = 484 кДж.
= 2 мольЧ (1694 кДж/484 кДж) = 7 моль.

2.Как вы думаете, может ли реакционная система при протекании экзотермической реакции охлаждаться?
3.Какое количество теплоты выделится при сгорании 320 г серы в кислороде по реакции:
4.Какое количество теплоты выделится при сгорании 405 г алюминия в кислороде по реакции:
5.Определите объем водорода, прореагировавшего с кислородом (объему газов измерены при н. у.), если при этом выделилось 114,4 кДж теплоты.
6.Тепловой эффект реакции взаимодействия кристаллического алюминия с газообразным хлором равен 1408 кДж. Запишите термохимическое уравнение этой реакции и определите массу алюминия, необходимого для получения 2816 кДж теплоты с использованием этой реакции.
7.Определите количество теплоты, выделяющейся при сгорании на воздухе 1 кг угля, содержащего 90 % графита, если тепловой эффект реакции горения графита в кислороде равна 394 кДж.
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
| Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Таким образом, энергия, выделяющаяся при образовании связей в продуктах этих и им подобных реакций, меньше, чем энергия, необходимая для разрыва связей в исходных веществах.
Что же является причиной протекания таких реакций, ведь энергетически они невыгодны?
Раз такие реакции возможны, значит существует какой-то неизвестный нам фактор, являющийся причиной их протекания. Попробуем его обнаружить.
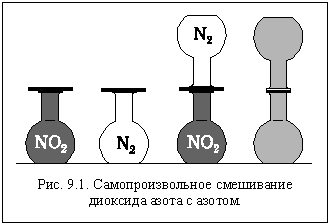
Возьмем две колбы и заполним одну из них азотом (бесцветный газ), а другую – диоксидом азота (бурый газ) так, чтобы и давление, и температура в колбах были одинаковыми. Известно, что эти вещества между собой не вступают в химическую реакцию. Герметично соединим колбы горлышками и установим их вертикально, так, чтобы колба с более тяжелым диоксидом азота была внизу (рис. 9.1). Через некоторое время мы увидим, что бурый диоксид азота постепенно распространяется в верхнюю колбу, а бесцветный азот проникает в нижнюю. В результате газы смешиваются, и окраска содержимого колб становится одинаковой.
Что же заставляет газы смешиваться?
Хаотическое тепловое движение молекул.
Приведенный опыт показывает, что самопроизвольно, без какого бы то ни было нашего (внешнего) воздействия может протекать процесс, тепловой эффект которого равен нулю. А он действительно равен нулю, потому что химического взаимодействия в данном случае нет (химические связи не рвутся и не образуются), а межмолекулярное взаимодействие в газах ничтожно и практически одинаково.
Наблюдаемое явление представляет собой частный случай проявления всеобщего закона Природы, в соответствии с которым системы, состоящие из большого числа частиц, всегда стремятся к наибольшей неупорядоченности.
Мерой такой неупорядоченности служит физическая величина, называемая энтропией.
| Энтропия – физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ,
чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ.
Уравнения связи между энтропией (S) и другими величинами изучаются в курсах физики и физической химии. Единица измерений энтропии [S] = 1 Дж/К.
Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние.
Что же произошло в нашем опыте?
При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса.
Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся!
Итак, мы с вами обнаружили два фактора, определяющих возможность протекания многих процессов, в том числе и химических реакций:
1) стремление системы к минимуму энергии (энергетический фактор) и
2) стремление системы к максимуму энтропии (энтропийный фактор).
Посмотрим теперь, как влияют на возможность протекания химических реакций различные комбинации этих двух факторов.
1. Если в результате предполагаемой реакции энергия продуктов реакции оказывается меньше, чем энергия исходных веществ, а энтропия больше (» под гору к большему беспорядку» ), то такая реакция может протекать и будет экзотермической.
2. Если в результате предполагаемой реакции энергия продуктов реакции оказывается больше, чем энергия исходных веществ, а энтропия меньше (» в гору к большему порядку» ), то такая реакция не идет.
3. Если в предполагаемой реакции энергетический и энтропийный факторы действуют в разные стороны (» под гору, но к большему порядку» или » в гору, но к большему беспорядку» ), то без специальных расчетов сказать что-либо о возможности протекания такой реакции нельзя (» кто перетянет» ). Подумайте, к какому из этих случаев относятся эндотермические реакции.
Возможность протекания химической реакции можно оценить, рассчитав изменение в ходе реакции физической величины, зависящей как от изменения энтальпии, так и от изменения энтропии в этой реакции. Такая физическая величина называется энергией Гиббса (в честь американского физикохимика XIX в. Джозайя Уилларда Гиббса).
G = H – T S
Условие самопроизвольного протекания реакции:
G
| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
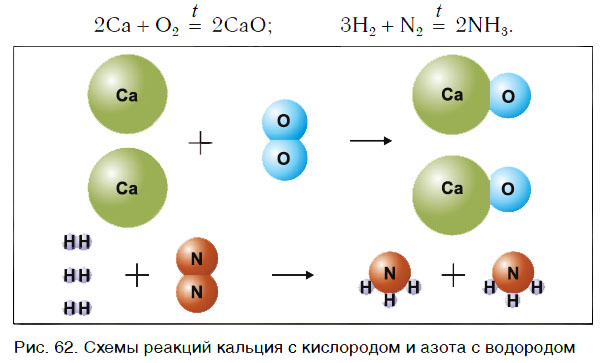
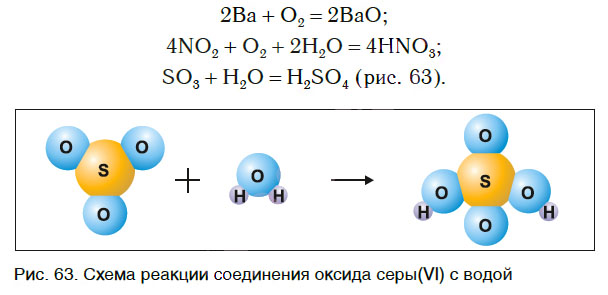
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
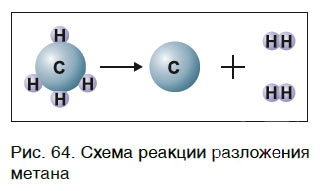
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
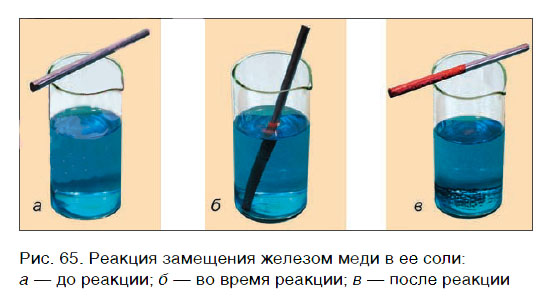
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Реакции замещения
Тип урока. Приобретение новых знаний.
Вид урока. Лабораторная работа.
Обучающие – рассмотреть новый тип реакций – реакции замещения; научить учащихся писать уравнения реакций замещения; формировать умение предсказывать продукты реакций замещения; дать первоначальные понятия об электрохимическом ряде напряжений металлов.
Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к адекватному само- и взаимоконтролю.
Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «ученик–ученик», «учитель–ученик», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы. Лабораторная работа; фронтальный опрос; самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок; работа с наглядными средствами – периодической системой химических элементов Д.И.Менделеева и карточками.
Оборудование и реактивы. Кодоскоп, карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения», карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ», лабораторный штатив с пробирками, кристаллизатор, прибор для получения водорода, лучинка, спички; цинк и магний в гранулах, железный гвоздь, медная проволока, растворы – соляной кислоты, хлорида меди(II), хлорида железа(II).
Учитель. Думаю, что урок вам понравится, вы узнаете много нового. Сегодня вы не соскучитесь, потому что сами будете проводить опыты. Но для начала проверим материал прошлого урока.

Проводится фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (Габриелян О.С. «Химия-8», М.: изд-во «Дрофа», 2002, упр. 1а, б; 2г; с. 100.)
Учитель. На прошлом уроке* вы познакомились с классификацией химических реакций. По каким признакам классифицируют реакции?
Ученик. Реакции классифицируют по количеству вступивших и образовавшихся веществ и по их составу.
Учитель. С реакциями каких типов вы познакомились?
Ученик. С реакциями разложения и соединения.
Учитель. Дайте определение реакции разложения.
Ученик. Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель. Какая реакция называется реакцией соединения?
Ученик. Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Учитель. Для чего в схемах химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался закон сохранения массы веществ.
Учитель проверяет домашние упражнения, выполненные на доске, ученики задают дополнительные вопросы отвечающим, выставляются оценки.
Задание 1а, б, с. 100. Запишите в виде химических уравнений следующие предложения:
а) при обжиге карбоната кальция образуются оксид кальция и оксид углерода(IV);
б) при взаимодействии оксида фосфора(V) с водой образуется фосфорная кислота.
Укажите типы этих реакций. Какая из них экзотермическая, а какая – эндотермическая?
Первая – реакция разложения, эндотермическая:
СаСО3 
Вторая – реакция соединения, экзотермическая:
Задание 2г, с. 100. Составьте уравнение по следующей схеме и укажите тип реакции:
СuОН 
Под формулами веществ напишите их названия.
Тип реакции – разложение:
Учитель. Следующий этап урока – самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты, укажите типы химических реакций.
1) MgO + CO2 
2) NO2 + O2 + H2O 
3) Na2O + H2O 
4) KClO3 
5) CO + O2 
1) KNO3 
2) SO2 + O2 
3) SO3 + H2O 
4) K2O + H2O 
5) NO + O2 
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанный тип химической реакции и по 1 баллу за правильно расставленные коэффициенты).
На «5» – 10–9 баллов,
на «4» – 8–7 баллов,
на «3» – 6–5 баллов.
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Ученики взаимно проверяют работы с помощью кодоскопа, им выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще с одним типом химических реакций – реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться, потренируетесь в расстановке коэффициентов.

Учитель. Какие ассоциации вызывает у вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим.
Учитель. Каким по составу – простым или сложным – должно быть вещество, которое замещает элемент сложного вещества?
Ученик. Простым.
Учитель. Каким должен быть состав вещества, в котором происходит замещение?
Ученик. Это вещество должно быть сложным, чтобы атомы одного элемента могли замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество буквой А, а сложное вещество – двумя буквами – ВС. Как в этом случае записать общую схему реакции замещения?
Ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу (табл. 1), которую начали заполнять на прошлом уроке.
| Тип реакции | Уравнения реакций в общем виде |
|---|---|
| Реакция соединения | Соединение двух (нескольких) простых веществ в одно сложное вещество: А + В = АВ. Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2 |
| Реакция разложения | Разложение сложного вещества на два (несколько) простых вещества: АВ = А + В. Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС |
| Реакция замещения | Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС |
Учитель. Реакцией замещения называется реакция, в которой участвуют одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества – простое и сложное (запись определения в тетрадь).
Рассмотрим на практике реакции замещения. Для этого проведем лабораторную работу. (Учащиеся получают карточки с таблицей (табл. 2) для составления отчета по лабораторной работе «Реакции замещения»). В карточке заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспомните, что работать с растворами кислот нужно осторожно, т. к. они опасны. С растворами работайте по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта № 1.
Лабораторная работа «Реакции замещения»
| № опыта | Ход работы (что нужно сделать) | Наблюдения (что увидели) | Уравнения химических реакций, выводы |
|---|---|---|---|
| 1 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка | Выделяются пузырьки газа | Произошла химическая реакция: Zn + 2HCl = ZnCl2 + H2  . Это реакция замещения, цинк вытеснил водород из соляной кислоты . Это реакция замещения, цинк вытеснил водород из соляной кислоты |
| 2 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу магния | Выделяются пузырьки газа | Произошла химическая реакция: Mg + 2HCl = MgCl2 + H2  . Это реакция замещения, магний вытеснил водород из соляной кислоты . Это реакция замещения, магний вытеснил водород из соляной кислоты |
| 3 | Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь | Гвоздь покрывается красным налетом | Произошла химическая реакция: Fe + CuCl2 = FeCl2 + Cu. Это реакция замещения, железо вытеснило медь из раствора соли |
| 4 | Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку | Никаких изменений не происходит | Эта реакция невозможна: FeCl2 + Cu  .Менее активная медь не может вытеснить более активное железо из раствора соли .Менее активная медь не может вытеснить более активное железо из раствора соли |
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение химической реакции, надо предположить, какие вещества образовались в результате этой реакции. (Учитель у доски объясняет принцип составления уравнений реакций такого типа и предлагает учащимся самостоятельно расставить коэффициенты.)
Из уравнения реакции видно, что получился газ водород. Открою вам маленький секрет: вы сейчас прошли тем же путем, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как собрать водород в другую пробирку.
Правило при работе с кислотами:
«Не разлей!» Фото Л.Ларионовой
Ученик. Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку.
Учитель. Что находится в пустой пробирке?
Ученик. Воздух.
Учитель. Найдите относительную молекулярную массу водорода и скажите, что легче – водород или воздух?
Ученик. Легче водород, потому что его относительная молекулярная масса Mr(H2) равна двум.
Учитель. В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ собирания газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после этого учащиеся приступают к самостоятельному выполнению опыта № 2.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, т.к. выделился газ.
Учитель. Предположите, какой газ выделился в результате этой химической реакции.
Ученик. В результате замещения атомов водорода в соляной кислоте на атомы магния выделился водород.
Учитель. Составьте уравнение этой химической реакции и расставьте в нем коэффициенты. Сравните скорости взаимодействия магния и цинка с соляной кислотой.
Оказывается, скорость взаимодействия металла с кислотой зависит от активности металла. Все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов. Посмотрите, какой неметалл занесен в этот ряд.
Ученик. Неметалл в ряду металлов – водород.
Учитель. Металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Будет ли медь вытеснять водород из раствора соляной кислоты?
Ученик. Нет, такая реакция невозможна, т.к. медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель демонстрирует опыты, подтверждающие выдвинутую гипотезу, и делает вывод, что электрохимический ряд напряжений металлов позволяет не только предсказывать продукты реакции, но и определять возможность протекания той или иной реакции.
Учащиеся выполняют опыты № 3 и 4.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Что вы наблюдали при проведении этих опытов?
Ученик. В первой реакции гвоздь покрылся красным налетом меди, а во второй никаких изменений не произошло.
Учитель. Почему невозможна вторая реакция?
Ученик. Медь в электрохимическом ряду напряжений металлов находится правее железа, значит, она менее активна и не может его вытеснить.
Учитель. Запишите уравнения взаимодействия железа с хлоридом меди(II). (Результаты работы проверяются с помощью кодоскопа.)

Учитель. Итак, сегодня вы познакомились еще с одним типом химических реакций – реакциями замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнения.
На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие – нет. Дайте развернутый ответ. (Спрашивать по одному ученику на составление каждого уравнения реакции.)
Задание. Расставьте коэффициенты в схемах возможных химических реакций.
Аg + Н2SO4 (р-р) 
Fe + НСl 
АgNO3 + Сu 
СuO + H2 
Al + FeSO4 
Fe(NO3)3 + Hg 
Аl + Н2SO4 (р-р) 
Ответ. Уравнения возможных реакций:
Заключительная часть. Учитель подводит итоги урока, анализирует полученные результаты.
Домашнее задание. По учебнику О.С.Габриеляна «Химия-8» § 27, упр. 2а, 3в, с. 100.
* См. № 7/2006, «Реакции разложения и соединения»
Литература
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2002, 208 с.; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416 с.; Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001, 224 с.; Кузнецова Н.Е., Титова И.М.,
Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М: Вентана-Граф, 2003, 224 с.; Гин А. Приемы педагогической техники. Пособие для учителя. М.: Вита-Пресс, 2003, 88 с.
http://himi4ka.ru/arhiv-urokov/urok-13-tipy-himicheskih-reakcij.html
http://him.1sept.ru/article.php?ID=200601011