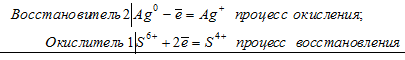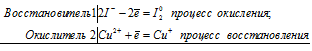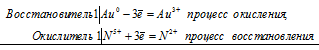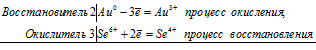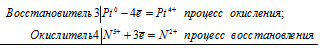Составление окислительно-восстановительных реакций соединений серебра, золота и платины
Задание 391
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Серная кислота обладает окислительными свойствами (сходными со свойствами азотной кислоты), если её концентрация превосходит 70%. Только тогда можно говорить о специфических свойствах H2SO4, как окислителя. Концентрированная серная кислота, как окислитель восстанавливается активными металлами (от Mg Cr) до H2S, малоактивными металлами (от Fe до Pb) – до свободной серы, а тяжёлыми, инертными металлами (отSb до Au) – до оксида серы (IV). При содержании H2SO4 в растворе менее 70% (разбавленная серная кислота) её поведение описывается в рамках обычных представлений. При взаимодействии разбавленной серной кислоты с металлами, стоящими в электрохимическом ряду напряжений левее водорода, выделяется газообразный водород. С металлами, стоящими в ряду напряжений правее водорода, разбавленная серная кислота не взаимодействует.
В концентрированной серной кислоте элементом-окислителем является атом серы (степень окисления +6), а в разбавленной – водород (степень окисления +1).
Уравнение реакции растворения серебра в концентрированной серной кислоте
2Аg 0 + S 6+ = 2Ag + + S 4+
В данной реакции серебро увеличивает свою степень окисления от 0 до +1, т. е. проявляет свойства восстановителя, а сера уменьшает свою степень окисления от +6 до +4, т.е. проявляет свойства окислителя.
Задание 401
Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия KI с сульфатом меди.
Решение:
Для меди характерна степень окисления +1 (Cu2O, CuCl, CuI, Cu2S) и +2 [CuO, CuSO4 . 5H2O, Cu(NO3)2 . 6H2O, CuS, Cu2(OH)2CO3]; для серебра: +1 (Ag2O, AgNO3, AgCl, AgBr, AgI); для золота: +3 (AuCl3, H[AuCl4]). Как элементы 2-й группы медь, серебро и золото имеют по одному электрону на внешнем энергетическом уровне (ns 1 ), поэтому должны проявлять степень окисления +1. Характерная степень окисления, как у элементов 2-й группы должна быть +2. Для меди наиболее характерна степень окисления +2, для серебра +1, а для золота +3.
Уравнения взаимодействия KI с сульфатом меди
2Сu 2+ +2I — = Cu + + I2 0
Задание 404
Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Золото растворяется в «царской водке» с образованием комплекса H[AuCl4]
Au 0 +N 5+ = Au 3+ + N 2+
3Au + 12HCl + 3HNO3 = 3H[AuCl4] + 3NO + 6H2O
б) Золото растворяется в селеновой кислоте с образованием селената золота(III)
2Au 0 + 3Se 6+ = 2Au 3+ + 3Se 4+
Задание 428
Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий — до+8.
Решение:
а) Реакция растворения платины в царской водке
3Pt 0 + 4N 5+ = 3Pt 4+ + 4N 2+
б) Реакция взаимодействия осмия с фтором:
Реактивы и ход процесса растворения золота
Растворители золота — это вещества, которые способны воздействовать на драгметалл и трансформировать элемент на некоторое время. У многих может возникнуть вопрос, зачем растворять золото? Этот процесс предназначен в первую очередь для очистки драгметалла от примесей и эффективной переработки отходов.
Растворение золота в царской водке
Процесс растворения
Растворяя золото, можно с помощью последующих процессов добиться высшей пробы, то есть увеличить количество драгметалла металла в сплаве. Процесс происходит в три этапа:
- Растворение золота с примесями.
- Выпаривание.
- Осаждение драгметалла.
Именно для первой стадии нужны растворители. Но не каждое сильнодействующее вещество подойдет для таких целей. Золото — благородный металл, что означает инертность вещества по отношению ко многим реактивам. Но в то же время существуют кислоты или смеси, которые способны растворить золото.
Растворение — сложный процесс, но можно выполнить его и в домашних условиях. Например, перед очисткой лома или извлечением драгметалла из радиодеталей. Но перед тем как добавлять реактивы в изделия, стоит очистить лом от примесей. Например, с помощью магнита избавится от ферромагнетиков. Затем лом можно опустить в азотистую кислоту, чтоб избавиться сразу от части металлов.
Реактивы (вещества) для первого этапа очистки
Среди реактивов, которыми можно растворить золото, самым известным и применяемым является царская водка, или Aqua Regia. Вещество очень популярное, его изучают даже на уроках химии в школе. Как растворить золото в царской водке — вопрос, который волнует домашних экспериментаторов. По составу царская водка — это смесь концентрированных азотной и соляной кислот в соотношении 1:3 по объему и 1:2 по массе. Около 65-67% приходится на азотную кислоту по массе и 33-36% — соляной кислоты.
Царским прозвали реактив, поскольку он мог растворить «царя металлов», ну а водка изначально была жидким веществом. Намного позже значение этого слова стало ассоциироваться с алкогольным напитком. С точки зрения химии, в результате реакции получается вещество — золотохлористоводородная кислота, или тетрахлораурат водовода.
Формула процесса выглядит так: Au + HNO3 + 4 HCl = HAuCl4 + NO + 2 H2O. Поэтому, ориентируясь на уравнение, для растворения 1 грамма золота необходимо 5 миллилитров царской водки. В реакции именно соляная кислота является растворителем, а азотная выступает в роли катализатора, то есть ускоряет процесс и компенсирует реакцию.
Поэтому в процессе растворения лучше всего брать 3,75 миллилитра соляной кислоты на грамм лома золота. После того как начнет происходить видимая реакция, выдержите металл в растворе до 5 минут и слейте кислоту, после чего залейте новой порцией вещества. Далее поставьте емкость с ломом и кислотой на плиту и нагревайте смесь, вливая в нее азотную кислоту в пропорции 1,25 миллилитр на 1 грамм металла.
Все реактивы должны быть просчитаны, особенно азотная кислота. Именно от этого вещества придется избавляться в процессе фильтрации и осаждения. После растворения металла не стоит добавлять азотную кислоту в раствор. После завершения процесса растворения необходимо продержать получившуюся смесь нагретой около 30 минут.
Следующим этапом будет фильтрация золота, которая происходит уже с помощью других веществ. Фильтрация — процесс, проходящий в два этапа. Перед фильтрацией после растворения нужно выдержать раствор около суток, поскольку за это время кислоты в составе царской водки испаряются. Само по себе вещество нестойкое, что облегчает последующую очистку драгметалла.
Из всех существующих веществ не только водка справляется с процессами растворения благородного металла. На золото действуют:
- Озон. В результате чего образуется оксид Аu2О3 коричневого цвета. В обычных условиях реакция невозможна, нужно большое количество концентрированного озона.
- Газообразный фтор, бром, йод, хлор также растворяют золото в нагретом состоянии. В результате процесса образуются фторид АuF3, красный хлорид АиС13, коричневый бромид АuВr3 и темно-зеленый йодид АuI3. Поэтому если у вас есть позолоченное украшение, лучше избегать контактов с йодной настойкой. Драгметалл способен растворяться в жидком броме, а с хлорной водой он реагирует при комнатной температуре, образовывая НАuСl4.
- А еще растворяется золото в концентрированной горячей селеновой кислоте. В процессе реакции кислота восстанавливается до селенистой. Химики записывают методику так: 2Аu + 6Н2SеO4 = Аu2(SеO4)3 + 3Н2Sе03 + 3Н20.
- Чтоб растворить драгметалл, нужно к горячей серной кислоте добавить окислитель. В роли окислителя используют нитрат, перманганат, хромовую кислоту, диоксид марганца.
- Можно провести процесс и с помощью цианидов щелочных и щелочноземельных металлов. Реакция происходит даже при нормальной температуре с доступом кислорода. Но в результате соединения золота с цианидом получаются очень прочными, поэтому в промышленных целях способ используют для очистки добытого золота от руд. 4Аu + 8КСN + 2Н2O + O2=4К[Аu(СN)2] + 4КОН — вот так выглядит реакция. Она была открыта и исследована русским ученым-инженером Багратионом. Процесс назвали цианированием.
- Существует и анодное растворение золота в щелочи КОН, при котором драгметалл образует аурат калия и анодный осадок.
Благородность золота, с точки зрения современной химии, все же не так совершенна, как хотелось бы. Конечно, в домашних условиях эти реакции проводить опасно, но в лабораториях и на заводах есть возможность за ними наблюдать. Эти реакции и позволяют экономнее относиться к сырью в виде золота, а также делать драгметалл более чистым. Перед проведением реакций убедитесь, что все реактивы подготовлены правильно и соблюдены меры предосторожности.
А чтоб уберечь свое изделие из золота от негативных реакций, лучше не контактируйте с йодной настойкой. Особенно от воздействия веществ следует беречь украшения с меньшим составом драгметалла, поскольку лигатура быстрее реагирует на химические реактивы.
Уравнение реакции золота с серной кислотой
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
HCl 
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl 
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e — → Al 3+ — окисление
3│2 H + + 2 e — → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H2SO4 
HSO4 — 
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e — → 2Al 3+ — окисление
3│2 H + + 2 e — → H 2 – восстановление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) 
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:
Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
http://dedpodaril.com/zoloto/imform/rastvoriteli-zolota.html
http://www.chem-astu.ru/chair/study/metals/5_Metals-Acids.shtml