Бериллий: способы получения и химические свойства
Бериллий Be — это cветло-серый, легкий, хрупкий металл. На воздухе покрывается оксидной пленкой. Восстановитель.
Относительная молекулярная масса Mr = 9,012; относительная плотность для твердого и жидкого состояния d = 1,85; tпл = 1287º C; tкип = 2507º C.
Способ получения
1. В результате электролиза расплава хлорида бериллия образуются бериллий и хлор :
2. Расплав фторида бериллия подвергают электролизу , в результате чего на выходе образуется бериллий и фтор:
3. Оксид бериллия легко восстанавливается магнием при 700 — 800º С, образуя бериллий и оксид магния:
BeO + Mg = MgO + Be
4. Фторид бериллия также легко восстанавливается магнием при 700 — 750º С с образованием бериллия и фторида магния:
BeF2 + Mg = Be + MgF2
Качественная реакция
Качественная реакция на бериллий — окрашивание пламени горелки в коричнево — красный цвет.
Химические свойства
1. Бериллий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Бериллий взаимодействует с азотом при 700 — 900º С образуя нитрид бериллия:
1.2. Бериллий сгорает в кислороде (воздухе) при 900º С с образованием оксида бериллия:
2Be + O2 = 2BeO
1.3. Бериллий активно реагирует при комнатной температуре с фтором (комнатная температура) , хлором (250º С), бромом (480º С) и йодом (480º С) . При этом образуются фторид бериллия, хлорид бериллия, бромид бериллия, йодид бериллия :
Be + Br2 = BeBr2
1.4. С серой бериллий реагирует при температуре 1150º C с образованием сульфида бериллия:
Be + S = BeS
1.5. С углеродом бериллий реагирует при 1700 — 1900º С и вакууме, образуя карбид бериллия:
2Be + C = Be2C
2. Бериллий активно взаимодействует со сложными веществами:
2.1. Бериллий при кипении реагирует с водой . Взаимодействие бериллия с водой приводит к образованию гидроксида бериллия и газа водорода:
2.2. Бериллий взаимодействует с кислотами:
2.2.1. Бериллий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бериллия и водород :
Be + 2HCl = BeCl2 + H2 ↑
2.2.2. Реагируя с разбавленной и горячей азотной кислотой бериллий образует нитрат бериллия, газ оксид азота (II) и воду:
2.2.3. В результате реакции концентрированной фтороводородной кислоты и бериллия образуется осадок тетрафторобериллат водорода и газ водород:
2.3. Бериллий может взаимодействовать с основаниями:
2.3.1. Бериллий взаимодействует с гидроксидом натрия в расплаве при температуре 400 — 500º С, при этом образуется бериллат натрия и водород:
Бериллий взаимодействует с гидроксидом натрия в растворе , при этом образуется тетрагидроксобериллат натрия и водород:
2.4. Бериллий вступает в реакцию с газом аммиаком при 500 — 700º С. В результате данной реакции образуется нитрид бериллия и водород:
2.5. Бериллий может вступать в реакцию с оксидами :
В результате взаимодействия бериллия и оксида магния при температуре 1075º С образуется оксид бериллия и магний:
Be + MgO = BeO + Mg
3. Бериллий взаимодействует с органическими веществами :
Бериллий может вступать в реакцию с ацетиленом при 400 — 450º С, образуя карбид бериллия и водород:
2.2.2. Химические свойства металлов IIA группы.
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Гидрид бериллия (BeH2) химическая структура, свойства и применение
гидрид бериллия представляет собой ковалентное соединение, образованное между бериллием щелочноземельного металла и водородом. Его химическая формула BeH2, и будучи ковалентным, он не состоит из иона Be 2+ ни Н — . Вместе с LiH он является одним из самых легких гидридов металлов, способных к синтезу..
Его получают обработкой диметилберилом, Be (CH3)2, с литийалюминийгидридом, LiAlH4. Тем не менее, BeH2 Самым чистым является пиролиз ди-трет-бутилбериллия, Be (C (CH).3)3)2 при 210 ºC.
Как отдельная молекула в газообразном состоянии, она линейна по геометрии, но в твердом и жидком состоянии она полимеризуется в массивах трехмерных сетей. Это аморфное твердое вещество в нормальных условиях, оно может стать кристаллическим и проявлять металлические свойства при огромном давлении.
Он представляет собой возможный способ хранения водорода либо в качестве источника водорода при разложении, либо в виде твердого поглощающего газа. Тем не менее, BeH2 Он очень токсичен и загрязняет окружающую среду, учитывая бериллиевую природу.
- 1 Химическая структура
- 1.1 Молекула BeH2
- 1.2 Цепи BeH2
- 1.3 Трехмерные сети BeH2
- 2 свойства
- 2.1 Ковалентный характер
- 2.2 Химическая формула
- 2.3 Внешность
- 2.4 Растворимость в воде
- 2.5 Растворимость
- 2.6 Плотность
- 2.7 Реакционная способность
- 3 использования
- 4 Ссылки
Химическая структура
Молекула BeH2
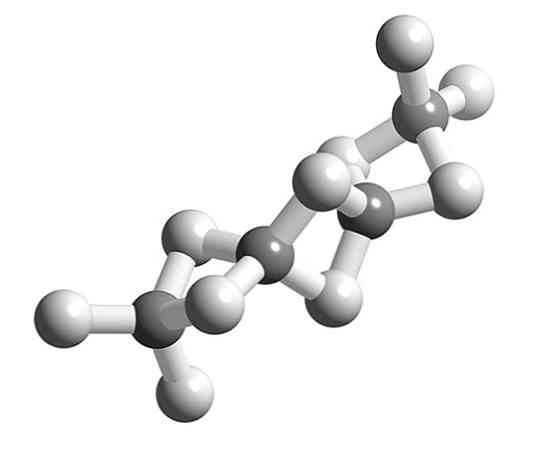
На первом изображении видна отдельная молекула гидрида бериллия в газообразном состоянии. Обратите внимание, что его геометрия является линейной, с атомами H, отделенными друг от друга углом 180º. Чтобы объяснить такую геометрию, атом Be должен иметь sp-гибридизацию.
Бериллий имеет два валентных электрона, которые находятся на 2-й орбите. Согласно теории валентных связей, один из электронов 2s-орбитали энергетически превращается в 2p-орбиталь; и, как следствие, теперь он может образовывать две ковалентные связи с двумя sp-гибридными орбиталями.
А как насчет остальных свободных орбиталей Бе? Доступны еще две чистые 2p-орбитали, негибридизованные. С ними пусто, БиГ2 это дефицитное соединение электронов в газообразной форме; и поэтому, охлаждая и группируя их молекулы, они конденсируются и кристаллизуются в полимере.
BeH Chains2
Когда молекулы BeH2 при полимеризации окружающая геометрия атома Be перестает быть линейной и становится тетраэдрической.
Ранее структура этого полимера моделировалась, как если бы они были цепочками с звеньями BeH2 связаны водородными мостиками (верхнее изображение, со сферами в белых и серых тонах). В отличие от водородных связей диполь-дипольных взаимодействий, они имеют ковалентный характер.
В мостике Be-H-Be полимера два электрона распределены между тремя атомами (ссылка 3с, 2е), который теоретически должен быть расположен с большей вероятностью вокруг атома водорода (поскольку он является более электроотрицательным).
С другой стороны, Be, окруженный четырьмя H, успевает относительно заполнить свою электронную вакансию, завершив свой валентный октет.
Здесь теория валентной связи бледнеет, чтобы дать относительно точное объяснение. Почему? Поскольку водород может иметь только два электрона, и -H- связь будет включать в себя участие четырех электронов.
Итак, чтобы объяснить мосты Be-H2-Be (две серые сферы, соединенные двумя белыми сферами) нужны другие сложные модели связи, такие как те, которые предусмотрены молекулярно-орбитальной теорией.
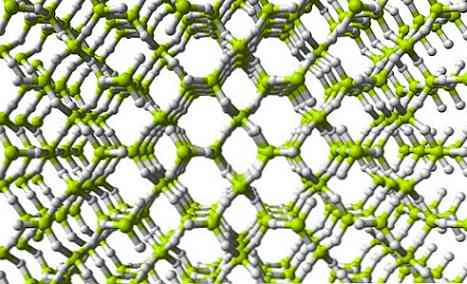
Экспериментально установлено, что полимерная структура BeH2 Это не цепочка, а трехмерная сеть..
Трехмерные сети BeH2
Верхнее изображение показывает часть трехмерной сети BeH2. Обратите внимание, что желтовато-зеленые сферы, атомы Ве, образуют тетраэдр, как в цепи; однако в этой структуре имеется большее число водородных мостиков, и, кроме того, структурная единица больше не является BeH2 но бе4.
Те же структурные единицы BeH2 и BeH4 они указывают на то, что в сети имеется большее количество атомов водорода (4 атома Н для каждого Be).
Это означает, что бериллию в этой сети удается заполнить свою электронную вакансию даже больше, чем в цепочечной структуре полимера..
И как наиболее очевидное отличие этого полимера по отношению к отдельной молекуле BeH2, является то, что Be должен обязательно иметь sp гибридизацию 3 (Обычно), чтобы объяснить тетраэдрическую и нелинейную геометрию.
свойства
Ковалентный персонаж
Почему гидрид бериллия является ковалентным и неионным соединением? Гидриды других элементов группы 2 (г-н Бекамгбара) являются ионными, то есть они состоят из твердых веществ, образованных катионом М. 2+ и два гидридных аниона Н — (MGH2, CaH2, ба2). Таким образом, BeH2 Он не состоит из Be 2+ ни Н — взаимодействуя электростатически.
Катион Бе 2+ он характеризуется высокой поляризационной силой, которая искажает электронные облака окружающих атомов.
В результате этого искажения анионы H — они вынуждены образовывать ковалентные связи; ссылки, которые являются краеугольным камнем структур только что объяснил.
Химическая формула
Внешний вид
Бесцветное аморфное твердое вещество.
Растворимость в воде
растворимость
Нерастворим в диэтиловом эфире и толуоле.
плотность
0,65 г / см3 (1,85 г / л). Первое значение может относиться к газовой фазе, а второе — к полимерному твердому веществу..
реактивность
Реагирует медленно с водой, но быстро гидролизуется HCl с образованием хлорида бериллия, BeCl2.
Гидрид бериллия реагирует с основаниями Льюиса, в частности, триметиламином, N (CH)3)3, образовать димерный аддукт с гидридами мостика.
Кроме того, он может реагировать с диметиламином с образованием тримерного диамида бериллия, [Be (N (CH)3)2)2]3 и водород. Реакция с гидридом лития, где ион Н — это основание Льюиса, форма последовательно LIBeH3 и Ли2Бех4.
приложений
Гидрид бериллия может представлять собой перспективный способ хранения молекулярного водорода. Разлагая полимер, он выпустил бы H2, который будет служить ракетным топливом. При таком подходе трехмерная сеть будет хранить больше водорода, чем цепей.
Также, как видно на изображении сети, есть поры, которые позволят разместить молекулы H.2.
На самом деле, некоторые исследования имитируют физическую память в BeH.2 кристаллический; то есть полимер подвергается воздействию огромных давлений, и каковы будут его физические свойства при разных количествах адсорбированного водорода.
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-metallov-iia-gruppy
http://ru.thpanorama.com/articles/qumica/hidruro-de-berilio-beh2-estructura-qumica-propiedades-y-usos.html