Уравнение реакций для непредельных углеводородов
г) гидрогалогенирование (гидрохлорирование):
Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
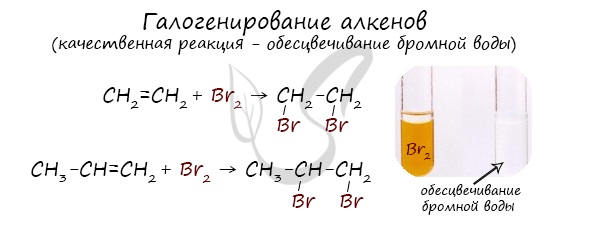
4. Качественные реакции на алкены: обесцвечивание бромной воды (см. уравнение 2 б ) и раствора перманганата калия
Алкины – это непредельные углеводороды, в молекулах которых есть одна тройная связь между атомами углерода
Физические свойства алкинов
Низшие алкины — бесцветные газы немного растворимые в воде с плтностью меньше 1 г/см 3 ; с увеличением молекулярной массы температура кипения возрастает, температура кипения неразветвленных алкинов больше температуры кипения разветвленных изомеров.
Химические свойства алкинов
В этой реакции температура пламени может достигать 3000 o С, поэтому она применяется для сварки металлов.
- Присоединение (протекает в две стадии: с разрывом одной, а затем и другой π -связи):
в) гидрогалогенирование (первая стадия):
CH CH + HCl CH 2 = CHCl
г) гидратация (реакция Кучерова):
ацетальдегид
(уксусный альдегид)
- Тримеризация (синтез Бертло-Зелинского):
- Замещение (для алкинов с тройной связью после первого атома углерода):
5. Качественные реакции на алкины: обесцвечивание бромной воды (см. реакцию 2 б ) и раствора перманганата калия; образование осадка ацетиленида серебра (см. реакцию 4).
Алкадиены – это непредельные углеводороды, в молекулах которых есть две двойные связи между атомами углерода
Физические свойства алкадиенов
бутадиен-1,3 — газ, следующие члены гомологического ряда — бесцветные жидкости с плотностью меньше 1 г/см 3 .
Химические свойства алкадиенов
- Полимеризация (используется при производстве синтетических каучуков):
Такой же состав, как полиизопрен, (C5H8)n – имеет и природный полимер − натуральный каучук.
Алкадиены, как алкены и алкины, обесцвечивают бромную воду (реакция 2 б ) и раствор перманганата калия.
Получение непредельных углеводородов
- Дегидрирование алканов: CH3—CH2—CH2—CH3 CH2=CH—CH=CH2 +2H2
- Дегидратация и дегидрирование этанола (метод С. В. Лебедева; только для бутадиена):
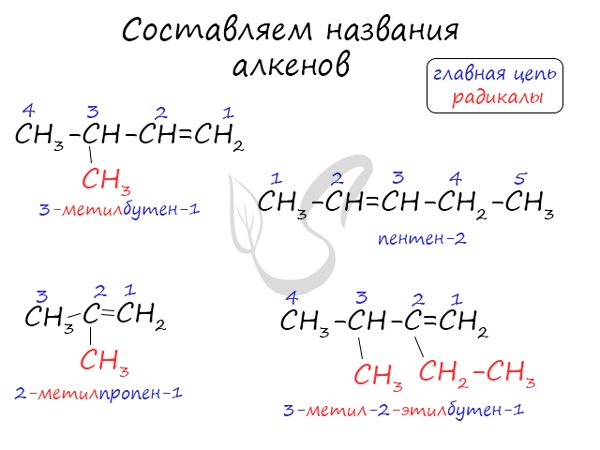
Алгоритм составления названий непредельных углеводородов
- Найдите главную углеродную цепь: это самая длинная цепь атомов углерода, содержащая кратную связь.
- Пронумеруйте атомы углерода в главной цепи с того конца, к которому ближе кратная связь.
- Укажите номер атома углерода в главной цепи, у которого есть заместитель и дайте название заместителю. Если заместителей несколько, расположите их по алфавиту. Перед названием одинаковых заместителей укажите номера всех атомов углерода, с которыми они связаны, и используйте умножающие приставки (ди-, три-, тетра-).
- Напишите название главной цепи с суффиксом, определяющим степень насыщенности углеводорода: для непредельных с двойной связью -ен, с двумя двойными связями -диен, с тройной связью -ин; затем укажите номер атома углерода, после которого стоит кратная связь.
Изучив тему, Вы должны усвоить следующие понятия: непредельные углеводороды, алкены, алкины, алкадиены, π -связь, двойная связь, тройная связь. Вы должны знать: общие формулы алкенов, алкинов, алкадиенов; виды изомерии; номенклатурные правила для углеводородов; правило Марковникова, типы реакций [горение, присоединение (гидрирование, гидратация, галогенирование, гидрогалогенирование, полимеризация), разложение (дегидрирование, дегидратация, дегидрогалогенирование)], качественные реакции на алкены, алкины и алкадиены. Желаем успехов.
Уравнение реакций для непредельных углеводородов
Составить уравнения реакций:
1.Предельные углеводороды — Непредельные углеводороды
2.Непредельные углеводороды- Предельные углеводороды
3.Непредельные углеводороды-Ароматические углеводороды.
4.Ароматические углеводороды-.Непредельные углеводороды.
5.Ароматические углеводороды-Галогенопроизводные ароматич. углеводородов. 6.Галогенопроизводные ароматич. углеводородов-Ароматические углеводороды. 7.Галогенопроизводные ароматич. углеводородов- Фенолы.
Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
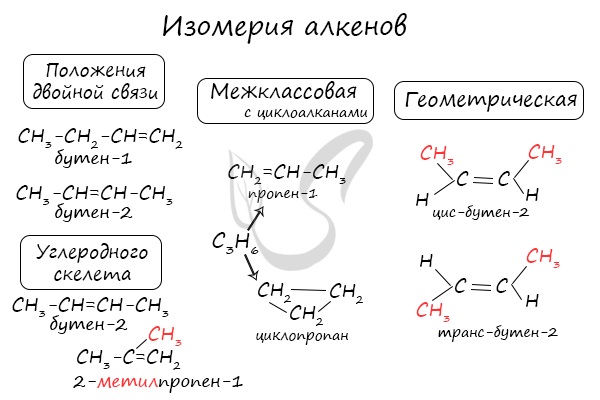
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.
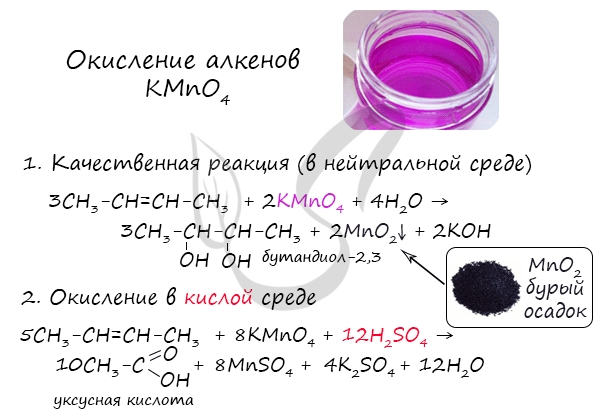
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
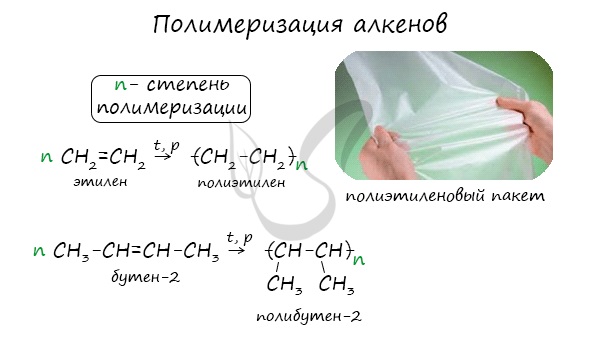
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://znanija.site/himiya/1718772.html
http://studarium.ru/article/183