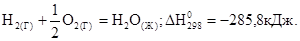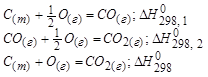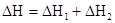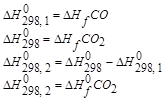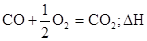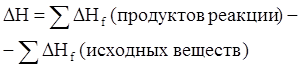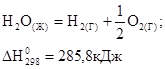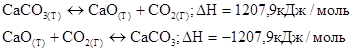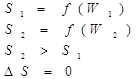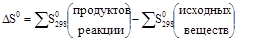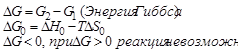Стандартное состояние.
Чтобы сравнивать между собой тепловые эффекты различных реакций необходимо стандартизировать условия, в которых эти реакции протекают (исходные вещества взяты в стехиометрических отношениях ). Состояние каждого вещества создается как стандартное состояние. Это физическое состояние, в котором вещество более устойчиво, при P0=101кПа=1атм. и T=298К=25˚С.
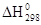
Термохимические уравнения –это уравнения химических реакций, в которых рядом с формулой участвующих реакций символом в скобках указывается состояние вещества (твердое – (т), кристаллическое – (к), жидкое – (ж), газообразное – (г), раствор – (р)) и после уравнения через точку с запятой указывается, величена теплового эффекта, при стандартных условиях.
В данной реакции из простых веществ 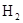
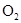
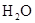
Стандартная терлота образования вещества ( 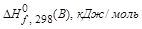
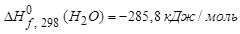
Стандартная теплота образования простых веществ условно принимается равной нулю. Стандартные теплоты образования сложных веществ имеются в справочной таблице.
Термохимические законы и расчёты по ним:
1. Закон Гесса.
Тепловой эффект реакции протекающий в несколько стадий равен сумме тепловых эффектов отдельных стадий.
Следствие из закона Гесса:
То есть тепловой эффект процесса зависит только от вида исходных веществ и продуктов реакций, но не зависит от пути перехода.
Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и исходных веществ. Теплоты образования участников реакции рассчитываются в последующем выражении с учетом коэффициента уравнения реакции. Последнее выражение используется для расчета тепловых эффектов химических реакций, протекающих при стандартных условиях, с использованием справочных данных, по стандартным теплотам образования участников реакций.
2. Закон Лавуазье-Лапласа.
Теплота образования вещества численно равна теплоте разложения вещества с противоположным знаком.
Направленность химических реакций.
Всякая химическая реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении. Поэтому в реакционной смеси всегда присутствуют как исходные вещества, так и продукты реакции. Но отношение будет зависеть от условий, в которых находятся реагирующие вещества. Все реакции обратимы, но в определенных условиях они могут протекать в определенном направлении.
Термодинамика позволяет определить направление протекания данной реакции при данных условиях (при t=const и P=const). Самопроизвольно протекают процессы связанные с уменьшением свободной энергии системы. Исходя из этого, самопроизвольно могут протекать реакции в ходе, которых уменьшается свободная энергия системы. При экзотермической реакции теплосодержание уменьшается такие реакции должны идти самопроизвольно ( 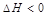
Следовательно, принцип Бертло-Томсона не распространяется на все реакции. Это объясняется тем, что изменение свободной системы связано не только с изменением ее теплосодержанием, но и с изменением энтропии.
Процессы могут протекать и без изменения внутренней энергии 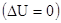
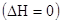
Энтропия (S, Дж/К) – это термохимическая функция, мера беспорядка системы, функция вероятности состояния системы. Таким образом, самопроизвольно идут процессы, в ходе которых энтропия увеличивается, то есть растет хаотизация. Обратный процесс требует затраты энергии.
Самопроизвольно может протекать расширение газа в пустоту или в вакуум и процессы смешения.
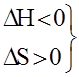
протекания процесса.
Стандартная энтропия вещества ( 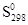
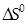
Изменение энтропии не зависит от способа перехода системы из начального состояния в конечное состояние, а определяется лишь исходным и конечным состоянием реагирующих веществ. И если 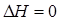
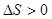
Энтропия вещества зависит от его физического состояния и при переходе из кристаллического в жидкое и газообразное энтропия будет увеличиваться. Энтропия пропорциональна температуре.
Изобарно-изотермический потенциал системы – это величина свободной энергии системы при постоянном давлении и температуре, при стандартных условиях, она обозначается G 0 . В ходе химической реакции имеет место изменение изобарно-термического потенциала.
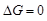
Дата добавления: 2015-08-08 ; просмотров: 1899 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Термохимические уравнения.
Большинство реакций протекают при постоянном давлении. Поэтому энергетический эффект реакции оценивают именно изменением энтальпии или тепловым эффектом. Уравнение реакции, для которой указываются соответствующие этой реакции изменением энтальпии ∆Н или тепловой эффект Qp, называют термохимическим.
Химические реакции, при протекании которых происходит уменьшение энтальпии системы (Н 0), называют экзотермическим.
Реакции, в результате которых энтальпия возрастает (∆H > 0) и система поглощает теплоту Qp извне (Qp
Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
- Если ΔН о Т о Т > 0, то ΔG о Т
- Если ΔН о Т > 0, ΔS о Т о Т > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔН о Т о Т о Т о /ΔS о (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔН о Т > 0, ΔS о Т > 0, то ΔG о Т ΔН о / ΔS о (процесс идет при высокой температуре за счет энтропийного фактора).
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Объяснить знак и величину ΔS о .
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔG о f,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| S о 298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
http://www.calc.ru/Termokhimicheskiye-Uravneniya.html
http://chemege.ru/entropy-gibbs-energy/