Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
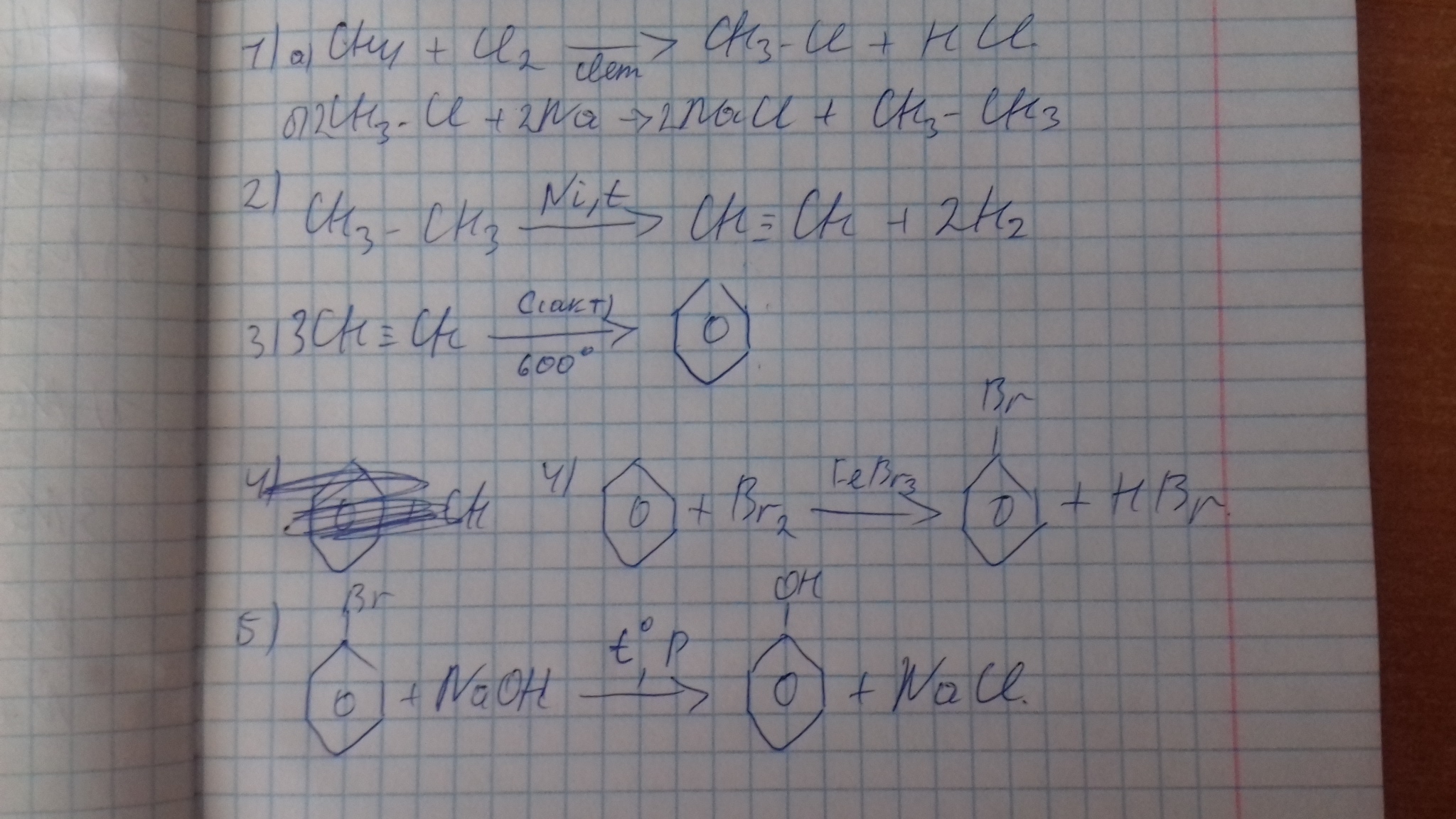
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. составьте уравнение реакции , с помощью которых можно осуществить цепочки превращений. обозначьте условия их осуществления.а)метан — ацетилен — бензол — бромбезол б) карбид кальция — ацетилен — бензол — нитробензол в) бензол — циклогексан — хлорцислогексан — 1 1 ди хлорциклогексан г) карбид аллюмия — метан — ацетилен — бензол — гексахлорциклогексан д) циклогексен — циклогексан — бензол — талуол ж)бензол — бензолсульфановая кислота- бензолсульфанат натрия з) бензойная кислота — бензол — бромбензол — бромциклогексан — циклогексанол Составьте уравнение реакций в цепочке превращений :Метан — этан — этин — бензол — бромбензол — фенол?Химия | 5 — 9 классы Составьте уравнение реакций в цепочке превращений : Метан — этан — этин — бензол — бромбензол — фенол. Ответ прикрепил ниже. Из метана получить этан, только в 2 сталии. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения : а) бензол бромбензол : б) бензол ; в) гексан ; г) этил — метан стирол?Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения : а) бензол бромбензол : б) бензол ; в) гексан ; г) этил — метан стирол. Укажите условия течения реакций. СРОЧНО?метан — хлорметан — этан — бромэтан — этен — этин — бензол. Осуществить цепочку превращений 1 — хлорпропан — — — — — — гексан — — — — — — циклогексан — — — — — — бензол — — — — — — бромбензол?Осуществить цепочку превращений 1 — хлорпропан — — — — — — гексан — — — — — — циклогексан — — — — — — бензол — — — — — — бромбензол. Написать уравнение реакции превращений ацетилен — бензол — хлорбензол — фенол?Написать уравнение реакции превращений ацетилен — бензол — хлорбензол — фенол. Осуществить цепочку превращений : метан — ацетилен — бензол — хлорбензол — фенол — фенолят калия?Осуществить цепочку превращений : метан — ацетилен — бензол — хлорбензол — фенол — фенолят калия. Составьте уравнения химических реакций с помощью которых можно осуществить превращения этин — этан — этин — этен — углекислый газПомогите пожалуйста?Составьте уравнения химических реакций с помощью которых можно осуществить превращения этин — этан — этин — этен — углекислый газ Помогите пожалуйста?Составьте уравнения реакциий следующих превращений. Метан — ацетилен — бензол — хлорбензол — фенол — фенолят калия. Напишите схему превращений : углерод — метан — бромметан — этан — этен — этин — бензол — нитробензол?Напишите схему превращений : углерод — метан — бромметан — этан — этен — этин — бензол — нитробензол. Осуществить цепочку превращений : циклогексан — бензол — — бромбензол — — нитробензол — анилинуказать тип химических реакций, условия их проведения?Осуществить цепочку превращений : циклогексан — бензол — — бромбензол — — нитробензол — анилин указать тип химических реакций, условия их проведения. Написать уравнение реакций : карбид кальция — этике — бензол — бромбензол — фенол — фенолят калия?Написать уравнение реакций : карбид кальция — этике — бензол — бромбензол — фенол — фенолят калия. Составить химические реакции для осуществления следующих превращений ?Составить химические реакции для осуществления следующих превращений . Этан — этен — хлорэтан — этен — этин — бензол . Вы открыли страницу вопроса Составьте уравнение реакций в цепочке превращений :Метан — этан — этин — бензол — бромбензол — фенол?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху. = kcl2 + h2 вот это. ЭО2 пусть масса оксида 100г, тогда m(Me) = 69, 5 ; m(O) = 30, 5 m(Me) : m(O) = Э(Me) : Э(O) 69, 5 : 30, 5 = Э(Ме) : 8 Э(Ме) = 18 М(Ме) = 18 * 4 = 72г / моль — это германий. Дано m(Fe) = 28 g — — — — — — — — — — — — — — — — — — — — — — — — — — m(CL2) — ? 28 X 2Fe + 3CL2 — — >2FeCL3 M(Fe) = 56 g / mol M(CL2) = 71 g / mol 2 * 56 3 * 71 X = 28 * 213 / 112 = 53. 25 g ответ 53. 25 г. источники: http://znanija.org/himiya/8621622.html http://himia.my-dict.ru/q/8059507_sostavte-uravnenie-reakcij-v-cepocke-prevrasenij/ |