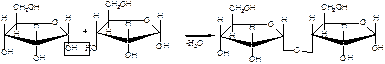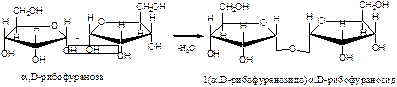Уравнение реакций окисления и восстановления рибозы
Вопрос по химии:
Напишите уравнения реакций и структурные формулы реакций окисления и восстановления рибозы
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Напишите уравнения реакций окисления (реакция «серебряного зеркала») D-рибозы и её взаимодействия с метиловым спиртом. Назовите продукты реакций.
Решение:
В реакцию окисления (реакция «серебряного зеркала») вступает открытая форма D-рибозы, при этом окисление идет по альдегидной группе с образованием альдоновой кислоты:
D-рибоза D-рибоновая кислота
Название кислоты – замена альд на корень соответствующей монозы, поэтому — рибоновая кислота.
В более жестких условиях, например при взаимодействии с таким окислителем, как азотная кислота, окисление происходит по альдегидной и по первичной гидроксильной группе. В результате образуется аровая (сахарная) кислота:
D-рибоза D-рибоаровая кислота (корень монозы + аровая кислота).
Во взаимодействие со спиртами вступает циклическая форма углевода. В этой реакции углеводы проявляют свойства многоатомных спиртов. Полуацетальный гидроксил наиболее активен и при взаимодействии со спиртами дает полуацетали, которые в классе углеводов называются гликозидами:


1. Напишите уравнения образования восстанавливающего и невосстанавливающего дисахарида из двух молекул 
Решение:
Восстанавливающий дисахарид образуется за счет полуацетального гидроксила одной молекулы монозы и любого другого спиртового гидроксила (гликозид-гликозная связь) другой молекулы:



3( 

В полученном дисахариде остается один свободный полуацетальный гидроксил, за счет которого в водных растворах возможно существование таутомерных форм, т.е. восстанавливающий дисахарид в водном растворе мутаротирует.
Невосстанавливающий дисахарид образуется в результате взаимодействия полуацетальных гидроксилов двух молекул моноз (гликозид-гликозидная связь):
В полученном дисахариде отсутствует полуацетальный гидроксил, поэтому углевод в водном растворе не образует таутомерных форм (не мутаротирует). Такие дисахариды проявляют свойства только многоатомных спирт.
РАЗДЕЛ 5. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Амины. Аминокислоты
Литература
1. Иванов, В.Г. Органическая химия: учеб. пособие для вузов / В.Г. Иванов, В.А. Горленко. – М.: Издательский центр «Академия», 2009. -С. 255-262, 426-442, 275-285.
2. Грандберг, И.И. Органическая химия: учеб. для вузов / И.И. Грандберг. — М.: Дрофа, 2002. -С. 314-329, 484-508.
3. Артеменко, А.И. Органическая химия: учеб. для вузов / А.И. Артеменко. — М.: Высшая школа, 2009. -С. 248-251, 274-280, 375-386.
4. Денисов, В.Я. Органическая химия: учеб. для студентов вузов, обучающихся по направлению подготовки и специальности «Химия»/ В.Я. Денисов, Д.Л. Мурышкин, Т.В. Чуйкова. – М.: Высшая школа, 2009, -С. 163-170,329-345, 196-201.
5. Петров, А.А. Органическая химия: учеб. для вузов / А.А. Петров. — С-Пб.: Иван Федоров, 2002. -С. 226-233, 384-396, 286-293.
Основные вопросы по данной теме в достаточном объеме освещены в рекомендуемых учебниках. Однако объем материала по ароматическим аминам выходит за рамки программы по дисциплине, поэтому необходимо отбирать материал в соответствии с программой и методическими рекомендациями. Подробно электронное и пространственное строение аминов, механизмы различных типов реакций рассмотрены в учебнике [4], в учебниках [1-3,5] материал изложен систематично и более кратко. При изучении аминокислот лучше использовать учебники [1,2], где материал представлен в компактной форме.
Амины можно рассматривать как производные аммиака (NH3), в молекуле которого атомы водорода замещены на радикалы алифатического (R-) или ароматического (Ar-) ряда: R–NН2 и Ar–NH2 – первичные амины, (R)2NH и (Ar)2NH – вторичные амины, (R)3N и (Ar)3N – третичные амины.
При изучении аминов следует обратить внимание на номенклатуру. Для данных соединений более характерны названия, построенные по радикально-функциональной, а не по заместительной номенклатуре. Для ароматических аминов широко представлены тривиальные названия, некоторые следует запомнить — анилин, толуидины и т.д.
При изучении строения аминов следует обратить внимание на различия в строении алифатических и ароматических аминов (см. «Электронные эффекты»).
При изучении химических свойств аминов прежде всего следует рассмотреть основные свойства, которые обусловлены свободной парой электронов на атоме азота аминогруппы. Поэтому амины могут реагировать с кислотами, образуя соли аммония, которые неустойчивы, особенно в ароматическом ряду, и способны разлагаться в присутствии гидроксидов металлов:
Основные свойства аминов зависят от количества и природы радикалов.
Необходимо подробно рассмотреть реакции алкилирования, ацилирования, в которых амины проявляют нуклеофильные свойства, причем более выраженные в алифатических аминах.
Студенту следует обратить внимание на отношение аминов различных типов к азотистой кислоте, так как эта реакция является характерной для них и дает возможность определять природу амина.
Необходимо рассмотреть характерные для ароматических аминов реакции электрофильного замещения, протекающие по бензольному кольцу.
При изучении способов получения аминов следует обратить внимание на реакции Гофмана и Зимина.
Аминокислоты – гетерофункциональные соединения, в составе которых присутствуют амино — и карбоксильная группы. В водных растворах аминокислоты существуют в виде внутренней соли, образуемой в результате внутримолекулярного взаимодействия обеих функциональных групп.
При изучении аминокислот следует обратить внимание на оптическую изомерию (D, L –конфигурации).
Необходимо запомнить тривиальные названия некоторых аминокислот (глицин, аланин и т.д). При изучении химических свойств кислот следует отметить сходство аминокислот с карбоновыми кислотами (образование солей, сложных эфиров, галогенангидридов), а также с аминами (образование солей, алкилирование, ацилирование, взаимодействие с азотистой кислотой). Необходимо обратить внимание на образование пептидных связей.
При рассмотрении полипептидов более подробно следует рассмотреть белки. Если выделить повторяющееся звено в полипептидной цепи, то таким образом можно определить общую формулу первичной структуры молекулы белка:
Поскольку белки построены из молекул α-аминокислот, то по химическим свойствам они подобныаминокислотам. Белки обладают амфотерными свойствами. Существуют качественные реакции, определяющие особенности в строении молекулы белка. Для белков характерно явление осаждения: обратимое осаждение или высаливание, необратимое осаждение или денатурация.
Контрольные вопросы и упражнения:
1. Среди представленных соединений, формулы которых приведены ниже, укажите амины:
ж) 
Определите первичные, вторичные, третичные амины алифатического и ароматического ряда. Назовите амины.
2. Приведите структурные формулы всех изомерных аминов состава C4H11N. Назовите структурные изомеры.
3. Напишите уравнения реакций соляной кислоты с анилином, метиламином. Назовите полученные соединения. Сравните основные свойства указанных аминов и аммиака
4.Представьте формулы биполярных ионов лизина (α, ε – диаминокапроновая кислота), глицина, аминомалоновой кислоты. Рассмотрите поведение ионов в кислой и щелочной средах.
5. Напишите уравнение образования дипептида из глицина (аминоуксусная кислота). Назовите полученное соединение.
Напишите уравнения реакций и структурные формулы реакций окисления и восстановления рибозы?
Химия | 10 — 11 классы
Напишите уравнения реакций и структурные формулы реакций окисления и восстановления рибозы.
1) Реакция окисления.
Образуется рибоновая кислота (2, 3, 4, 5 — тетрагидроксипентановая кислота).
2) Реакция восстановления.
Образуется рибит (пентанпентадиол — 1, 2, 3, 4, 5 или 1, 2, 3, 4, 5 — пентагидроксипентан).
Напишите уравнение реакции окисления альдегидов?
Напишите уравнение реакции окисления альдегидов.
Составьте уравнение реакции натрия с водой?
Составьте уравнение реакции натрия с водой.
Укажите окислитель и восстановитель, реакции окисления и восстановления.
1. Напишите реакцию окисления угарного газа до углекислого?
1. Напишите реакцию окисления угарного газа до углекислого.
2. напишите реакцию разложения гидрокарбоната кальция.
3. Напишите реакцию восстановления углекислого газа до угарного газа.
4. Напишите реакцию восстановления меди из ее оксида при помощи угарного газа.
Fe — — > ; FeCl2 — — > ; FeSO4 Напишите уравнения реакций и рассмотрите с позиции окисления — восстановления?
Fe — — > ; FeCl2 — — > ; FeSO4 Напишите уравнения реакций и рассмотрите с позиции окисления — восстановления.
Запишите в молекулярных и ионных формах.
Напишите уравнения химических реакций для следующих превращений?
Напишите уравнения химических реакций для следующих превращений.
При написании уравнений используйте структурные формулы органических веществ.
Укажите условия протекания реакций.
Напишите структурную формулу реакции дегидрирования 2 — метилпропена?
Напишите структурную формулу реакции дегидрирования 2 — метилпропена.
Напишите структурную формулу вещества состава С3Н8О, если известно, что оно реагирует с металлическим натрием с выделением водорода, а при окислении дает кетон?
Напишите структурную формулу вещества состава С3Н8О, если известно, что оно реагирует с металлическим натрием с выделением водорода, а при окислении дает кетон.
Напишите уравнения соответствующих реакций.
Предложите структурную формулу полисульфида K2S3?
Предложите структурную формулу полисульфида K2S3.
Напишите уравнение его реакции с соляной кислотой.
Разберите уравнение реакции с точки зрения окисления — восстановления :Al + CuCl2 — — > AlCl3 + Cu?
Разберите уравнение реакции с точки зрения окисления — восстановления :
Al + CuCl2 — — > AlCl3 + Cu.
Что называют реакцией восстановления, реакцией окисления и реакцией нейтрализации?
Что называют реакцией восстановления, реакцией окисления и реакцией нейтрализации.
На этой странице находится вопрос Напишите уравнения реакций и структурные формулы реакций окисления и восстановления рибозы?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
1 — 3 2 — 3 3 — 2 4 — 1 5 — 4 6 — 3 7 — 1 8 — 1 9 — 4 10 — 2 11 — 1.
Помогииитеее прошуу пожалуйста пожалуйста пожалуйста.
M = n x Mr — m = 3 x 17. 031 = 51. 093 V = n x 22. 4 — V = 3 x 22. 4 = 67. 2.
2Cu + O₂ (t) = 2CuO CuO + 2HCl = CuCl₂ + H₂O CuCl₂ + 2AgNO₃ = Cu(NO₃)₂ + 2AgCl↓ Cu(NO₃)₂ + 2NaOH = Cu(OH)₂↓ + 2NaNO₃.
8. 71г 3л X + H2O = XO + H2 хгр 22, 4л х = 8, 71гр * 22. 4л / 3л = 65гр По таблице Менделеева это цинк (Zn).
H2S + CuSO4 = CuS(осадок) + Н2SO4 m(CuSO4) = 200 * 0. 16 = 32г 32 : 160 = х : 96 х = 32 * 96 : 160 х = 19, 2 г.
Железо представляет собой серебристо — белый блестящий вязкий металл, внешне похож на платину. Железо легко растворяется в разбавленных кислотах, вытесняя из них водород и образуя ионы двухвалентного железа. Сера — твёрдое кристаллическое вещество.
1)Zn(0) — 2e—>Zn(2 + )|4 восстановитель S(6 + ) + 8e—>s( — 2)|1 окислитель S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O S(o) — 6e—>S(6 + )|1 восстановитель N( + 5) + 1e—>n( + 4)|6 окислитель 5H2SO4(конц) + 4zn = 4ZnSo4 + H2S + 4H2O 2)Zn(0) — 2e = Zn (2 + ) ..
Дано : V(H₂) = 22, 4л. Q = 484кДж Vm = 22, 4л. / моль — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — Q₁ — ? 1. Определим количество вещества водорода в 22, 4л. : n(H₂) = V(H₂) : Vm = 22, 4л. : 22, 4л. / моль = 1моль 2. Запишем тер..
http://lektsia.com/2x7b1.html
http://himia.my-dict.ru/q/7294755_napisite-uravnenia-reakcij-i-strukturnye-formuly/