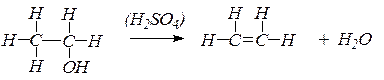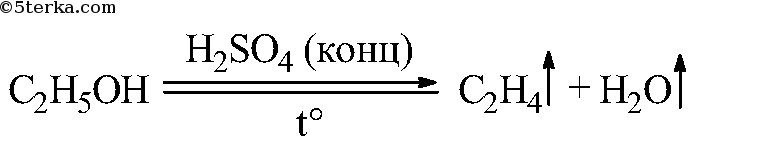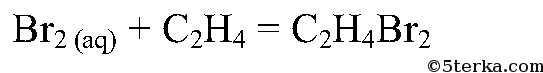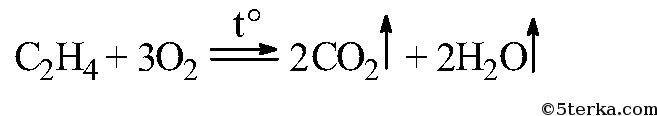Практ. 1
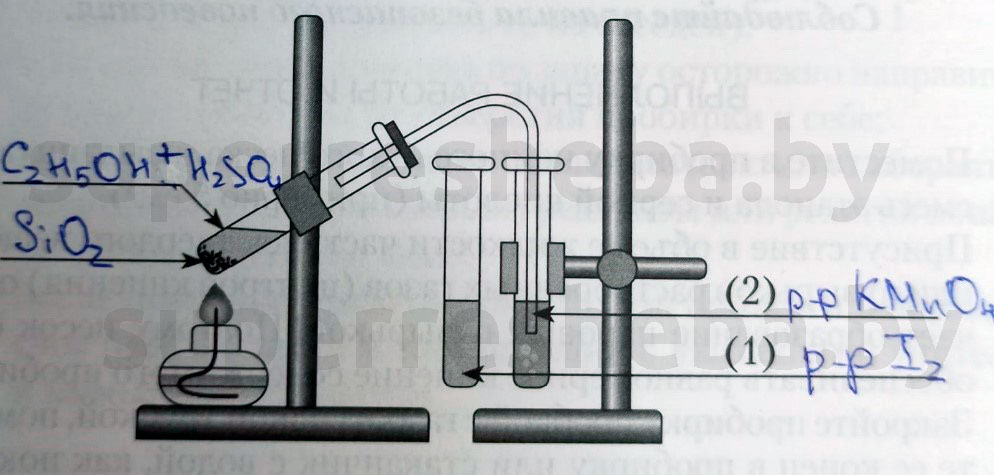
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Получение этилена и его горение
В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки — он горит светящимся пламенем.
CНз-СН2ОН + НОSОзН 
Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается:
СНз-СН2-OSOзН 
Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта:
Выделяющийся этилен горит светящимся пламенем:
C2H4 + ЗO2 
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4 + С 
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
Дата добавления: 2015-09-11 ; просмотров: 2986 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Практическое занятие № 8. Получение этилена и изучение его свойств
Задания. 1. Получите этилен из этилового спирта.
2. Проведите характерные реакции для этилена как представителя непредельных углеводородов.
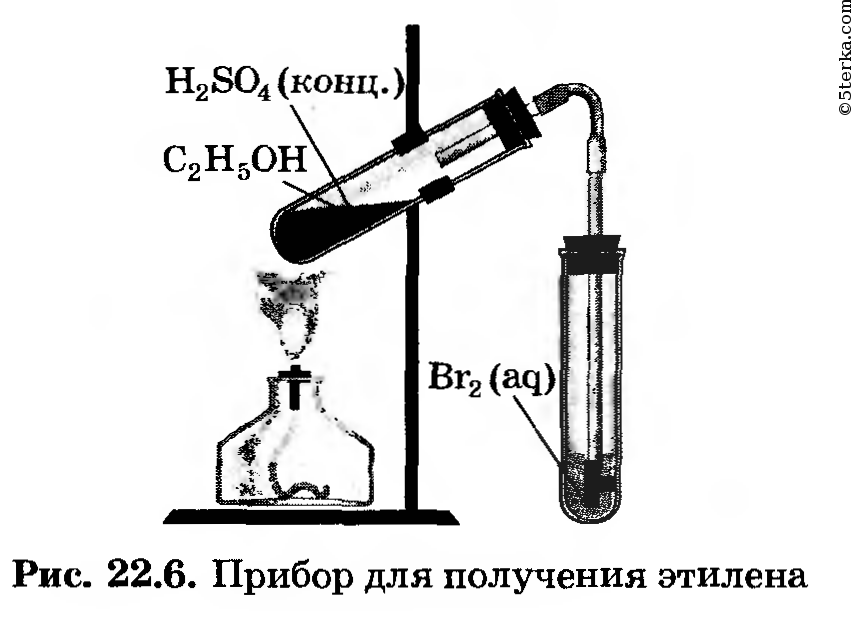
Оборудование. Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, чашка с песком, лабораторный штатив, горелка, спички, мензурка, свернутая спирально медная проволока, которая должна быть вложена в газоотводную трубку.
Вещества. Этиловый спирт, серная кислота (конц.), раствор бромной воды и розовый раствор подкисленного перманганата калия, промытый и прокаленный речной песок.
1. Получение этилена. Соберите прибор для получения этилена (рис. 22.6) и проверьте его на герметичность.
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка. Закройте пробирку пробкой с газоотводной трубкой и закрепите прибор в штативе.
2. В две пробирки прилейте по 2 мл растворов бромной воды и перманганата калия. Нагрейте в приборе для получения этилена смесь до кипения и, не переставая нагревать, но не перегревая, опустите конец газоотводной трубки сначала в
пробирку с бромной водой, а затем в пробирку с раствором перманганата калия.
Что вы наблюдаете? Составьте уравнения химических реакций: а) получения этилена из этилового спирта; б) взаимодействия этилена с бромной водой.
Направьте конец газоотводной трубки прибора вверх и подожгите лучиной выделяющийся этилен. Отметьте характер пламени. Внесите в пламя этилена на несколько секунд фарфоровую пластинку или чашу. Что вы наблюдаете?
Вдувайте воздух через стеклянную трубку с оттянутым концом в среднюю часть пламени этилена. Как изменяется яркость пламени? Почему? Составьте уравнение реакции горения этилена.
Концентрированная серная кислота обладает свойством отбирать воду у других веществ. Это свойство использовано для получения этилена.
Вода частично конденсируется на стенках пробирки и скатывается обратно в раствор. Этилен уходит по газообразной трубке. Свойства этилена:
При пробулькивании этилена через раствор бромной воды и перманганата происходит обесцвечивание.
Этилен горит желтым пламенем, при внесении фарфоровой чашки она чернеет, из-за неполного сгорания этилена образуется свободный углерод — сажа черного цвета. При вдувании воздуха в пламя этилена происходит полное сгорание этилена, и пламя из желтого становится синим.

задача №8
к главе «Практические занятия».
http://helpiks.org/5-16784.html
http://5terka.com/node/10050