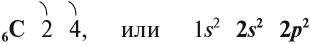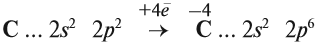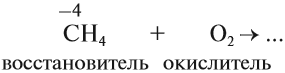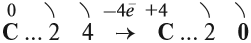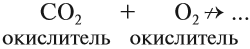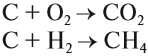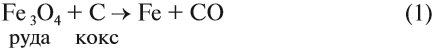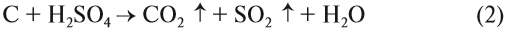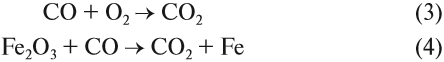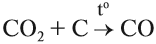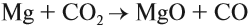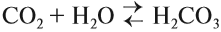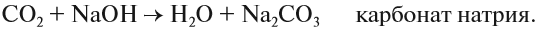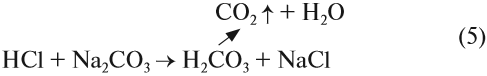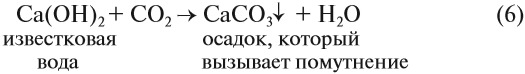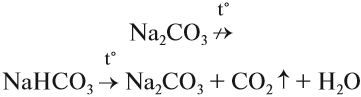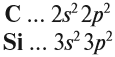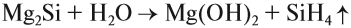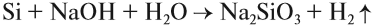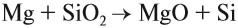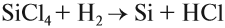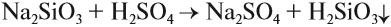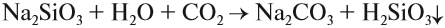2.3.4. Химические свойства углерода и кремния.
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 о С:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 о С:
С бромом – 620-700 о С:
С йодом – 750-810 о С:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300 о С) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 о С кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
2MgCl2 + SiH4↑» width=»276″ height=»35″/>
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500 о С. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Урок 13. Углерод и кремний
Строение атома и свойства углерода
Углерод — химический элемент четвертой группы второго периода, поэтому строение его атома можно показать схемой:
Имея четыре валентных электрона близко от ядра, атом углерода проявляет неметаллические свойства, т. е. способен принимать электроны.
Вопрос. Сколько электронов может принять атом углерода до завершения внешнего уровня?
Принимая четыре электрона, атом углерода приобретает степень окисления –4:
Вопрос. Может ли атом углерода в состоянии С –4 ещё принимать электроны? Как называются атомы, принимающие электроны (окислитель или восстановитель)?
Атом углерода в низшей степени окисления (–4) уже не может принимать электроны, но может их отдавать. Значит, атом углерода в низшей степени окисления –4 может быть только восстановителем. Поэтому метан СН4 (простейшее водородное соединение этого элемента) легко горит:
Задание 13.1. Закончить уравнение этой реакции (при затруднении см. урок 2.1).
Как известно, атомы неметаллов могут и отдавать электроны.
Вопрос. Какое максимальное число электронов может отдать атом углерода?
Отдавая четыре валентных электрона, атом углерода переходит в состояние С +4 :
Вопросы. Может ли атом углерода в этом состоянии ещё отдавать электроны? Как называются атомы, которые в окислительно-восстановительных реакциях отдают электроны?
Схема показывает, что атом углерода в высшей степени окисления +4 не может больше отдавать электроны, но может их присоединять, т. е. он может быть только окислителем. Поэтому углекислый газ СО2 (простейшее соединение такого атома) не горит:
Сделаем вывод: любой атом в высшей степени окисления может быть только окислителем; любой атом в низшей степени окисления может быть только восстановителем.
Разберём эти и другие свойства углерода и его соединений на конкретных примерах.
Начнём с того, что простое вещество с названием «углерод» в природе не существует! Дело в том, что атомы углерода поразному соединяются друг с другом, образуя разные простые вещества. Так, если атомы углерода образуют тетраэдрическую пространственную решетку:
то образуется самое твёрдое вещество алмаз. Из него делают драгоценные камни — бриллианты, а также режущие инструменты, например для резки стекла.
Если атомы углерода лежат в одной плоскости:
то образуется графит (от др.-греч. γράφω — пишу). Углеродные «пластинки» скользят друг относительно друга, и поэтому графит оставляет следы (графитный стержень карандаша) на бумаге. Подобную кристаллическую структуру (графита) имеют сажа, уголь, кокс. Эти вещества «пачкаются», а уголь и графит способны проводить электрический ток, что для неметаллов не характерно.
Если атомы углерода составляют линейную структуру:
то образуется карбин — он очень редко встречается в природе. Это очень прочное вещество.
Существование химического элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин — аллотропные видоизменения (модификации) углерода.
И алмаз, и графит, и карбин имеют почти одинаковые химические свойства, так как образованы одним химическим элементом. Рассмотрим эти свойства на примере графита или угля. Это чёрные блестящие вещества, способные (из-за особенностей внутреннего строения) проводить электрический ток. Поэтому графитовые и угольные стержни используют в качестве электродов в батарейках, при проведении электролиза и т. д.
Вопрос. Может ли атом углерода быть окислителем? Восстановителем? Почему?
Как было показано выше, атом углерода, как и атом почти любого неметалла, может и отдавать, и присоединять электроны, т. е. быть и окислителем, и восстановителем:
Задание 13.2. Определите, в какой из реакций атом углерода является окислителем, а в какой — восстановителем?
Чаще всего на практике используют восстановительные свойства углерода. Так, при помощи углерода (кокса) получают чистое железо (чугун) из природной руды:
Реакция с кислородом происходит при горении твёрдого топлива (угля).
Окислительные свойства углерода проявляются при взаимодействии с металлами. Так образуются карбиды.
Задание 13.3. Составьте уравнение реакции алюминия с углеродом. При затруднениях см. урок 7.3.
Карбиды металлов легко разлагаются водой и кислотами. При этом степени окисления не меняются:
Задание 13.4. Расставьте степени окисления атомов в последней схеме и убедитесь, что они не изменились.
Простые вещества, состоящие из атомов углерода, довольно инертны: они не реагируют со щелочами, растворами кислот, с водой при н. у. Только некоторые кислоты-окислители (азотная, концентрированная серная) могут окислить углерод:
При температуре 800 °C углерод реагирует с водяными парами:
В этой реакции получается газовая смесь, используемая как газообразное топливо — водяной газ.
Задание 13.5. Расставьте коэффициенты в уравнениях реакций (1) и (2) методом электронного баланса. Определите, какие свойства проявляет углерод в этих ОВР.
Свойства соединений углерода
Углерод образует два оксида:
Задание 13.6. Назовите эти оксиды. Определите характер этих оксидов. В каком из них углерод проявляет высшую степень окисления?
Угарный газ СО — несолеобразующий оксид*, т. е. он не образует неорганических солей ни с кислотами, ни с основаниями.
* Такие оксиды называются также безразличными, или индифферентными.
Имея промежуточную степень окисления (+2), углерод может быть и окислителем, и восстановителем, но для него более характерны восстановительные свойства:
Реакция (4) происходит в доменных печах при выплавке чугуна из железных руд (см. также урок 11.2). Реакция (3) происходит, когда появляются синие огоньки на непрогоревших углях в костре, печке. Дело в том, что угарный газ образуется при контакте углекислого газа (продукт сгорания любого топлива) с горячими углями при недостатке кислорода:
При достаточном доступе воздуха (кислорода) угарный газ сгорает полностью. Но если тяга плохая (доступ кислорода затруднён), то реакция (3) не происходит и угарный газ попадает в помещение. А это смертельный яд!
Углекислый газ дыхания не поддерживает, но и не ядовит.
Вопрос. Почему СО2 не горит в кислороде?
Имея высшую степень окисления, атом углерода углекислого газа С +4 : может быть только окислителем и с окислителем (кислородом) не реагирует. По этой же причине углекислый газ может реагировать с активными восстановителями (активными металлами, раскалённым углём:
Углекислый газ СО2 — кислотный оксид и образует при взаимодействии с водой слабую и неустойчивую угольную кислоту, которая существует только в растворах:
Угольную кислоту пил каждый, так как это обычная газированная вода. Она слегка пощипывает язык, но совсем не обжигает, потому что это слабая кислота.
Эта двухосновная кислота образует два вида солей — карбонаты (средние соли) и гидрокарбонаты (кислые соли):
Задание 13.7. Расставьте коэффициенты в последних двух уравнениях и определите, от чего зависит состав полученной соли.
Вопрос. Как, используя эти соли, получить углекислый газ?
Угольная кислота получается при действии более сильных кислот на карбонаты и гидрокарбонаты. Но в момент получения неустойчивая угольная кислота разлагается на углекислый газ и воду. Поэтому при действии более сильной, чем угольная, кислоты на карбонат выделяется углекислый газ:
Это качественная реакция на любые карбонаты, даже в смеси: если исследуемая смесь сухая, то под действием кислоты она «зашипит» из-за выделения газа.
Углекислый газ не имеет вкуса и запаха, не поддерживает горения (тлеющая лучинка гаснет в атмосфере углекислого газа), а при пропускании через известковую воду вызывает её помутнение:
Пользуясь химическими реакциями (5) и (6), а также зная свойства углекислого газа, можно обнаружить карбонаты и гидрокарбонаты в растворах и твёрдых смесях. Для этого нужно к твёрдой смеси добавить любую кислоту: смесь зашипит, если в её состав входит соль угольной кислоты. Если эта соль находится в растворе, то после добавления кислоты в нём появляются пузырьки углекислого газа. Так можно получить «газированный напиток».
Реакцию (5) можно использовании при получении СО2 в лаборатории.
Поскольку угольная кислота слабая, — все растворимые карбонаты подвергаются гидролизу.
Задание 13.8. Составьте уравнение реакции гидролиза карбоната калия (поташа).
В результате реакции гидролиза образуется щелочная среда, поэтому такие карбонаты как сода Na2СО3 и поташ К2СО3 используются как заменители щелочей, например при варке мыла.
Гидрокарбонаты слабо подвергаются гидролизу и, в отличие от карбонатов, легко разлагаются при нагревании:
Поэтому питьевую соду NаНСО3 добавляют в печенье и другие мучные кондитерские изделия, которые от этого становятся более пышными и рыхлыми. Питьевую соду применяют при производстве шипучих напитков (в присутствии органических кислот образуется углекислый газ), ею заправляют огнетушители, её же используют в медицине для полосканий и ингаляций.
Строение атома и свойства кремния
Поскольку кремний и углерод находятся в одной подгруппе, то распределение валентных электронов у них одинаково:
Кремний тоже проявляет неметаллические свойства, т. е. способен и принимать, и отдавать электроны.
Задание 13.9. Определите степени окисления атома кремния. Составьте формулы его простейших соединений.
Неметаллические свойства кремния выражены слабее, чем у углерода. Это проявляется в том, что, во-первых, кремний внешне похож на металл, является полупроводником. Эти свойства кремния высокой чистоты нашли применение в электронике. Во-вторых, кислотные свойства оксида и гидроксида кремния выражены слабее, чем у углерода. Рассмотрим эти свойства.
Кремний — по распространённости в природе уступает только кислороду: каждый пятый атом в Земной коре принадлежит кремнию. Массовая доля кремния в Земной коре составляет 29,5 %. В виде простого вещества кремний не встречается в природе, но его оксид известен каждому: это обычный песок (кремнезём) SiO2. Это — самое распространённое твёрдое вещество на нашей планете, так как на него приходится 12 % Земной коры. Этот же состав имеет кварц, кремень. Многие горные породы содержат этот оксид, т. е. являются силикатами. Таких соединений — 75 % от массы Земной коры! Поэтому название химического элемента происходит от греческого слова «кремнос», что означает «утёс, скала».
Простое вещество кремний — это серебристо-серые кристаллы с металлическим блеском. Атомы кремния расположены в этих кристаллах так же, как атомы углерода в алмазе, но связи менее прочные (длина связи больше, потому что радиус атома больше), и кремний уступает по твёрдости алмазу.
Именно кремень использовали древние люди для изготовления первых орудий труда, этот твёрдый камень позволил нашим предкам приручить огонь. До той поры, как были изобретены спички, люди высекали искру при помощи кремня. Первые образцы стекла, возраст которых около 5 тыс. лет, тоже содержат оксид кремния.
В подавляющем большинстве соединений кремний четырёхвалентен. Кремний — довольно инертное вещество, которое при нормальных условиях реагирует только с фтором. При нагревании до 400…600 °C он взаимодействует с хлором, бромом, кислородом, а также с активными металлами, образуя силициды. С водородом кремний не реагирует.
Задание 13.10. Составьте уравнения перечисленных реакций.
Силициды, так же как и карбиды, разлагаются водой и растворами кислот.
При этом образуется крайне ядовитый газ силан. Это настолько сильный восстановитель, что он самовоспламеняется на воздухе.
Задание 13.11. Составьте уравнение реакции горения силана.
В результате образуется облачко дыма, который состоит из мельчайших частичек оксида кремния. Этот оксид, в отличие от аналогичного оксида углерода, является твёрдым веществом.
Кремний, в отличие от углерода, не реагирует с водой и кислотами, но реагирует со щелочами:
В этой реакции образуется силикат натрия — соль кремниевой кислоты.
Кремний образуется при взаимодействии его оксида с магнием, алюминием или коксом:
Образующийся при этой реакции кремний обычно загрязнён силицидами. Кремний высокой чистоты, необходимый для электроники, получают восстановлением хлорида кремния водородом:
Создание и применение современных компьютеров без кремния немыслимо. Этот же неметалл необходим для создания солнечных батарей — источников электрического тока, в которых преобразуется энергия Солнца.
Кремниевая кислота и силикаты
Как уже упоминалось, минералы, основу которых составляет оксид кремния, составляют около 12 % земной коры. К ним относятся песок и кварц, горный хрусталь и полудрагоценные камни (яшма, агат и др.). Песок — это тугоплавкое вещество, при остывании расплава которого образуется кварцевое стекло. Обычное стекло образуется при сплавлении этого оксида с карбонатами кальция и натрия.
Оксид кремния относится к кислотным оксидам, поскольку кислоты не действуют на этот оксид, а со щелочами и основными оксидами он образует соли.
Задание 13.11. Составьте уравнения реакций оксида кремния с гидроксидом кальция и оксидом магния. Вспомните, где происходят эти процессы (см. урок 9).
Но с водой этот кислотный оксид не реагирует, так как соответствующий гидроксид (кислота) нерастворим в воде. Кремниевая кислота H2SiO3– аморфное бесцветное вещество, которое легко теряет влагу и превращается в пористый силикагель. Силикагель, как и активированный уголь, используется в качестве адсорбента*.
* Адсорбент — материал, поглощающий влагу, запахи и др. вещества.
Кремниевые кислоты образуются под действием любой кислоты на раствор силиката. При этом образуется студенистый осадок:
Эту реакцию можно считать качественной на силикаты, потому что при действии кислот на различные соли только силикаты дают осадок кислоты.
Концентрированный раствор силикатов калия и натрия называется «жидкое стекло» и применяется в качестве канцелярского клея. Этот клей под действием углекислоты воздуха застывает:
Растворимые силикаты сильно гидролизуются.
Задание 13.12. Составить уравнение реакции гидролиза силиката, определить реакцию среды.
Создавая щелочную среду и связывая ионы кальция и магния, эти силикаты облегчают процессы стирки и входят в состав некоторых моющих средств. Если растворимым стеклом пропитать текстиль или древесину, то они не возгораются. Но не всякий текстиль выдерживает такую обработку: сильно щелочная среда разрушает материал.
Если внимательно посмотреть по сторонам, то искусственно полученные силикаты окружают нас со всех сторон. Это:
- керамические изделия (вазы, чашки, сковородки с керамическим покрытием, к которому не пригорает пища),
- кирпичи, стекло, цемент и бетон, другие строительные материалы;
- изделия из фарфора и фаянса (чашки и тарелки).
Задание. Найдите у себя дома несколько предметов, которые выпускает силикатная промышленность.
Выводы
Углерод — самый распространённый химический элемент в органической, т. е. живой природе. Атомы углерода способны реагировать друг с другом, образуя углеродные цепи (как у карбина). Такие углеродные цепочки составляют основу любого органического соединения, которые и составляют основу жизни на Земле.
К неорганическим относятся только простейшие соединения углерода: угарный газ, углекислый газ и соли угольной кислоты.
Кремний играет в неживой природе такую же роль, как углерод — в живой природе. Атомы кремния придают растениям особую прочность. Без кремния ни трава, ни деревья не могли бы расти вверх, а стелились бы по земле. Минералы, основу которых составляет оксид кремния, составляют около 12 % земной коры.
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
http://himi4ka.ru/samouchitel-po-himii/urok-13-uglerod-i-kremnij.html
http://chemege.ru/silicium/