Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Формула масляной кислоты, свойства, риски и использованиемасляная кислота, также известная как н-бутановая кислота (в системе IUPAC), это карбоновая кислота со структурной формулой CH3CH2CH2-COOH. Он классифицируется как жирная кислота с короткой цепью. Имеет неприятный запах, острый вкус и в то же время немного сладковатый (похож на эфир). Его структура показана на рисунке 1. Он содержится особенно в прогорклом масле, сыре пармезан, сыром молоке, животных жирах, растительных маслах и рвоте. Его название происходит от греческого слова βουτυρος, что означает «масло» (contributors, 2016).. Масляная кислота образуется в толстой кишке человека в результате бактериальной ферментации углеводов (в том числе пищевых волокон) и, предположительно, подавляет колоректальный рак. Масляная кислота — это жирная кислота, которая встречается в форме сложных эфиров в животных жирах и растительных маслах. Интересно, что низкомолекулярные эфиры масляной кислоты, такие как метилбутират, имеют в основном приятные ароматы или ароматизаторы (Центр метаболических инноваций, S.F.).
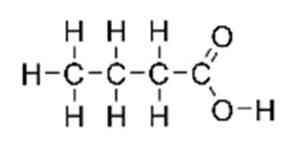
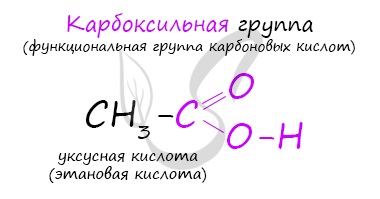
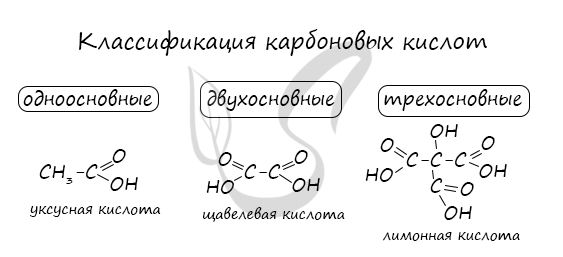
Физико-химические свойства масляной кислотыМасляная кислота — бесцветная жидкость с неприятным запахом прогорклого масла. У этого также есть определенный вкус масла. Он имеет молекулярную массу 88,11 г / моль и плотность 0,9528 г / мл при комнатной температуре. Температура его плавления составляет -5,1 ° С, а температура кипения составляет 163,75 ° С.. Соединение растворимо в воде, этаноле и эфире. Он мало растворим в четыреххлористом углероде. Это слабая кислота, что означает, что она не диссоциирует полностью, ее pKa составляет 4,82 (Национальный центр биотехнологической информации, S.F.). Изомер 2-метилпропановой кислоты (изомасляной), (CH3) 2CHCO2H, найден как в свободном состоянии, так и в его этиловом эфире в нескольких растительных маслах. Хотя это коммерчески менее важно, чем масляная кислота (Brown, 2011). Масляная кислота может реагировать с окислителями. Реакции накаливания происходят с триоксидом хрома при температуре выше 100 ° С. Они также несовместимы с основаниями и восстановителями. Может атаковать алюминий и другие легкие металлы (BUTYRIC ACID, 2016). Реактивность и опасностиМасляная кислота считается легковоспламеняющимся соединением. Несовместим с сильными окислителями, алюминием и большинством других металлов, щелочами, восстановителями (Royal Society of Chemistry, 2015). Соединение очень опасно в случае контакта с кожей (может вызвать ожоги), при проглатывании, попадании в глаза (раздражение) и вдыхании (может вызвать сильное раздражение дыхательных путей). Распыленная жидкость или туман могут вызвать повреждение тканей, особенно слизистых оболочек глаз, рта и дыхательных путей.. Вещество токсично для легких, нервной системы, слизистых оболочек. Повторное или длительное воздействие вещества может вызвать повреждение этих органов, а также раздражение дыхательных путей, приводящее к частым приступам бронхиальной инфекции (паспорт безопасности материала масляная кислота, 2013 г.). В случае попадания в глаза следует проверить, есть ли у жертвы контактные линзы, и снять их. Глаза жертвы следует промывать водой или физиологическим раствором в течение 20-30 минут, одновременно вызывая больницу. В случае контакта с кожей пораженный участок следует погрузить в воду, одновременно снимая и изолируя всю загрязненную одежду. Аккуратно промойте все пораженные участки кожи водой с мылом. Медицинская помощь должна быть получена. В случае вдыхания, вы должны оставить загрязненный участок в прохладном месте. При появлении симптомов (например, хрипы, кашель, одышка или жжение во рту, горле или в груди), обратитесь к врачу.. В случае проглатывания не следует вызывать рвоту. Если пострадавший находится в сознании и у него нет судорог, следует ввести один или два стакана воды, чтобы разбавить химическое вещество и вызвать больницу или токсикологический центр.. Если жертва находится в конвульсии или без сознания, не давайте ничего внутрь, убедитесь, что дыхательные пути жертвы открыты, и поместите жертву сбоку, опустив голову ниже тела. Необходимо немедленно обратиться к врачу. Использование и польза для здоровьяНизкомолекулярные сложные эфиры масляной кислоты, такие как метилбутират, имеют запах и вкус, обычно приятные. Из-за этого они находят применение в качестве пищевых и парфюмерных добавок.. Бутират, конъюгированное основание масляной кислоты, может быть найдено в нескольких продуктах. Он также может быть добавлен в качестве добавки или ароматизатора в других. Сложные эфиры масляной кислоты или бутираты используются для изготовления искусственных ароматизаторов и эссенций растительного масла. Бутиламират является основным ингредиентом абрикосового масла, а метилбутират можно найти в ананасовом масле.. Помимо использования в качестве ароматизатора, ананасовое масло также используется для стимулирования роста костей, лечения стоматологических операций и лечения простуды, ангины и острого синусита, в соответствии с производителем натуральных продуктов OCA Brazil (PULUGURTHA, 2015). Бактерии, обнаруженные в желудочно-кишечном тракте, могут продуцировать значительные количества ферментированного бутирата, пищевых волокон и неперевариваемых углеводов. Употребление в пищу продуктов, богатых клетчаткой, таких как ячмень, овес, неочищенный рис и отруби, — это полезный способ повысить уровень бутирата. Исследование, опубликованное в ноябрьском выпуске «Журнала питания» за ноябрь 2010 года, указывает на то, что употребление в пищу злаков в ночное время, богатых неусвояемыми углеводами, может повысить концентрацию бутирата плазмы на следующее утро.. Он добавляет, что это может быть механизм, с помощью которого цельное зерно помогает предотвратить диабет и болезни сердца. Масляная кислота, как и бутират, образуется в толстой кишке человека как продукт ферментации волокон, и это считается фактором, объясняющим, почему диеты с высоким содержанием клетчатки защищают от рака толстой кишки.. Было рассмотрено несколько гипотез о возможном механизме этих взаимоотношений, в том числе о том, важен ли бутират для поддержания нормальной фенотипической экспрессии эпителиальных клеток или для улучшения удаления поврежденных клеток посредством апоптоза.. Другие преимущества масляной кислоты или бутирата: Карбоновые кислотыКарбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH. Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 . Классификация карбоновых кислотПо количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
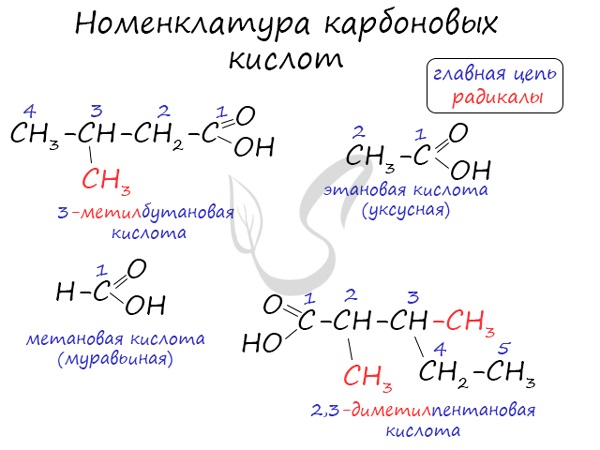
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят. Номенклатура и изомерия карбоновых кислотНазвания карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д. Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
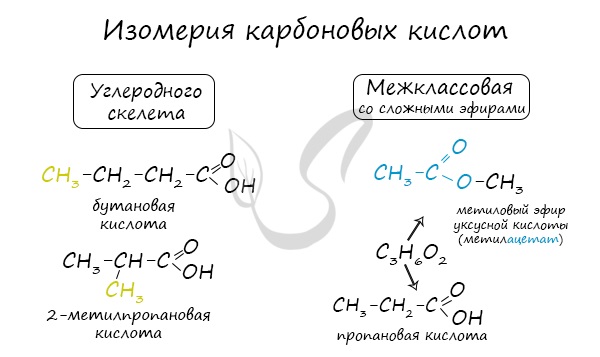
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами. Получение карбоновых кислот
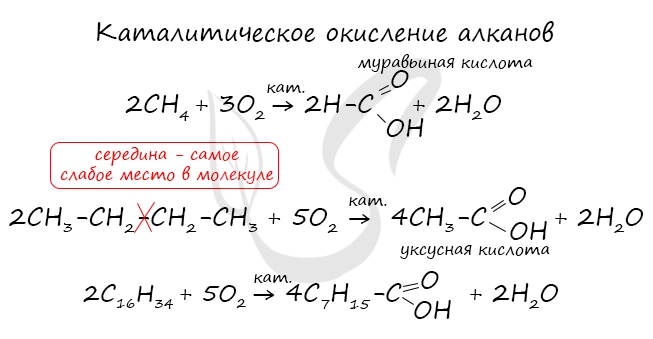
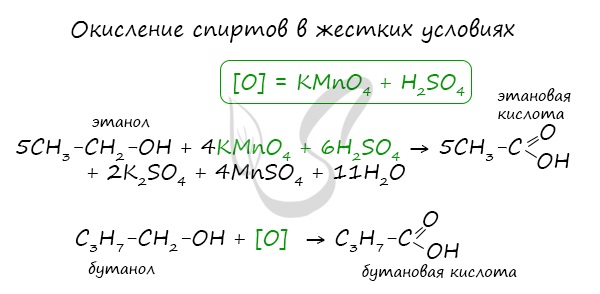
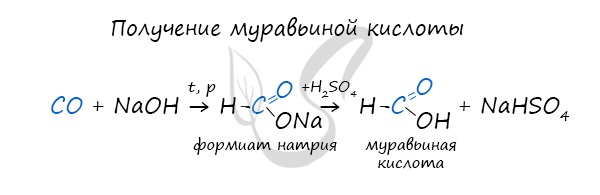
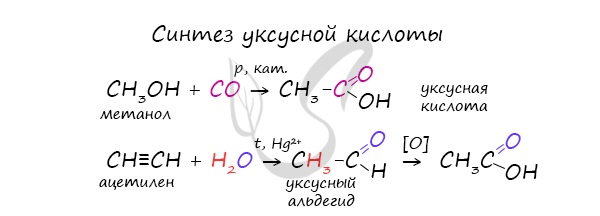
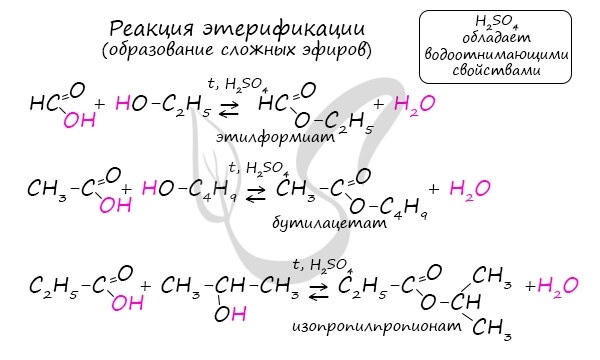
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты. При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот. При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала. Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли. Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I. Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты). При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота. Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется. Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II. Химические свойства карбоновых кислотДля карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты. Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты. Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода. Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная. Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность. Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала. В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду. При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ. Сложные эфирыПолучение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта. Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
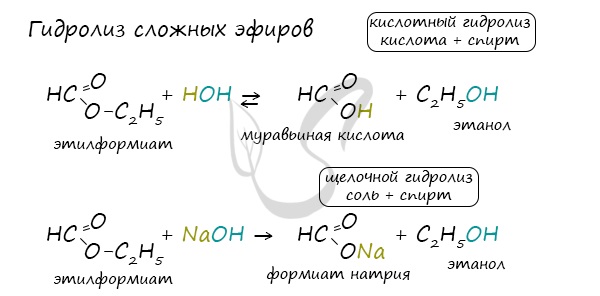
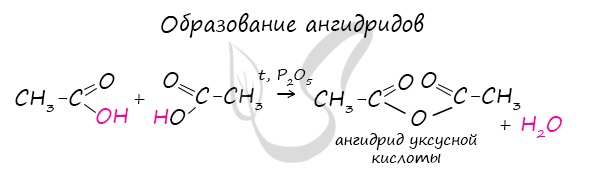
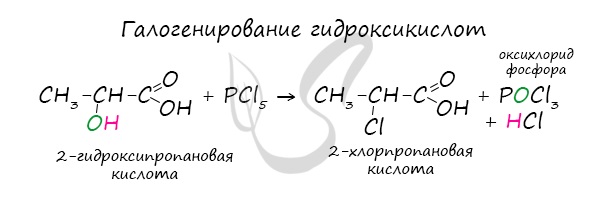
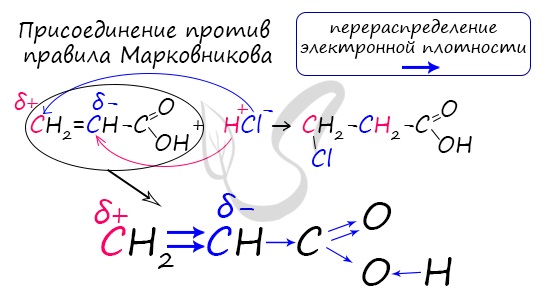
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота. Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров. АнгидридыАнгидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации. Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V. Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена. Непредельные карбоновые кислотыРаспределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. источники: http://ru.thpanorama.com/articles/qumica/cido-butrico-frmula-propiedades-riesgos-y-usos.html http://studarium.ru/article/190 |