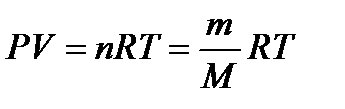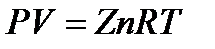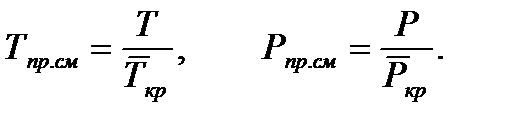Уравнение состояния идеального и реального газа.
Уравнение состояния идеальных газов.аналитическая зависимость между основными параметрами состояния газа (объем, давление и температура). Уравнением состояния идеальных газов называют уравнение Менделеева-Клапейрона или Клапейрона-Менделеева,
где Р – абсолютное давление, Па; V – объем занимающий газом, м 3 ; n – число киломолей газа; m – масса вещества; М – молекулярная масса; Т – абсолютная температура, К; R – универсальная газовая постоянная, 8314,3 Дж/(кмоль∙К).
Универсальная газовая постоянная – это работа расширения одного моля газа при нагревании на один градус при постоянном давлении. В системе СИ измеряется Дж/(моль*К) и равняется 8,3143.
Уравнение состояния реальных газовДля описания поведения природных газов во время добычи, переработки и транспортировки, при давлениях выше атмосферного, наиболее широко в отрасли используется следующее уравнение:
где Z – безразмерный коэффициент сферхсжимаемости газа, который вводится в уравнение состояния идеального газа, для того чтобы учитывать отклонение реального газа от законов идеального.
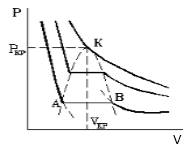
7. Критические параметры газа: Ткр , Ркр .
Критическим состоянием вещества (газа) является такое состояние, при котором исчезает граница между его газовой и жидкой фазой и свойства этих фаз становятся равными друг другу.
Критические параметры газа.Критической называется такая температура, выше которой, при любом давлении, газ не может быть переведен в жидкое состояние. Давление, необходимое для сжижения газа при критической температуре, называется критическим.Приведенные параметры газа.Приведенными параметрами называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, температура, плотность, удельный объем) больше или меньше критических:
Дата добавления: 2016-12-27 ; просмотров: 5560 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение состояния вещества
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления p , объема V и температуры (масса тела или системы, как правило, известна).
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз ( 2 ) , ( 3 ) , ( 5 ) :
p V = m μ R T = ν R T ( 2 ) .
Уравнение ( 2 ) – уравнение Менделеева-Клапейрона, где m – это масса газа, μ – это молярная масса газа, R = 8 , 31 Д ж м о л ь · К – это универсальная газовая постоянная, ν – это число молей вещества.
где N – это количество молекул газа в массе m , k = 1 , 38 · 10 — 23 Д ж К , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на 1 молекулу и
N A = 6 , 02 · 10 23 м о л ь — 1 – это постоянная Авогадро.
Если поделить в ( 4 ) обе части на V , то получаем следующий вид записи уравнения состояния идеального газа:
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
p + a V μ 2 V μ — b = R T ( 6 ) ,
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
b = N A 2 3 πd 3 ( 7 ) ,
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
a = — 2 πN A 2 ∫ d ∞ W p ( r ) r 2 dr ( 8 ) ,
где W p ( r ) – это потенциальная энергия притяжения 2 -х молекул.
При увеличении объема значение поправок в уравнении ( 6 ) становится менее существенным. И в пределе уравнение ( 6 ) превращается в уравнение ( 2 ) . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
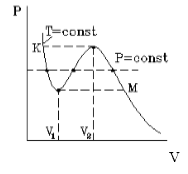
На рисунке 1 представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма 3 раза пересекает изобару. На участке
V 1 , V 2 давление увеличивается с ростом объема.
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок 2 ). Это особая точка К , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину n . В процессе, представленном на рисунке 3 , давление p
Из графика, приведенного на рисунке 3 , запишем уравнение процесса в параметрах p ( V ) :
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Моль кислорода охлаждают до — 100 ° C . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем V = 0 , 1 л . Необходимо также сравнить p с давлением идеального газа p i d , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса a и b , для кислорода a = 0 , 1358 П а · м 6 / м о л ь 2 , b = 3 , 167 · 10 — 5 м 3 / м о л ь .
Из уравнения Ван-Дер-Ваальса имеем:
p = R T V μ — b — a V μ 2
Переведем температуру в систему измерения: T = t + 273 , По условию T = 173 K , V = 0 , 1 л = 10 — 4 м 3 .
Произведем расчет: p = 8 , 31 · 173 ( 10 — 3 , 2 ) · 10 — 5 — 0 , 1358 ( 10 — 4 ) 2 = 75 , 61 · 10 5 ( П а ) .
Для идеального газа:
Рассчитаем: p i d = 1 · 8 , 31 · 173 10 — 4 = 143 · 10 5 ( П а ) .
Основы теплотехники
Основные законы теплотехники
Идеальные и реальные газы
Превращение теплоты в механическую работу в тепловых установках происходит при участии рабочего тела, которым обычно является газ или пар. Газы, которые существуют в природе, называют реальными . Молекулы этих газов имеют конечный объем, между ними существуют силы притяжения, существенно влияющие на их энергетические параметры.

Для простоты изучения свойств газообразного рабочего тела введено понятие идеального газа – воображаемого газа, в котором молекулы рассматриваются, как материальные точки, обладающие некоторой массой, но силы взаимодействия между этими точками при анализе состояния рабочего тела и происходящих в нем процессов не учитываются.
При больших объемах и малых давлениях, когда расстояние между молекулами во много раз больше собственных размеров молекул, а также при высоких температурах, когда интенсивность хаотического движения молекул велика, и поэтому они слабо взаимодействуют между собой, складываются условия, при которых реальный газ можно с некоторым приближением считать идеальным.
Это позволяет вести расчеты для реальных газов по уравнениям и зависимостям, выведенным для идеальных газов, что упрощает сами расчеты и понимание сущности процессов, происходящих в газах. В связи с этим изучение термодинамических свойств идеальных газов имеет не только теоретическое, но и большое практическое значение.
Газовые законы термодинамики
Основными законами для идеальных газов, применяемыми в термодинамике, являются закон Бойля — Мариотта, закон Гей-Люссака, закон Шарля и закон Авогадро. Эти законы устанавливают зависимости между основными параметрами газов – давлением, объемом, температурой и молекулярной массой.
Впоследствии газовые законы, описывающие процессы в термодинамических системах с одним неизменным и двумя переменными параметрами газа, были объединены учеными Клайпероном и Менделеевым в уравнениях, описывающей процессы системы при всех переменных параметрах рабочего тела.
Закон Бойля — Мариотта
Закон Бойля — Мариотта утверждает, что произведение абсолютного давления газа на его удельный объем в изотермическом процессе (при постоянной температуре) есть величина постоянная:
Чтобы понять смысловую суть этого закона следует представить термодинамическую систему, состоящую из цилиндра с подвижным поршнем, заполненного в надпоршневом пространстве газом (рис. 1) . Система термоизолирована — тепло к ней не подводится и не отводится.

Очень медленное перемещение поршня в этом случае необходимо для того, чтобы не вызывать изменение температуры газа в процессе сжатия или расширения.
Закон справедлив для термодинамических систем с идеальным рабочим телом, в которых неизменным параметром является температура, а переменными — давление и объем. Подобные процессы (протекающие при постоянной температуре) называют изотермическими — абсолютная температура рабочего тела в системе постоянна.
Это не означает, что исключен подвод (или отвод) тепла к термодинамической системе в целом, однако тепловая энергия в этом случае не должна оказывать влияние на температуру газа (рабочего тела), а использоваться, например, для выполнения работы путем преобразования в другой вид энергии. Процессы, при которых полностью исключается подвод и отвод тепла к термодинамической системе носят название адиабатных процессов .
Закон Бойля — Мариотта — один из основных газовых законов, открытый в 1662 году английским ученым Робертом Бойлем. В 1676 году, независимо от выводов Р. Бойля, закон был вторично описан французским физиком Эдмом Мариоттом, поэтому носит двойное название по фамилиям авторов.
Закономерность, установленная Р. Бойлем и Э. Мариоттом, справедлива для идеальных газов, но может быть с высокой степенью точности применима и для разреженных газов. Для сжатых газов применение закона Бойля — Мариотта приводит к большим погрешностям.
Следует отметить, что применение закона Бойля — Мариотта, связывающего начальные и конечные величины давления и объёма газа друг с другом, не ограничивается изотермическими процессами. Он с достаточной степенью точности справедлив и в тех случаях, когда в ходе термодинамического процесса температура изменяется, но начальная и конечная температура газа в результате процесса оказываются равными.
Закон Гей-Люссака
Закон Гей-Люссака гласит, что при постоянном давлении (изобарный процесс) удельный объем газообразного вещества (объем постоянной массы газа) изменяется прямо пропорционально изменению абсолютных температур:
Для простоты рассмотрим, опять же, термодинамическую систему, состоящую из цилиндра с абсолютно подвижным (трение между стенками цилиндра и поршнем отсутствует) и невесомым поршнем. Над поршнем в цилиндре поместим газ.
Очевидно, что при нагреве газа поршень переместится в сторону увеличения объема газа. При этом изменение объема газа будет прямо пропорционально изменению его абсолютной температуры, поскольку мы исключили изменение давления за счет отсутствия сил трения и тяжести, действующих на поршень.
Закон носит имя одного из своих первооткрывателей — французского физика и химика Жозефа Луи Гей-Люссака, описавшего его в 1802 году. В разных источниках (особенно, зарубежных) этот закон нередко упоминается под названием закон Шарля, по имени француза Жака Шарля, который описал его в неопубликованной работе, датируемой 1787 годом.
Авторство приписывают, также, таким видным ученым конца XVII — начала XVIII века, как английский физик Джон Дальтон и французский ученый Гийом Амонтон.
В русскоязычных учебниках этот закон обычно называют по имени Гей-Люссака, который первым продемонстрировал его применимость ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения.
Закономерность, описанная Ж. Л. Гей-Люссаком, справедлива в системах с одним неизменным параметром — давлением, и переменными параметрами — температура — удельный объем. Такие термодинамические процессы (протекающие при постоянном давлении) называют изобарными (иногда — изобарическими) .
Закон Шарля
Закон Шарля, который иногда называют вторым законом Гей-Люссака, заключается в том, что при неизменном удельном объеме абсолютные давления газа изменяются прямо пропорционально изменению абсолютных температур:
Смысловое содержание закона Шарля проще понять, представив герметичный абсолютно жесткий сосуд, заполненный газом. Тогда при нагреве газа его давление будет увеличиваться прямо пропорционально увеличению абсолютной температуры, т. е. при увеличении абсолютной температуры в три раза, давление газа тоже возрастет в три раза и т. п.
Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Жаком Шарлем, который исследовал термодинамические процессы имеющие место в идеальных газах.
Труды Шарля опубликованы не были, но его идеи были подхвачены видными физиками — Гей-Люссаком, Гильомом Амонтоном и другими, поэтому вопросы авторства некоторых основных законов термодинамики являются предметом спора между специалистами до сих пор.
Закономерность, открытая и описанная Ж. Шарлем, справедлива в системах с неизменным параметром — удельным объемом, и переменными параметрами — температура — давление. Такие термодинамические процессы (протекающие при постоянном объеме) называют изохорными (иногда — изохорическими) .
Закон Авогадро
Закон Авогадро утверждает, что все газы при одинаковом давлении и температуре содержат в равных объемах одинаковое число молекул. Из этого закона следует, что массы двух равных объемов различных газов с молекулярными массами μ1 и μ2 равны соответственно:
где: m1 и m2 – соответственно масса одной молекулы рассматриваемых газов; N – число молекул во взятом объеме.
Массы молекул пропорциональны молекулярным массам:
где z – коэффициент пропорциональности.
Тогда можно записать:
откуда получим пропорциональную зависимость:
Поскольку мы взяли равные объемы газов, то, разделив числитель и знаменатель левой части уравнения на объем, получим:
где: ρ1 и ρ2 – плотность рассматриваемых газов.
Так как удельный объем v является величиной, обратной плотности, т. е. v = 1/ρ , то можно записать полученную зависимость в следующем виде:
т. е. произведение удельного объема на молекулярную массу постоянно для любого газа при одинаковых условиях (давлении и температуре) .
Закон Авогадро можно сформулировать и так: объем киломоля различных газов при аналогичных физических условиях одинаков.
Этот закон был описан в 1811 году итальянским физиком Амедео Авогадро.
Закон Дальтона
Рабочее тело, используемое в термодинамических установках, обычно представляет собой смесь нескольких газов. Например, в двигателях внутреннего сгорания в состав продуктов сгорания, являющихся рабочим телом, входят водород, кислород, азот, окись углерода, углекислый газ, водяные пары воды и некоторые другие газообразные вещества.
В 1801 году английский физик Джон Дальтон установил закон, согласно которому давление, оказываемое смесью равно сумме парциальных давлений отдельных газов, входящих в состав смеси.
Парциальным давлением называют давление компонента смеси, которое он создавал бы, находясь один в занимаемой смесью объеме при температуре смеси.
Это утверждение легко доказать основываясь на выводах из закона Бойля — Маритта, рассматривая парциальные компоненты газовой по отдельности и в смеси.
Закон Дальтона применим для идеальных газов, и может быть использован для реальных газов, имеющих близкие к идеальным физические свойства и параметры.
Уравнение состояния газа
Газовые законы, описанные в начале статьи, справедливы для систем, в которых хотя бы один параметр рабочего тела в процессе остается неизменным. Такие процессы, в зависимости от того, какой из параметр постоянен, называют изотермическими, изобарными или изохорными.
На практике обычно приходится наблюдать термодинамические процессы, во время которых изменяются все основные параметры рабочего тела — политропные процессы .
Для описания политропных процессов учеными Клайпероном и Менделеевым были предложены уравнения состояния газа, полученные, на основе анализа рассмотренных ранее газовых законов Бойля-Мариотта, Гей-Люссака, Шарля и Авогадро.
Предположим, что 1 кг газа переходит из состояния, характеризующегося параметрами p1 , v1 , T1 в другое состояние – с параметрами p2 , v2 , T2 . Допустим, что этот переход происходит сначала при постоянной температуре Т1 до промежуточного удельного объема v’ , а затем при постоянном давлении р2 до конечного удельного объема v2 .
Тогда по закону Бойля — Мариотта имеем:
Следующая часть процесса протекает при постоянном давлении, начинается параметрами газа p2 , v’ , T1 и заканчивается параметрами газа v2 , T2 и p2 (последний параметр остался неизменным после первого перехода) . Тогда, в соответствии с законом Гей-Люссака, можно получить выражение при p = const:
Приравняв найденное выражение для v’ в первой и второй частях (переходах) процесса, получим:
Преобразовав это равенство, имеем:
На основании полученного в результате уравнения, можно сделать вывод, что отношение произведения абсолютного давления газа на его удельный объем к абсолютной температуре есть величина постоянная. Для 1 кг газа эту величину называют удельной газовой постоянной и обозначают R :
pv/T = R или pv = RT .
Полученное уравнение называют уравнением состояния идеального газа или уравнением Клайперона.
Впервые это уравнение предложил французский физик и инженер Бенуа Поль Эмиль Клайперон, который долгое время жил и работал в России. Исследуя известный термодинамический цикл Карно, Клайперон в 1834 году вывел уравнение состояния идеального газа, которое носит его имя.
Так как R – величина постоянная для каждого газа, можно определить любой основной параметр газа, если известны два других его параметра.
Удельные газовые постоянные для большинства известных газов приведены в соответствующих справочных таблицах. Так, например, удельная газовая постоянная кислорода равна 259,8 Дж/(кг×К), углекислого газа — 188,9 Дж/(кг×К) и т. п.
Уравнение Менделеева — Клайперона
Если обе части уравнения состояния идеального газа (уравнения Клайперона) умножить на массу газа М , получим следующее выражение:
или, учитывая, что произведение массы на удельный объем это полный объем газа: Mv = V , получим:
Заменив в полученном уравнении объем газа его молекулярным объемом Vμ , а массу газа – молекулярной массой μ , получим уравнение состояния для 1 киломоля газа:
Уравнение состояния идеального газа в таком виде предложил в 1874 году Д. И. Менделеев, и, поскольку оно является частным случаем уравнения Клайперона, то носит название уравнения Менделеева — Клайперона для идеального газа (иногда его называют уравнением Клайперона — Менделеева) .
Из уравнения Менделеева — Клайперона можно определить универсальную газовую постоянную:
При нормальных физических условиях величина универсальной газовой постоянной равна
Используя универсальную газовую постоянную, легко определить величину удельной газовой постоянной для любого газа по формуле:
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-veschestva/
http://k-a-t.ru/teplotexnika/2_gaz_zakony/