Осмотическое давление растворов ВМС
Вязкость. Ассоциация. Осмотическое давление ВМС.
Осмотическое давление растворов ВМС
Осмотическое давление растворов низкомолекулярных и высокомолекулярных веществ определяется теоретически уравнением Вант-Гоффа: Росм = CRT
Осмотическое давление можно выразить и по другому: Росм = C/M•RT
где С — концентрация растворенного вещества в г/л; М — молярная масса растворенного вещества.
Таким образом, 2 уравнение можно использовать для определения молярных масс.
Пример: Рассмотрим систему, в которой раствор, содержащий 20 г гемоглобина в 1 л, помещен в правый сосуд, а чистая вода — в левый, отделенный от правого полупроницаемой мембраной (2). После достижения равновесия высота столба воды в правом сосуде на 7,78 см превышает высоту в левом сосуде. Температура системы поддерживается постоянной, равной 298 К. Какой же будет молярная масса гемоглобина?
Для определения М сначала рассчитывают осмотическое давление раствора:
где h — разность высот менисков (0,0778 м); р — плотность раствора (103 кг/м3); g — ускорение свободного падения (9,807 м/с2); А — площадь сечения трубки, м2.
Подставляя численные значения в уравнение, получаем:
Росм = 0,0778 м•103 кг/м3 •9,807 м/с2 = 762,46 кг/м•с2 = 762,46 н/м2.
Из уравнения (2) определяют молярную массу гемоглобина:
Ответ: 65040 г/моль
С повышением концентрации ВМС (кроме глобулярных полимеров) их осмотическое давление перестает подчиняться закону Вант-Гоффа и растет быстрее (рис. 3).
Причиной отклонений от закона Вант-Гоффа является относительная независимость теплового движения отдельных сегментов линейных макромолекул ВМС. Каждая макромолекула ведет себя как совокупность нескольких молекул меньшего размера. Это и проявляется в увеличении осмотического давления.
Для расчета осмотического давления растворов ВМС Галлер предложил уравнение
где М — молярная масса ВМС, г/моль; С — концентрация раствора ВМС, г/л;
? — коэффициент, учитывающий гибкость и форму макромолекулы в растворе.
Коэффициент ? зависит от природы растворителя и растворенного вещества, но не зависит от молярной массы растворенного полимера. С увеличением длины макромолекулы и разветвленности цепи величина ? растет. Увеличение эффективного числа подвижных единиц (кинетически активных единиц) в растворе учитывается дополнительным слагаемым ?С2.
При небольших концентрациях полимера значение слагаемого невелико и уравнение Галлера переходит в уравнение Вант-Гоффа. Уравнение Галлера можно преобразовать в уравнение прямой, разделив его обе части на С:
Измерив осмотическое давление растворов с различной концентрацией С, можно построить графическую зависимость величины Росм/С от С и найти значение молярной массы М полимера и коэффициента ? (рис. 4).
Осмометрическим методом обычно пользуются для определения молярных масс ВМС в интервале от 10 000 до 70 000 г/моль. Нижний предел зависит от свойств мембран, а верхний определяется той чувствительностью, при которой можно измерять осмотическое давление. Погрешность результатов измерений осмотического давления растворов ВМС может быть связано с присутствием в растворе низкомолекулярных электролитов. Чтобы предотвратить влияние последних, раствор ВМС предварительно диализуют.
Следует заметить, что молярные массы ВМС нельзя определить традиционным криоскопическим методом, так как разбавленные растворы ВМС в общем случае не подчиняются закону Рауля. Поэтому кроме описанного выше осмометрического метода разработаны и другие методы определения молярных масс ВМС: химический, вискозиметрический, методы седиментации и светорассеяния растворов, метод гель-фильтрации, электрофоретические и т.д. Ни один из перечисленных методов не является универсальным, так как каждый из них можно применять только при определенном диапазоне молярных масс полимеров.
Вязкость растворов ВМС
Вязкость жидкости можно определить как сопротивление жидкости передвижению одного ее слоя относительно другого. Любое перемещение одной части жидкости относительно другой тормозится силами притяжения между ее элементами. Иначе говоря, вязкость жидкости характеризует внутреннее трение, возникающее при перемещении слоев жидкости относительно друг друга.
Основы теории вязкости. При теоретическом рассмотрении вязкости жидкость представляется в виде бесструктурной непрерывной среды. Если к жидкости приложить силу, она начинает течь. Для жидкостей характерны два основных типа течения: ламинарное и турбулентное.
Ламинарным называют течение жидкости в виде параллельных слоев, не перемешивающихся между собой. Такое течение существует до тех пор, пока величина градиента скорости не слишком велика. При увеличении градиента скорости слои жидкости образуют завихрения и перемешиваются. В таких случаях ламинарный поток переходит в турбулентный и ситуацию трудно трактовать как теоретически, так и экспериментально. Рассматриваемые нами закономерности вязкости будут относиться только к ламинарному режиму течения.
Рассмотрим два примыкающих объемных элемента какой-то жидкости. Если один из них перемещается относительно другого под действием внешней силы, то между ними возникают силы, которые будут препятствовать такому перемещению, стараясь вернуть объемные элементы в их положение равновесия. Эта препятствующая сила (F) называется силой внутреннего трения (сопротивления).
Чтобы определить вязкость количественно, можно воспользоваться рис.5. Предположим, что один из объемных элементов жидкости, представленных на этом рисунке, движется со скоростью dv относительно второго элемента. Можно ожидать, что сила трения будет пропорциональна относительной скорости dv и площади контакта S между соседними элементами объема. Она будет обратно пропорциональна расстоянию dх между центрами этих элементов. Константа пропорциональности, связывающая силу трения и данные переменные, называется коэффициентом вязкости или просто вязкостью ?|. Обозначив силу трения через F, получим:
Это определение вязкости первоначально дал Ньютон. Оно является микроскопическим, выраженным через величины, которые нельзя измерить.
Единицей вязкости служит ньютон-секунда на квадратный метр (Н•с/м2 ) или паскаль-секунда (Па•с); раньше за единицу вязкости принимали пуаз:
Особенности вязкости растворов полимеров. Коэффициент вязкости ? не зависит ни от приложенного давления, ни от градиента скорости (в условиях равномерного ламинарного течения).
Жидкость, подчиняющаяся закону Ньютона, называется ньютоновской. Растворы ВМС не являются таковыми, поскольку величина их вязкости ? зависит от градиента скорости. Дело в том, что для растворов ВМС само явление течения обусловливает ориентацию растворенных макромолекул (рис.6).
При увеличении градиента скорости макромолекулы ориентируются вдоль оси потока, в связи с чем вязкость раствора ВМС снижается, и при определенных значениях градиента скорости надмолекулярные структуры могут разрушаться, вследствие чего раствор приобретет свойства ньютоновской жидкости. Жидкости, проявляющие подобные эффекты ориентации, называют неньютоновскими.
Вязкость растворов, содержащих макромолекулы полимера, обычно значительно выше вязкости растворов низкомолекулярных соединений и коллоидных растворов тех же концентраций. Поэтому только очень разбавленные растворы ВМС в условиях ламинарного течения можно считать ньютоновскими.
Увеличение вязкости раствора полимера по сравнению с вязкостью растворителя обусловлено не только его концентрацией, но и рядом параметров макромолекулы.
Такими параметрами являются:
- объем раствора, занимаемый макромолекулой (удельный объем);
- отношение длины молекулы к ее ширине (осевое отношение),
- жесткость молекулы.
Для глобулярных молекул, каковыми являются молекулы многих белков, принципиальное значение имеет молекулярный объем. Его можно легко связать с относительной молекулярной массой. В случае очень жестких тонких молекул, как, например, ДНК, основной эффект оказывает осевое отношение; оно также является функцией относительной молекулярной массы. Если же известна относительная молекулярная масса, то можно получить информацию об общей форме молекулы.
Поскольку измерения абсолютной вязкости затруднены, чаще определяют относительную вязкость. При добавлении полимера к растворителю с вязкостью ?о вязкость раствора увеличивается до ?. Отношение вязкости раствора к вязкости чистого растворителя называется относительной вязкостью ?отн
Относительное повышение вязкости раствора ВМС по сравнению с вязкостью растворителя называется удельной вязкостью ?уд. Она равна
Относительная и удельная вязкости являются безразмерными величинами и зависят от концентрации полимера. Но их невозможно связать непосредственно с параметрами макромолекулы (например, с ее формой и объемом), поэтому были введены понятия приведенной и характеристической вязкостен.
Удельная вязкость, отнесенная к единице концентрации, называется приведенной вязкостью
где С — массовая концентрация полимера, г/см3 .
Предельное значение приведенной вязкости в бесконечно разбавленном растворе назвали внутренней или характеристической вязкостью [?]:
Экспериментально ее определяют путем построения графика зависимости приведенной вязкости ?УД/С от различных концентраций полимера (рис. 7).
Такой график для достаточно разбавленных растворов полимеров носит прямолинейный характер. Экстраполируя прямую ?уд/С = /С) к С = О, на оси ординат отсекают отрезок, который соответствует предельному значению приведенной вязкости, т.е. характеристической вязкости [?].
Приведенная и характеристическая вязкости имеют размерности, обратные концентрации, т.е. см3 /г.
Характеристическая вязкость зависит от относительной молекулярной массы, формы и удельного объема макромолекулы, ее способности изменять форму в зависимости от природы растворителя (конформационные изменения), но она не зависит от концентрации полимера в растворе и скорости взаимного перемещения слоев жидкости.
Соотношение между характеристической вязкостью и относительной молекулярной массой полимера.
Штаудингер предложил формулу для определения относительной молекулярной массы ВМС:
где ?Уд — удельная вязкость раствора; К — константа, см3/г; М- относительная молекулярная масса ВМС; С — концентрация ВМС в растворе, г/см3 .
Из уравнения следует: ?уд /С =КМ
Отношение удельной вязкости к концентрации полимера (т.е. приведенная вязкость) пропорционально его относительной молекулярной массе и не зависит от его концентрации в растворе.
При выводе уравнения Штаудингер допустил, что приведенная вязкость не зависит от концентрации полимера и что линейные макромолекулы в растворе ведут себя как жесткие стержни. Но на самом деле это не так. Были предложены многочисленные эмпирические формулы, в которых их авторы пытались устранить недостатки уравнения Штаудингера. Наиболее широкое применение нашло так называемое обобщенное уравнение Штаудингера или уравнение Марка-Хаувинка-Куна:
где К и ? — постоянные для данного полимергомологического ряда и данного растворителя.
Эти константы обычно определяют опытным путем для каждой системы «растворитель — растворенное вещество», используя соединения с известной относительной молекулярной массой, потому что до сих пор нет теории, пригодной для их расчета. Константы К и ?, определенные для данной системы «полимер — растворитель», нельзя использовать для другой системы.
Константа К имеет величину порядка 10-4. У жестких макромолекул ??1, для гибких полимерных молекул, приближающихся по форме к сфере, ?? 0,5, а у сильно заряженных полиэлектролитов ??2.
Зависимость (13.13) можно записать также в виде lп[?]= lпК+ ?lпМ
Данное уравнение является уравнением прямой в координатах lпМ, lп[?]. Измерив характеристическую вязкость нескольких стандартных препаратов с известными относительными молекулярными массами и разместив соответствующие точки в координатах lпМ, lп[?] (рис. 8), можно убедиться в справедливости выражения (13.14) для данного случая. Если нанесенные на график точки действительно лежат на одной прямой, то длина отрезка, отсекаемого ею на оси lп[?], и тангенс угла ? ее наклона дают соответственно величины lпК и ? в формуле (13.14). Теперь не составляет труда вычислить или определить непосредственно на графике неизвестную относительную молекулярную массу фракции полимера, для которой измерена характеристическая вязкость.
Причиной отклонения вязкости растворов ВМС является взаимодействие вытянутых и гибких макромолекул, часто образующих структированные системы. Такие системы получили название ассоциаты.
Ассоциаты обладают свойством сильно увеличивать вязкость растворов.
ШТОРА ОТ ЗАПОРА. 780 Если для реакции и, то температура, при которой возможно ее протекание в прямом и обратном направлении, равна (зависимостью термодинамических функций от температуры пренебречь). 413
| Название | 780 Если для реакции и, то температура, при которой возможно ее протекание в прямом и обратном направлении, равна (зависимостью термодинамических функций от температуры пренебречь). 413 |
| Дата | 22.02.2019 |
| Размер | 261.7 Kb. |
| Формат файла |  |
| Имя файла | ШТОРА ОТ ЗАПОРА.docx |
| Тип | Документы #68555 |
| страница | 4 из 4 |
| Подборка по базе: Чек-лист_ Что делать , если дети дерутся.pdf, Практическая работа Равновесие и скорость химической реакции 2.d, пример решения задачи реакции опоры.docx, _Скорость химической реакции, равновесие.pptx, Серологические реакции.doc, Экстренная психологическая помощь при острой реакции на стресс.d, Как будет выглядеть планета, если повысится уровень мирового оке, Определение константы скорости химической реакции.doc, как запомнить процессуальные сроки, если вы не юрист.pdf, 25_П_В1_Химия_8_Экзотермические и эндотермические реакции. Лабор Атомно-абсорбционные методы анализа основаны на способности возбужденных атомов вещества ________ электромагнитное излучение определенной длины волны. Если температурный коэффициент скорости равен 3, то при увеличении температуры от 20С до 60С скорость химической реакции __________ раз.
Основными отличиями между физической и химической адсорбцией являются … В лабораторной практике электрофорез наиболее часто используют для определения __________ коллоидной частицы. Знака заряда Вант – Гоффа
В лабораторной практике электрофорез наиболее часто используют для определения __________ коллоидной частицы. Знака заряда Равновесными Хроматографическими Константой равновесия Ион избыточного реагента, адсорбирующийся на поверхности ядра и определяющий заряд коллоидной частицы (гранулы), называется … Заряд гранулы золя, образующегося при взаимодействии избытка сульфата меди с сероводородом, определяется зарядом Иона меди При разбавлении ацетатного буферного раствора в два раза значение величины Не изменится Равновесном Уменьшается Пептизационные Вторичная структура белковой макромолекулы обусловлена наличием в ней ______ связей. Водородных Отсутствие побочных низкомолекулярных продуктов Антиоксидантами Движется к аноду Дж/м 2 Оптической плотности На поверхности раздела фаз Пенопласт относится к дисперсным системам с _____ дисперсионной средой и ______ дисперсной фазой. Газообразной
Кондуктометрическими Коллоидные растворы относятся к высокодисперсным системам, которые состоят из дисперсионной _____ и дисперсной … Уравнение росм crt характеризующее зависимостьФенол в отличие от этанола реагирует с раствором … Для уменьшения в 32 раза скорости реакции, температурный коэффициент которой равен 2, необходимо понизить температуру на … Уравнения реакций, в результате которых происходит образование коллоидных растворов методом химической конденсации, имеют вид … Системами, для которых математическое выражение закона действующих масс имеет вид Уравнения реакций, в результате которых возможно образование коллоидных систем, имеют вид … При электролизе водного раствора, содержащего нитраты ртути (II), меди (II), никеля (II) и калия в стандартных условиях, последовательность выделения веществ на катоде имеет вид … Уравнения реакций, в результате которых возможно образование коллоидных растворов, имеют вид … Для физической адсорбции характерна(о) … Энтальпия образования Уравнение Pосм = CRT, характеризующее зависимость осмотического давления от концентрации раствора неэлектролита и температуры, называется законом … источники: http://topuch.ru/780-esli-dlya-reakcii-i-to-temperatura-pri-kotoroj-vozmojno-ee/index4.html http://iexam.ucoz.net/publ/khimija/72-5 |

 …
…

 , являются …
, являются …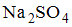 соответствует тепловому эффекту реакции …
соответствует тепловому эффекту реакции …