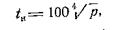Уравнение руша дает зависимость между
Как и для других газов, теплоемкость пара возрастает с повышением температуры. В небольшом диапазоне температур 100—150° С при постоянном давлении она может быть в среднем принята 2 кДж/(кг-К)[0,48 ккал/(кг-° С)]. Энтальпия сухого насыщенного пара при давлении 0,1 МПа и температуре 99,6° С составляет 2675 кДж/кг (639,0 ккал/кг) (см. 1).
Для перегретого пара, подчиняющегося уравнению (1), применительно к условиям сушки, в том числе для выявления гигроскопических характеристик материалов, высушиваемых в среде перегретого пара, желательно ввести параметр — степень насыщенности пара или, более кратко, насыщенность пара Ф, получаемую из соотношения
Для перегретого пара барометрического давления, при />99,6° С, применяемого в сушильных камерах, когда рп= 1 бар, формула (3) примет вид: ф=1/рн (здесь рн т.акже в барах).
§ 1. Физические свойства водяного пара. Сушильным агентом называются нагретые водяной пар атмосферного давления, воздух и продукты сгорания (топочные газы).
Эта среда называется агентом сушки или сушильным агентом.
Агентами сушки могут быть атмосферный воздух, топочные газы, водяной пар и их смеси, а в некоторых случаях
С изменением влажности древесины связаны такие ее свойства, как усушка и разбухание.
Рассмотрим наиболее важные свойства водяного пара, имеющие значение при сушке древесины.
В качестве сушильного агента используют перегретый пар, температура которого должна быть выше 100° С.
Свойства пара: высокая подвижность, малая плотность
Подытожим сравнительные достоинства и недостатки теплоносителей — воды, водяного пара и атмосферного воздуха.
В качестве теплоносителя или сушильного агента чаще всего используются топочные газы с.
§ 1. Физические свойства водяного пара. § 2. Параметры воздуха как сушильного агента.
Эффективность использования тепловой энергии топлива. § 20. Классификация и особенности лесосушильных установок.
§ 2. Параметры воздуха как сушильного агента.
Влагоемкость пространства (масса пара в 1 м3) — очень важное свойство пара — увеличивать плотность в результате подогрева; оно положено в основу процесса сушки.
ПРИЛОЖЕНИЕ 3
ВОДЯНОЙ ПАР
Основные понятия и определения.
Водяной пар применяется в качестве рабочего тела в паровых турбинах, которые являются в настоящее время основными тепловыми двигателями на тепловых электрических станциях.
Как теплоноситель водяной пар широко используется в технологических процессах многих отраслей народного хозяйства: энергетики, химической технологии, машиностроении и т. д.
Водяной пар применяется в различных состояниях в весьма широком диапазоне давлений и температур и часто переходит в жидкое состояние — конденсируется. В этих условиях нельзя пренебрегать силами взаимодействия между молекулами и объемом самих молекул и, следовательно, к водяному пару нельзя применять законы идеальных газов и уравнение Менделеева — Клапейрона.
При различных расчетах и изучении процессов, протекающих в водяном паре, используются таблицы водяного пара, которые составлены на основании большого экспериментального материала и теоретических исследований. Табличный метод расчетов тепловых процессов достаточно сложен, поэтому на практике широко применяется графический метод с использованием i- s-диаграммы. В нашей стране наиболее широкое практическое применение имеют таблицы, составленные под руководством М. П. Вукаловича.
Разделение вещества на газ и пар условно, так как между ними не существует какой-либо границы. Паром называется всякий реальный газ, который в условиях его применения способен переходить в жидкость. Такие газообразные вещества имеют относительно высокие критические температуры. Всякий реальный газ, который в обычных условиях его применения не переходит в жидкое состояние, сохраняет название газа; такие газообразные вещества имеют низкие критические температуры.
Процесс перехода жидкости в пар называется парообразованием, этот процесс может происходить путем испарения и кипения. При испарении образование пара происходит только со свободной поверхности жидкости; этот процесс протекает при любых температурах жидкости и может сопровождаться понижением ее температуры. Интенсивность испарения зависит от физических свойств жидкости и возрастает с повышением ее температуры. Бурный процесс парообразования, сопровождающийся возникновением пузырьков пара по всему объему жидкости, называется кипением. Кипение жидкости происходит при постоянном давлении и при соответствующей ему постоянной температуре, которая называется температурой кипения или насыщения и обозначается ts. Для всех жидкостей температура кипения повышается с увеличением давления, зависимость между ними находится из опыта и в общем случае выражается уравнением ts=f(p). Для различных жидкостей и воды имеется большое количество эмпирических уравнений, позволяющих приближенно установить зависимость ts=f(p). В качестве примера для воды можно привести уравнение Руша:
где: Р- абсолютное давление, кгс/см 2 .
Для давлений ниже 50 кгс/см 2 значение tн, найденное по формуле Руша, отличается от действительных значений не более чем на 1%, с повышением давлений расхождение увеличивается. При точном определении температуры кипения необходимо пользоваться таблицами. Все параметры кипящей жидкости принято обозначать соответствующей буквой со штрихом, например: удельный объем v’, энтальпия i’, энтропия s’ и т. д.
Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью. Это значит, что в закрытом сосуде число молекул пара, поступающих в пространство над кипящей жидкостью, равно числу молекул, возвращающихся обратно в жидкость. Такое подвижное равновесие обусловливается хаотичностью движения молекул и силами взаимодействия между молекулами пара и жидкостью вблизи ее поверхности.
Если при постоянном давлении к кипящей жидкости подвести необходимое количество теплоты для испарения всей жидкости, то в момент исчезновения последних капель жидкости (воды) получим сухой насыщенный пар при температуре кипения tн— Сухой насыщенный пар является неустойчивым состоянием и получается в парогенераторах как мгновенное состояние при переходе в перегретый пар. Состояние сухого насыщенного пара определяется одним параметром: давлением или температурой насыщения ts. Все параметры сухого насыщенного пара обозначаются соответствующими буквами с двумя штрихами, например: удельный объем v», энтальпия i», энтропия s» и т. д.
При кипении жидкости вместе с пузырьками пара выносятся мельчайшие частицы влаги. Получающаяся смесь пара и жидкости называется влажным насыщенным паром, причем частицы жидкости равномерно распределены по всему объему пара.
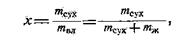
Состояние влажного насыщенного пара определяется давлением р и степенью сухости х или температурой кипения tK и степенью сухости х. Степенью сухости х называется массовая доля сухого пара, содержащегося во влажном паре:
где: mcyx и тж — соответственно масса сухого пара и жидкости, находящихся в 1 кг смеси; твл — масса 1 кг влажного пара.
Для сухого пара х=1, для кипящей жидкости х=0. Массовая доля жидкости, содержащейся во влажном паре, называется степенью влажности и обозначается y=1—х. Все параметры влажного пара (кроме давления и температуры) обозначаются с индексом х, например: удельный объем vx, энтальпия ix, энтропия sx и т. д.
Перегретым паром называется пар, который при одинаковом давлении с насыщенным, имеет более высокую температуру, чем температура кипения in. Состояние перегретого пара определяется любыми двумя параметрами, наиболее часто — давлением и температурой. Процесс перехода насыщенного пара в жидкость называется конденсацией. Этот процесс является обратным процессу парообразования и также происходит при постоянном давлении и соответствующей ему постоянной температуре, равной температуре кипения tn при том же давлении.
Основные процессы водяного пара
Основными процессами являются: изобарный, изохорный, изотермический и адиабатный. Каждый из этих процессов может протекать целиком в области влажного или перегретого пара, т. е. без изменения агрегатного состояния. Но процесс может протекать и таким образом, что, например, в начальном состоянии пар будет влажный, а в конечном состоянии — перегретый (или наоборот). Этот, более общий случай и будет рассматриваться ниже.
Так как водяной пар не подчиняется законам идеальных газов, полученные соотношения между параметрами и уравнения для подсчета теплоты, изменения внутренней энергии и работы применительно к идеальным газам, для пара неприменимы.
При решении задач с использованием таблиц необходимо сначала установить состояния рабочего тела в начале и в конце процесса. Для определения состояния рабочего тела при заданном давлении сравнивают любой известный параметр (р, i, s, t) с соответствующим параметром сухого насыщенного пара.
Термодинамические свойства и процессы реальных газов. Водяной пар 1. Использование водяного пара. 2. Пограничные кривые водяного пара. 3. Критическая температура. — презентация
Презентация была опубликована 8 лет назад пользователемStGAU.ru
Похожие презентации
Презентация на тему: » Термодинамические свойства и процессы реальных газов. Водяной пар 1. Использование водяного пара. 2. Пограничные кривые водяного пара. 3. Критическая температура.» — Транскрипт:
1 Термодинамические свойства и процессы реальных газов. Водяной пар 1. Использование водяного пара. 2. Пограничные кривые водяного пара. 3. Критическая температура. 4. Термодинамические параметры воды и водяного пара и их определение. 5. T – s диаграмма водяного пара. 6. h – s диаграмма водяного пара. 7. Термодинамические процессы на диаграмме h – s. 8. Определение параметров воды и водяного пара в термодинамических процессах.
2 Уравнение Руша где р – атмосферное или абсолютное давление, выраженное в атмосферах
3 Рассмотрим процесс получения пара кипением на диаграмме p – v при постоянном давлении.
4 Рассмотрим процесс получения жидкости из перегретого пара при постоянной температуре t пе.
5 Термодинамические параметры воды и воды и водяного пара. Холодная вода — p 0, V 0, t 0, h o, S 0, u; Начало кипения — p, V, t, h, S, u, r, x = 0; Влажный насыщенный пар – p x, V x, t к, h x, S x, u x, r, 0
6 Теплота, затраченная на нагрев воды до кипения: При
7 Теплота, затраченная на парообразование при р = const:
8 Теплота, затраченная на перегрев пара:
9 p, t к, v, v, h, h, r, S, S.
10 К Между параметрами существуют расчетные зависимости: энтальпия, или, внутренняя энергия В критической точке К h = h; r = 0. Если парообразование кипением осуществляется при p = const, то вся подведенная теплота от до будет равна:
11 Удельный объем влажного насыщенного пара равен: Энтальпия влажного насыщенного пара равна: Энтропия влажного насыщенного пара равна: Внутренняя энергия влажного насыщенного пара равна:
12 T – s диаграмма водяного пара T, К
14 h – s диаграмма водяного пара
15 Термодинамические процессы в диаграмме h – s
16 Название процесса Определение изменения внутренней энергии Определение подведённой или отведённой теплоты q Определе ние работы Изохорный процесс v = const Изобарный процесс p = const Изотермическ ий процесс T = const Адиабатный процесс q = 0
http://mydocx.ru/1-25953.html
http://www.myshared.ru/slide/324079/