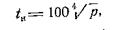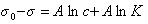Уравнение руша показывает зависимость между чем
Как и для других газов, теплоемкость пара возрастает с повышением температуры. В небольшом диапазоне температур 100—150° С при постоянном давлении она может быть в среднем принята 2 кДж/(кг-К)[0,48 ккал/(кг-° С)]. Энтальпия сухого насыщенного пара при давлении 0,1 МПа и температуре 99,6° С составляет 2675 кДж/кг (639,0 ккал/кг) (см. 1).
Для перегретого пара, подчиняющегося уравнению (1), применительно к условиям сушки, в том числе для выявления гигроскопических характеристик материалов, высушиваемых в среде перегретого пара, желательно ввести параметр — степень насыщенности пара или, более кратко, насыщенность пара Ф, получаемую из соотношения
Для перегретого пара барометрического давления, при />99,6° С, применяемого в сушильных камерах, когда рп= 1 бар, формула (3) примет вид: ф=1/рн (здесь рн т.акже в барах).
§ 1. Физические свойства водяного пара. Сушильным агентом называются нагретые водяной пар атмосферного давления, воздух и продукты сгорания (топочные газы).
Эта среда называется агентом сушки или сушильным агентом.
Агентами сушки могут быть атмосферный воздух, топочные газы, водяной пар и их смеси, а в некоторых случаях
С изменением влажности древесины связаны такие ее свойства, как усушка и разбухание.
Рассмотрим наиболее важные свойства водяного пара, имеющие значение при сушке древесины.
В качестве сушильного агента используют перегретый пар, температура которого должна быть выше 100° С.
Свойства пара: высокая подвижность, малая плотность
Подытожим сравнительные достоинства и недостатки теплоносителей — воды, водяного пара и атмосферного воздуха.
В качестве теплоносителя или сушильного агента чаще всего используются топочные газы с.
§ 1. Физические свойства водяного пара. § 2. Параметры воздуха как сушильного агента.
Эффективность использования тепловой энергии топлива. § 20. Классификация и особенности лесосушильных установок.
§ 2. Параметры воздуха как сушильного агента.
Влагоемкость пространства (масса пара в 1 м3) — очень важное свойство пара — увеличивать плотность в результате подогрева; оно положено в основу процесса сушки.
ПРИЛОЖЕНИЕ 3
ВОДЯНОЙ ПАР
Основные понятия и определения.
Водяной пар применяется в качестве рабочего тела в паровых турбинах, которые являются в настоящее время основными тепловыми двигателями на тепловых электрических станциях.
Как теплоноситель водяной пар широко используется в технологических процессах многих отраслей народного хозяйства: энергетики, химической технологии, машиностроении и т. д.
Водяной пар применяется в различных состояниях в весьма широком диапазоне давлений и температур и часто переходит в жидкое состояние — конденсируется. В этих условиях нельзя пренебрегать силами взаимодействия между молекулами и объемом самих молекул и, следовательно, к водяному пару нельзя применять законы идеальных газов и уравнение Менделеева — Клапейрона.
При различных расчетах и изучении процессов, протекающих в водяном паре, используются таблицы водяного пара, которые составлены на основании большого экспериментального материала и теоретических исследований. Табличный метод расчетов тепловых процессов достаточно сложен, поэтому на практике широко применяется графический метод с использованием i- s-диаграммы. В нашей стране наиболее широкое практическое применение имеют таблицы, составленные под руководством М. П. Вукаловича.
Разделение вещества на газ и пар условно, так как между ними не существует какой-либо границы. Паром называется всякий реальный газ, который в условиях его применения способен переходить в жидкость. Такие газообразные вещества имеют относительно высокие критические температуры. Всякий реальный газ, который в обычных условиях его применения не переходит в жидкое состояние, сохраняет название газа; такие газообразные вещества имеют низкие критические температуры.
Процесс перехода жидкости в пар называется парообразованием, этот процесс может происходить путем испарения и кипения. При испарении образование пара происходит только со свободной поверхности жидкости; этот процесс протекает при любых температурах жидкости и может сопровождаться понижением ее температуры. Интенсивность испарения зависит от физических свойств жидкости и возрастает с повышением ее температуры. Бурный процесс парообразования, сопровождающийся возникновением пузырьков пара по всему объему жидкости, называется кипением. Кипение жидкости происходит при постоянном давлении и при соответствующей ему постоянной температуре, которая называется температурой кипения или насыщения и обозначается ts. Для всех жидкостей температура кипения повышается с увеличением давления, зависимость между ними находится из опыта и в общем случае выражается уравнением ts=f(p). Для различных жидкостей и воды имеется большое количество эмпирических уравнений, позволяющих приближенно установить зависимость ts=f(p). В качестве примера для воды можно привести уравнение Руша:
где: Р- абсолютное давление, кгс/см 2 .
Для давлений ниже 50 кгс/см 2 значение tн, найденное по формуле Руша, отличается от действительных значений не более чем на 1%, с повышением давлений расхождение увеличивается. При точном определении температуры кипения необходимо пользоваться таблицами. Все параметры кипящей жидкости принято обозначать соответствующей буквой со штрихом, например: удельный объем v’, энтальпия i’, энтропия s’ и т. д.
Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью. Это значит, что в закрытом сосуде число молекул пара, поступающих в пространство над кипящей жидкостью, равно числу молекул, возвращающихся обратно в жидкость. Такое подвижное равновесие обусловливается хаотичностью движения молекул и силами взаимодействия между молекулами пара и жидкостью вблизи ее поверхности.
Если при постоянном давлении к кипящей жидкости подвести необходимое количество теплоты для испарения всей жидкости, то в момент исчезновения последних капель жидкости (воды) получим сухой насыщенный пар при температуре кипения tн— Сухой насыщенный пар является неустойчивым состоянием и получается в парогенераторах как мгновенное состояние при переходе в перегретый пар. Состояние сухого насыщенного пара определяется одним параметром: давлением или температурой насыщения ts. Все параметры сухого насыщенного пара обозначаются соответствующими буквами с двумя штрихами, например: удельный объем v», энтальпия i», энтропия s» и т. д.
При кипении жидкости вместе с пузырьками пара выносятся мельчайшие частицы влаги. Получающаяся смесь пара и жидкости называется влажным насыщенным паром, причем частицы жидкости равномерно распределены по всему объему пара.
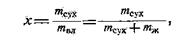
Состояние влажного насыщенного пара определяется давлением р и степенью сухости х или температурой кипения tK и степенью сухости х. Степенью сухости х называется массовая доля сухого пара, содержащегося во влажном паре:
где: mcyx и тж — соответственно масса сухого пара и жидкости, находящихся в 1 кг смеси; твл — масса 1 кг влажного пара.
Для сухого пара х=1, для кипящей жидкости х=0. Массовая доля жидкости, содержащейся во влажном паре, называется степенью влажности и обозначается y=1—х. Все параметры влажного пара (кроме давления и температуры) обозначаются с индексом х, например: удельный объем vx, энтальпия ix, энтропия sx и т. д.
Перегретым паром называется пар, который при одинаковом давлении с насыщенным, имеет более высокую температуру, чем температура кипения in. Состояние перегретого пара определяется любыми двумя параметрами, наиболее часто — давлением и температурой. Процесс перехода насыщенного пара в жидкость называется конденсацией. Этот процесс является обратным процессу парообразования и также происходит при постоянном давлении и соответствующей ему постоянной температуре, равной температуре кипения tn при том же давлении.
Основные процессы водяного пара
Основными процессами являются: изобарный, изохорный, изотермический и адиабатный. Каждый из этих процессов может протекать целиком в области влажного или перегретого пара, т. е. без изменения агрегатного состояния. Но процесс может протекать и таким образом, что, например, в начальном состоянии пар будет влажный, а в конечном состоянии — перегретый (или наоборот). Этот, более общий случай и будет рассматриваться ниже.
Так как водяной пар не подчиняется законам идеальных газов, полученные соотношения между параметрами и уравнения для подсчета теплоты, изменения внутренней энергии и работы применительно к идеальным газам, для пара неприменимы.
При решении задач с использованием таблиц необходимо сначала установить состояния рабочего тела в начале и в конце процесса. Для определения состояния рабочего тела при заданном давлении сравнивают любой известный параметр (р, i, s, t) с соответствующим параметром сухого насыщенного пара.
1.5. Поверхностное натяжение растворов и адсорбция
Свободная поверхностная энергия самопроизвольно может только уменьшаться, что проявляется в уменьшении либо поверхности раздела фаз, либо межфазного (поверхностного) натяжения. Поверхностное натяжение может уменьшаться в результате самопроизвольного перераспределения компонентов системы между объемами фаз a и b и поверхностью их раздела. В поверхности раздела фаз будут преимущественно концентрироваться те компоненты, которые способны уменьшать избыточную свободную поверхностную энергию. Это явление получило название «адсорбция». Количественно мерой адсорбции служит избыток вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же слое в объеме фазы. Этот избыток обычно относят к единице площади поверхности (или к единице массы адсорбента). Такая адсорбция называется гиббсовской и обозначается буквой Гi. Поверхностный избыток является алгебраической величиной. Если он положителен, то вблизи поверхности данный компонент присутствует в избытке, если отрицателен, то концентрация компонента на поверхности фазы ниже, чем в ее объеме .
Рассмотрим распределение в системе i -го компонента, предполагая, что это вещество способно понижать поверхностное натяжение. В соответствии с уравнением (1.1.6) число молей n вещества i-го компонента в системе определяется как 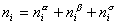
Количество вещества в обеих фазах составляет
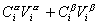
где С a , С b — концентрация вещества в фазах a, b.
Количество вещества на поверхности раздела фаз 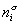
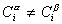
Учитывая уравнение (1.1.81) ,
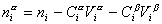
Разделив выражение (1.1.82) на площадь поверхности раздела фаз А, можем определить гиббсовскую адсорбцию:
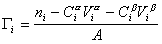
Фундаментальным уравнением физической химии поверхностей является взаимосвязь между адсорбцией и межфазным натяжением, которую можно определить экспериментально при одновременном изменении многих факторов. Остановимся на системах, в которых адсорбция протекает при постоянной температуре. Связь между адсорбцией и межфазным натяжением при постоянной температуре T называется изотермой адсорбции, фундаментальное уравнение которой известно как уравнение Гиббса. Рассмотрим его вывод.
При небольшом обратимом изменении энергии системы dU с учетом формулы (1.1.4) можем написать
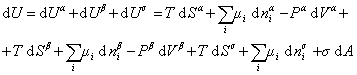
где U – полная внутренняя энергия системы; U a , U b , U s – внутренняя энергия фаз aиb и поверхности их раздела; P a , P b — давление в фазах aиb; m — химический потенциалi-того компонента; S a , S b , S s – энтропия фаз a иb и их поверхности раздела; s — поверхностное натяжение.
Поскольку из курса химической термодинамики известно, что
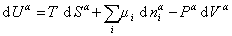
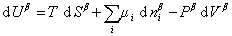
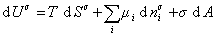
Если энергию, энтропию и количество компонентов увеличивать от нуля до некоторого определенного значения при постоянстве температуры T, площади поверхности раздела фаз A и количестве вещества на этой поверхности 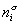
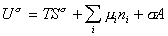
дифференцирование которого приводит к выражению
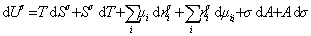
Сравнивая его с уравнением (1.1.88), получаем
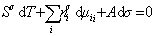
В расчете на единицу поверхности
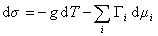
где 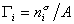
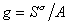
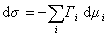
Для двухкомпонентной системы
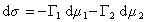
где индекс 1 относится к растворителю, а индекс 2 – к растворенному веществу.
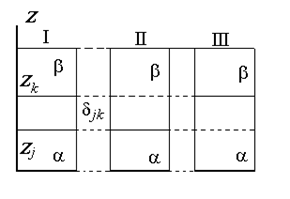
Разделяющая поверхность Гиббса может быть проведена так, чтобы обратилась в нуль адсорбция любого наперед заданного компонента, но только одного, как это показано на рис. 1.15.
Расстояние между двумя плоскостями (разделяющими поверхностями), одна из которых соответствует условию Гj = 0, а другая — Гk = 0, обозначим dkj:
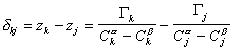
где Гk, Гj– избытки 
Поскольку значения Г1 в уравнении (1.1.93) определены относительно произвольно выбранного положения разделяющей плоскости, то ее можно расположить так, чтобы избыток растворителя в поверхностном слое был равен нулю ( Г1 = 0).
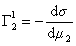
где верхний индекс 1 означает, что для выбранной поверхности раздела Г1=0.
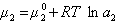
получаем после дифференцирования уравнения (1.1.96)
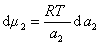
где 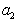
Поэтому, подставляя уравнение (1.1.97) в уравнение (1.1.95), получаем
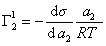
Из уравнения (1.1.98) следует, что если 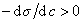
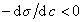
Поскольку 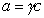
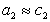
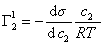
Уравнение (1.1.99) представляет собой наиболее употребляемую форму изотермы адсорбции Гиббса, причем так как рассматривается адсорбция именно растворенного вещества, индексы при адсорбции и концентрации опускают, т.е.
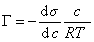
Исследования показывают, что существуют такие вещества, растворение которых приводит к резкому снижению поверхностного натяжения раствора. Эти вещества называют поверхностно-активными. В соответствии с уравнением Гиббса адсорбция их всегда положительна, т.е. концентрация в поверхностном слое выше объемной концентрации. По предложению Ребиндера мера поверхностной активности обозначается первой буквой фамилии Гиббса. Обычно используют значения поверхностной активности в бесконечно разбавленных растворах
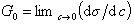
К классу поверхностно-активных веществ (ПАВ) относятся жирные кислоты и их соли (мыла), сульфокислоты, их соли, спирты, алкилсульфоэфиры и др. Если 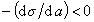
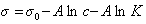
Обозначим постоянной В постоянные при изотермических условиях величины 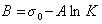
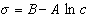
Следовательно, при относительно высокой концентрации растворов ПАВ их поверхностное натяжение должно уменьшаться экспоненциально с увеличением концентрации.
Уравнение (1.1.107) может быть получено непосредственно из уравнения изотермы адсорбции Гиббса:
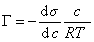
При достаточно высокой концентрации растворенного вещества адсорбция достигает предела , т.е. Г = Гmax , поэтому
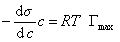
где при постоянной температуре правая часть представляет собой постоянную величину и может быть обозначена RT Гmax = A. Следовательно,
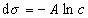
откуда после интегрирования получаем
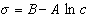
Таким образом, уравнение Шишковского может быть выведено из уравнения Гиббса, так как уравнения (1.1.107) и (1.1.109) идентичны. Точность уравнения Шишковского связана с тем, что в нем уже заложено условие насыщения адсорбционного слоя.
Если уравнение Шишковского в форме
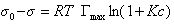
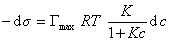
и подставить в уравнение Гиббса величину
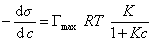
то уравнение изотермы адсорбции примет вид
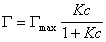
В такой форме уравнение изотермы адсорбции носит название изотермы Ленгмюра. Американский ученый И. Ленгмюр в 1917 г. развил представление о мономолекулярной адсорбции и на основании молекулярно- кинетической теории получил уравнение (1.1.113) .
Уравнение Шишковского позволяет определить предел адсорбции (при Kc>>1), так как в таком случае это уравнение принимает вид
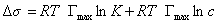
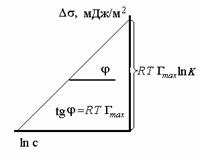
Построив график 
Понимание адсорбционных процессов имеет чрезвычайно важное значение, так как они лежат в основе многих процессов, протекающих на границе раздела фаз, например крашения, отмывания загрязнений, отделки текстильных материалов и т.д., т.е. в основе всех коллоидно -химических процессов на границе жидкость–газ.
http://mydocx.ru/1-25953.html
http://xumuk.ru/colloidchem/27.html