Реакции ионного обмена — это один из видов химических реакций. Правила, условия протекания и примеры
Реакции ионного обмена — это процессы, которые протекают между сложными веществами. Они должны сопровождаться появлением определенного результата: выпадением осадка, выделением газообразного соединения, образованием мало диссоциируемого вещества (например, воды).
Понятие о реакции
Курс органической химии рассматривает взаимодействия между соединениями, которые необходимы для жизнедеятельности человека и животных: белками, жирами, углеводами. Химическими принято называть такие процессы, которые протекают между веществами с получением иных соединений, отличающихся от исходных по свойствам и составу.

Реакции ионного обмена — это типичный пример химических процессов, так как они сопровождаются изменением окраски, появлением газа, выпадением осадка.
Реагентами именуют исходные соединения, а продуктами – конечные соединения.
Движущей силой процесса является природа реагентов, особенности продуктов, концентрация реагирующих компонентов, температура, давление.

Особенности взаимодействий
Реакции ионного обмена — это взаимодействие между веществами, взятыми в растворах. Как любые иные процессы химической природы, они протекают с выделением либо поглощением тепла, изменением окраски, агрегатного состояния.
В переводе с латинского языка «реакция» означает «ответное действие, отпор».
Именно поэтому реакции ионного обмена — это ответ одних веществ на атаку других.
Условия протекания
Среди тех факторов, которые необходимы для химического взаимодействия, выделяют:
- реагирующие соединения должны соприкасаться в максимальной степени;
- в некоторых случаях требуется повышение температуры;
- часть взаимодействий возможна только при воздействии электричества либо ультрафиолетового излучения.
Варианты классификации реакций
Сложно все процессы, сопровождающиеся изменением состава и свойств соединений, объединить в одну классификацию.
По возможности протекания процессов в прямом и обратном направлении неорганические и органические процессы делят на две группы.
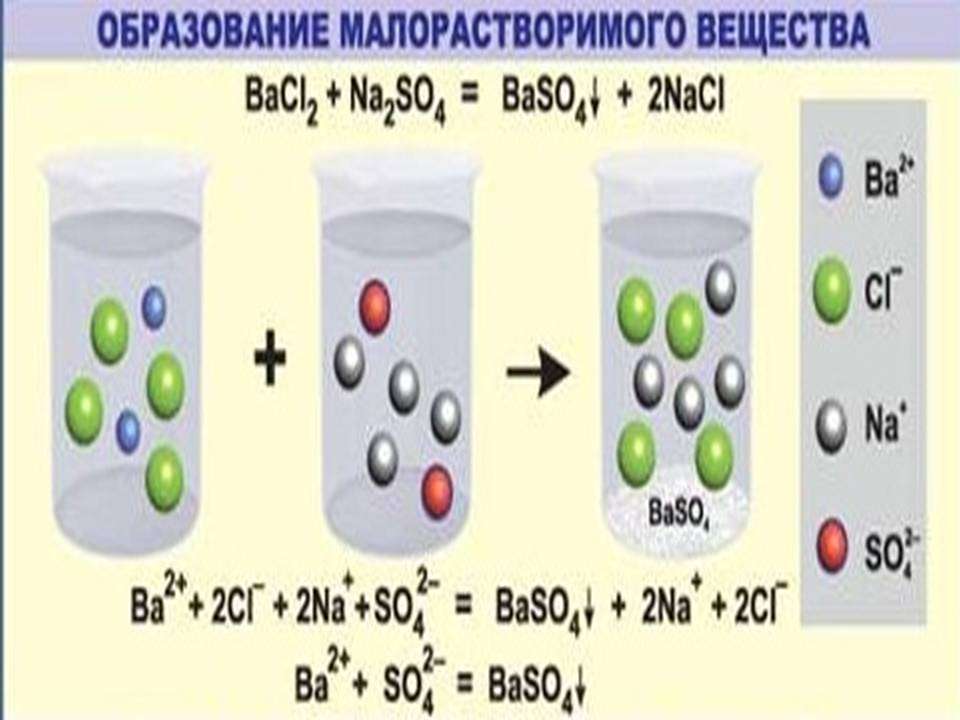
Необратимо протекает реакция ионного обмена между растворами растворимых соединений в том случае, когда между ними образуется нерастворимый продукт. Это применяется в аналитической химии для качественного определения катионов (анионов) в смеси растворов.
К примеру, для обнаружения катионов бария (Ba2+) используют раствор, содержащий сульфат анион (SO4 2-).
Пример ионных уравнений, сопровождающихся выпадением осадка
Как правильно составить уравнение процессов, характерных для этого случая? Рассмотрим на примере этой реакции ионного обмена сокращенные ионные уравнения. Данный вопрос входит в курс школьной программы, поэтому заслуживает пристального рассмотрения.
Первым этапом является написание процесса в молекулярном виде.
Чтобы понять, действительно ли необратимо протекает реакция ионного обмена между растворами этих веществ, потребуется таблица растворимости кислот, солей, оснований. Одним из продуктов является сульфат бария (средняя соль), которая является нерастворимым соединением. Следовательно, процесс действительно необратим, сопровождается выпадением осадка.
Вторым этапом является запись полного ионного уравнения. Каждое из исходных соединений, продуктов взаимодействия записывается в виде катионов и анионов.
Ba2++ 2Cl-+2Na+ +SO42-=BaSO4+2Na+ + 2Cl-
В левой и правой частях данного уравнения положительные и отрицательные ионы, которые не связаны в осадок, малодиссоциируемое или газообразное соединение. После их сокращения получаем вариант краткого ионного уравнения.
Пример процесса с образованием газа
Когда еще могут протекать реакции ионного обмена? Примеры с решением, предполагающим образование газообразного вещества, приведем для карбоната. Качественным реактивом на анион CO32- является взаимодействие с катионов водорода. Итогом процесса является образование углекислого газа.
Представим взаимодействие в молекулярном и ионном виде.
Продуктами реакции является углекислый газ и вода, которые не распадаются на ионы. Представим взаимодействие в полном ионном виде.
После сокращения ионов, повторяющихся в левой и правой частях, получаем следующий вид данного процесса:
Получение малодиссоциируемого соединения
Какими еще признаками могут сопровождаться реакции ионного обмена? Примеры с решением приведем для классического процесса нейтрализации между раствором щелочи и кислоты.
Взаимодействие раствора соляной кислоты с гидроксидом натрия сопровождается образованием воды (малодиссоциируемого соединения). Проверить полноту протекания процесса можно с помощью индикатора. Если первоначально к щелочи добавить спиртовой раствор фенолфталеина, по мере добавления к нему соляной кислоты окраска будет исчезать (идет нейтрализация).
В молекулярном виде процесс выглядит следующим образом:
Краткое ионное уравнение отражает процесс нейтрализации:
Заключение
В отличие от других разновидностей химических процессов, ионный обмен происходит только между растворами сложных соединений. Также среди обязательных условий, которые связаны с подобными процессами, отметим их необратимость. В тех случаях, когда среди продуктов есть малодиссоциируемое соединение, газообразное вещество, осадок, то можно говорить о полноте протекания процесса.
Если в случае замещения у соединений меняются степени окисления, то в случае ионного обмена валентное состояние атомов не меняется. Такие процессы протекают между сложными веществами: солями, кислотами, основаниями, оксидами.
Частным случаем таких взаимодействий является нейтрализация между щелочью и кислотой. Они подчиняются законам химического равновесия, идут в том направлении, где одно из соединений удаляют из реакционной сферы в летучем, газообразном виде, или как малодиссоциируемое вещество.
Химическая реакция является сложным процессом, который предполагает превращение одних веществ в другие, которые отличаются от исходных по строению, составу. Только при наличии одного из трех признаков, перечисленных выше, можно вести речь о полноте протекания взаимодействия.
Уравнение с образованием воды и осадка
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Условия протекания реакций ионного обмена до конца
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На уроке будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
http://kardaeva.ru/89-dlya-uchenika/9-klass/140-reaktsii-ionnogo-obmena-i-usloviya-ikh-protekaniya
http://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/usloviya-protekaniya-reaktsiy-ionnogo-obmena-do-kontsa