Советы тут
Много полезных советов
Фенолы. Получение и свойства
от Ауес Беев

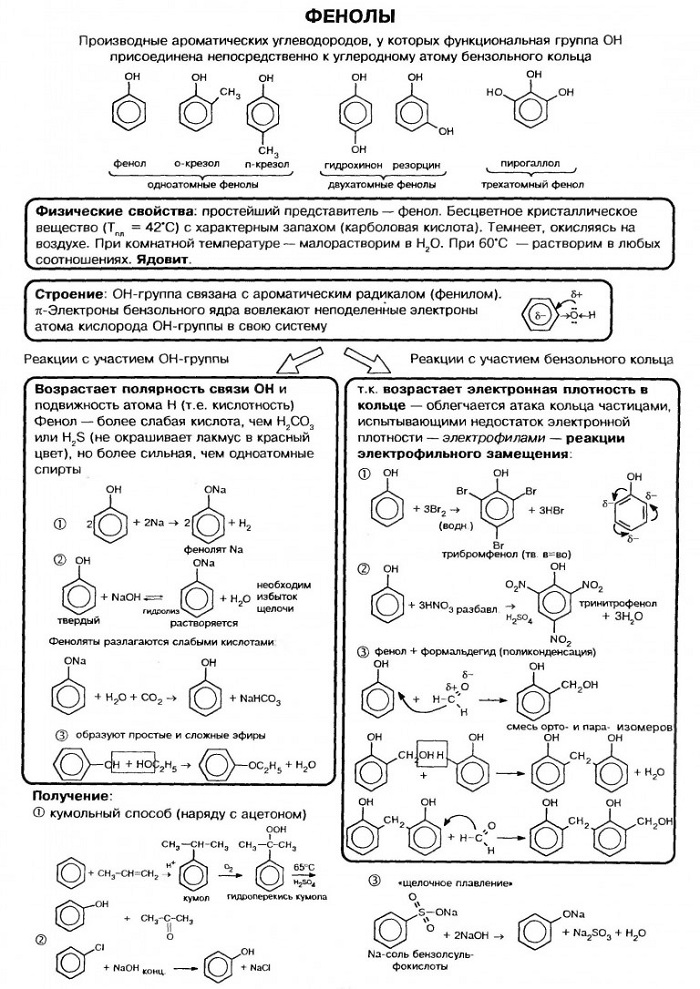
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, соединенных с бензольным кольцом. По числу гидроксильных групп фенолы делятся на одно-, двух-, трехатомные.
Гидроксогруппа и бензольное ядро оказывают большое влияние друг на друга: неподеленная пара кислорода вступает в сопряжение с π—электронами ядра. В результате электронная плотность переходит частично на связь С–О, увеличивая при этом электронную плотность в о— и п-положениях в ядре. Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию положительного заряда на атоме Н гидроксогруппы и отщеплению его в виде протона. В результате этого фенолы проявляет более сильный кислотный характер по сравнению со спиртами:
Фенолы – высококипящие жидкости или кристаллические вещества, обладающие сильным характерным запахом. Плотность около 1 г/см 3 .
Способы получения фенолов.
1. Из каменноугольной смолы.
2. Сплавлением солей сульфокислот с щелочами.
3. Реакцией галогенпроизводных аренов с щелочами
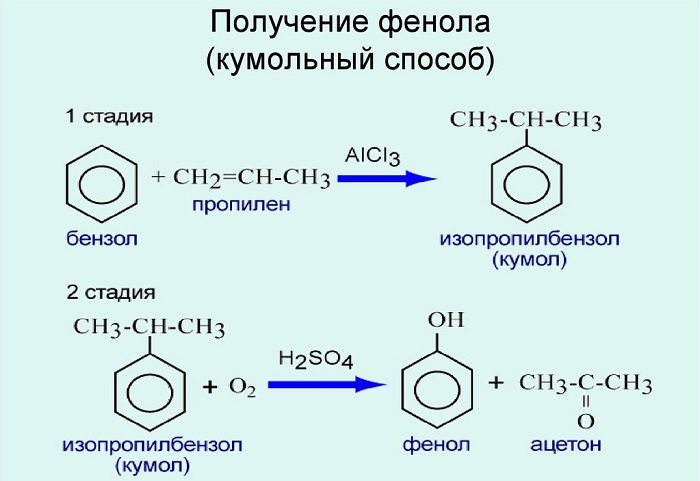
4. Из бензола и пропилена (кумольный способ)
5. Из солей диазония.
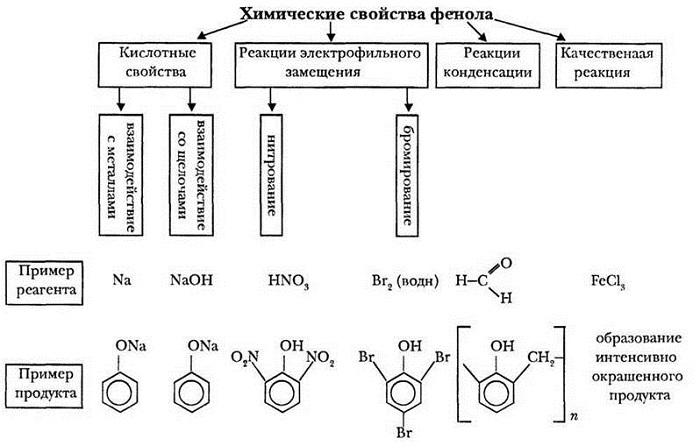
Химические свойства фенолов.
1. Фенолы проявляют слабокислые свойства.
2. Образование простых эфиров.
3. Образование сложных эфиров.
4. Замещение атомов водорода в ядре на галогены (в положения 2,4,6)
5. Нитрование (в положения 2,4,6)
6. Сульфирование фенола дает смесь изомерных о- и п-фенолсульфокислот:
7. При полном гидрировании фенола получается циклогексанол.
8. Двухатомные фенолы легко окисляются в хиноны:
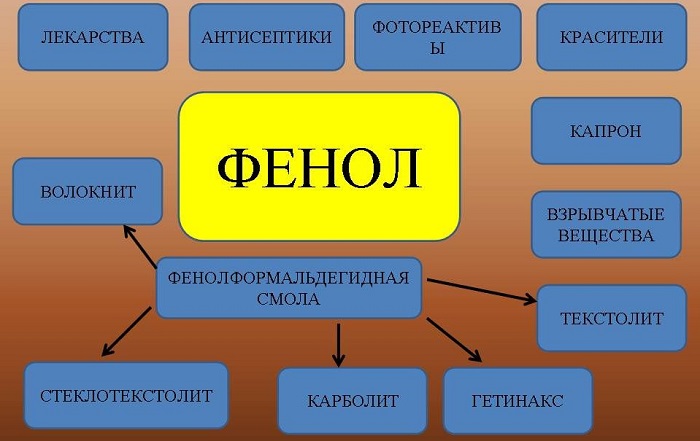
Фенол применяется для производства красителей пикриновой кислоты, лекарственных препаратов и особенно, для получения пластмасс – фенолоформальдегидных смол. Растворы фенола используются для дезинфекции.
Это был урок по химии 38 – Фенолы. Получение и свойства
1. Многоатомным спиртом является:
А. Бутанол-2. В. Фенол.
Б. Глицерин. Г. Этанол.
2.Название вещества, формула которого СН3—СН—СН—СН3:
А. 2 — Метилбутанол-З. В. З — Метилбутанол -2.
Б. Пентанол -2. Г. Метилбутанол.
3. Вид изомерии, характерный для фенолов:
A. Положения функциональной группы.
Г. Положения кратной связи.
4. Продуктом реакции гидратации углеводорода, формула которого
СН2=СН—СН2—СН2—СН3, является вещество:
A. пентанол-1. B. пентанол-3.
Б. пентанол-2. Г. пентандиол-1,2.
5.В цепочке превращений С2Н6 ——Х ——С2Н5ОН веществом X является:
А. Хлорэтан. В. 2,2-Дихлорэтан.
Б. 1,1-Дихлорэтан. Г. Этаналь.
6.Вещество с наиболее ярко выраженными кислотными свойствами:
А. Метанол. В. Фенол.
Б. Пентанол — 2. Г. Этанол.
7 . Метанол взаимодействует с веществом, формула которого:
A. Zn. Б. НВг. В. КОН. Г. Вг2(водн).
8 . Реактивом для распознавания фенолов является:
A. Перманганат калия (р-р). B. Гидроксид меди (II).
Б. Хлорид железа (III). Г. Оксид меди (II).
9 . Вещество, применяемое для производства антифризов:
А. Глицерин. В. Этанол.
Б. Метанол. Г. Этиленгликоль.
10. Пикриновую кислоту (тринитрофенол) можно получить путем взаимодействия фенола с веществом, формула которого:
А. Вг2(водн). Б. HNO3. В. КМnО4(р.р). Г. NaOH
Фенолы — строение, общая характеристика и основные свойства
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
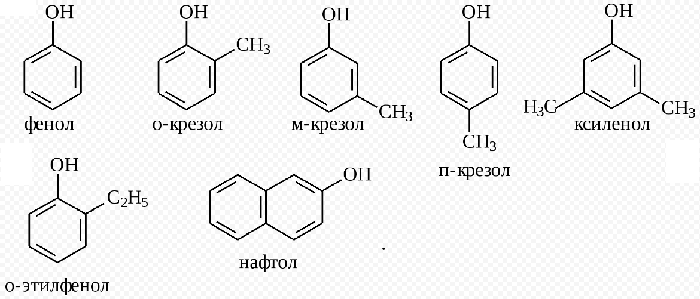
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
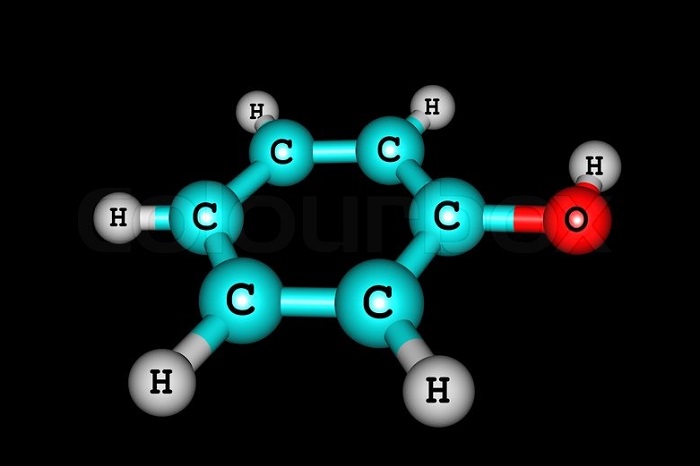
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,9 0 С. Молярная масса 94 г/моль.
В холодной воде фенол является малорастворимым веществом. При температуре выше +70 0 С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
По схеме С6Н6 —— С6Н5Cl —— С6Н5ОН. Минусом метода являются жёсткие условия замещения хлора на гидроксогруппу. Реакции приходится проводить при высокой температуре и давлении.
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.
http://znanija.org/himiya/34308400.html
http://nauka.club/khimiya/fenoly.html