Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e269c90af811e7d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
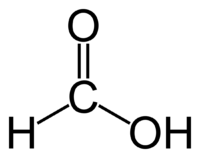
Уравнение серебряного зеркала для муравьиной кислоты
Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Муравьиная кислота
В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьёв, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»).
Впоследствии энтомологи — специалисты по насекомым (от греч. «энтокон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьёв в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает.
Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, в органах, тканях, выделениях животных и человека. В XIX в. муравьиную кислоту (в виде натриевой соли) получили искусственно действием оксида углерода(II) на влажную щёлочь при повышенной температуре: NaOH + СО = HCOONa. И наоборот, под действием концентрированной серной кислоты муравьиная кислота распадается с выделением газа: НСООН = СО + Н2О. Эта реакция используется в лаборатории для получения чистого СО. При сильном нагревании натриевой соли муравьиной кислоты — формиата натрия — идёт совсем другая реакция: углеродные атомы двух молекул кислоты как бы сшиваются и образуется оксалат натрия — соль щавелевой кислоты: 2HCOONa = NaOOC—COONa + Н2.
Важное отличие муравьиной кислоты от других карбоновых кислот в том, что она, как двуликий Янус, обладает одновременно свойствами и кислоты, и альдегида: в её молекуле с одной «стороны» можно увидеть кислотную (карбоксильную) группу —СО—ОН, а с другой — тот же атом углерода, входящий в состав альдегидной группы Н—СО—. Поэтому муравьиная кислота восстанавливает серебро из его растворов — даёт реакцию «серебряного зеркала», которая характерна для альдегидов, но не свойственна кислотам. В случае муравьиной кислоты эта реакция, что тоже необычно, сопровождается выделением углекислого газа в результате окисления органической кислоты (муравьиной) до неорганической (угольной), которая неустойчива и распадается: НСООН + [O] = НО—СО—ОН = СО2 + Н2O.
Муравьиная кислота — самая простая и при этом сильная карбоновая кислота, она в десять раз сильнее уксусной. Когда немецкий химик Юстус Либих впервые получил безводную муравьиную кислоту, оказалось, что это очень опасное соединение. При попадании на кожу оно не только жжёт, но и буквально растворяет её, оставляя трудно заживающие раны. Как вспоминал сотрудник Либиха Карл Фогт (1817—1895), у него на всю жизнь остался шрам на руке — результат «эксперимента», проведённого совместно с Либихом. И неудивительно — впоследствии обнаружилось, что безводная муравьиная кислота растворяет даже капрон, нейлон и прочие полимеры, которые не берут разбавленные растворы других кислот и щелочей.
Неожиданное применение муравьиная кислота нашла при изготовлении так называемых тяжёлых жидкостей — водных растворов, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Растворяя металлический таллий в 90-процентном растворе муравьиной кислоты, получают формиат таллия НСООТl. Эта соль в твёрдом состоянии, может быть, и не рекордсмен по плотности, но её отличает исключительно высокая растворимость: в 100 г воды при комнатной температуре можно растворить 0,5 кг (!) формиата таллия. У насыщенного водного раствора плотность изменяется от 3,40 г/см 3 (при 20 о С) до 4,76 г/см 3 (при 90 о С). Еще большая плотность у раствора смеси формиата таллия и малоната таллия — соли малоновой кислоты CH2(COOTl)2.
При растворении этих солей (в пропорции 1:1 по массе) в минимальном количестве воды образуется жидкость с уникальной плотностью: 4,324 г/см 3 при 20 о С, а при 95 о С плотность раствора можно довести и до 5,0 г/см 3 . В таком растворе плавают барит (тяжёлый шпат), кварц, корунд, малахит и даже гранит!
Муравьиная кислота обладает сильными бактерицидными свойствами. Поэтому её водные растворы используют как пищевой консервант, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки), уничтожают пчелиных клещей. Слабый водно-спиртовой раствор муравьиной кислоты (муравьиный спирт) применяют в медицине для растираний.
http://www.sites.google.com/site/school302chemistry/opyty/kacestvennye-reakcii-10-klass
http://al-himik.ru/muravinaja-kislota/