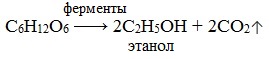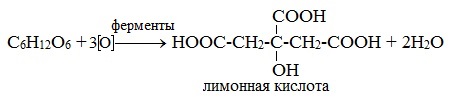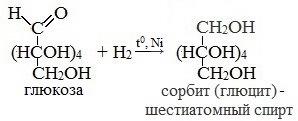Уравнение серебряного зеркала с глюкозой
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
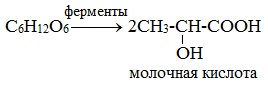
2) Молочнокислое брожение
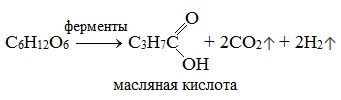
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
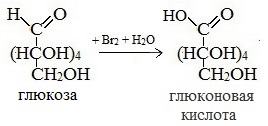
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
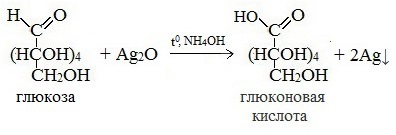
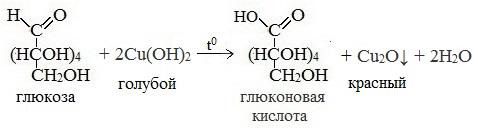
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
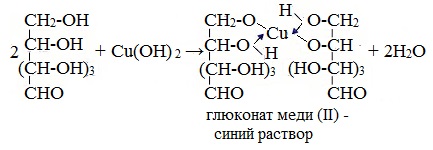
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
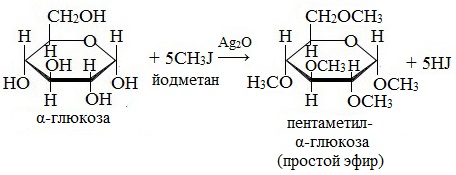
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
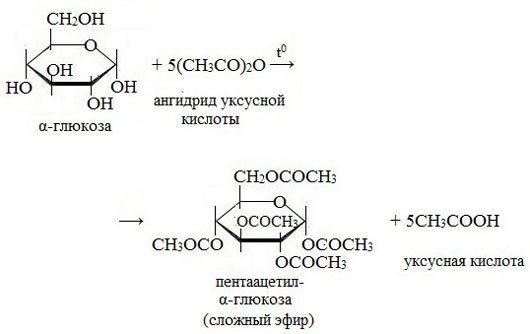
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
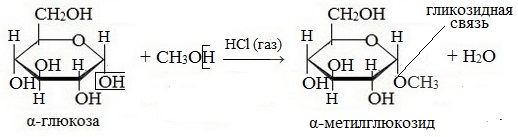
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
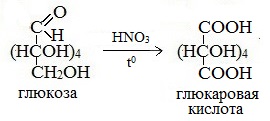
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Уравнение серебряного зеркала с глюкозой
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Смотрите видеоопыт по химии, рассказывающий о реакции глюкоза+аммиачный раствор оксида серебра.
Молекула глюкозы содержит альдегидную группу. Экспериментально доказать наличие альдегидной группы в молекуле глюкозы можно с использованием аммиачного раствора оксида серебра(Ag2O). Качественная реакция на выявление в растворе глюкозы — окисление глюкозы аммиачным раствором оксида серебра(I). Эта реакция называется еще реакцией «серебряного зеркала». Это потому, что глюкоза+аммиачный раствор оксида серебра дает в результате осаждение металлического серебра на внутренней поверхности колбы.
Для проведения опыта сначала в колбу с круглым дном наливают азотнокислое серебро, потом аммиачный раствор и раствор глюкозы. Полученная смесь нагревается на водяной бане для ускорения реакции.
Через некоторое время на стенках колбы равномерно осаждается металлическое серебро, которое создает эффект зеркального отражения. Поэтому эта реакция носит название «реакция серебряного зеркала».
Это качественная реакция на обнаружение альдегидов и альдегидных групп. Альдегидная группа молекулы глюкозы окисляется до карбоксильной группы, глюкоза превращается в глюконовую кислоту. Схематическое уравнение этой реакции:
В промышленной отрасли эту реакцию используют для производства зеркал, термосов, новогодних елочных шаров и т.д.
В чем суть реакции серебряного зеркала
Научное объяснение красивого опыта
Очень наглядным является опыт с красивым эффектом образования на стекле зеркального покрытия. Для этой реакции необходимо запастись опытом и терпением. В этой статье вы узнаете о необходимых реактивах и особенностях подготовки оборудования, а также увидите, по каким уравнениям реакций протекает этот процесс.
Суть реакции серебряного зеркала — в образовании металлического серебра в результате окислительно-восстановительной реакции при взаимодействии аммиачного раствора серебряного оксида в присутствии альдегидов.
Для создания стойкого серебристого слоя понадобится:
- стеклянная колба емкостью до 100 мл;
- раствор аммиака (2,5—4%);
- нитрат серебра (2%);
- водный раствор формальдегида (40%).
Вместо растворов аммиака и нитрата серебра можно взять готовый реактив Толленса — аммиачный раствор оксида серебра. Для его создания нужно добавить 1 грамм нитрата серебра в 10 капель воды (если жидкость будет храниться долго, надо поместить ее в темное место или в стеклянную емкость с темными стенками). Непосредственно перед опытом раствор (около 3 мл) надо смешать в пропорции 1:1 с 10%-ным водным раствором гидроксида натрия. Серебро может выпасть в осадок, поэтому его разводят, медленно добавляя аммиачный раствор. Рекомендуем провести еще один зрелищный опыт с аммиачным раствором и напечатать «химическую фотографию».
Реакция проводится при комнатной температуре. Обязательное условие успешного финала — это идеально чистые и гладкие стенки стеклянного сосуда. Если на стенках будут малейшие частички загрязнений, осадок, получаемый в результате опыта, станет рыхлым слоем черного или темно-серого цвета.
Для очистки колбы нужно использовать разные виды растворов щелочей.Так, для обработки можно взять раствор едкого натра, который после очистки приходится смывать дистиллированной водой. Промывать колбу от чистящего средства необходимо много раз.
Почему так важна чистота сосуда
Дело в том, что коллоидные частицы серебра, образующиеся в конце опыта, должны прочно сцепиться с поверхностью стекла. На его поверхности не должно быть жиров и механических частиц. Дистиллированная вода не содержит солей и идеально подходит для финишной очистки колбы. Ее можно приготовить в домашних условиях, но проще купить готовую жидкость.
Уравнение реакции серебряного зеркала:
Ag₂O + 4 NH₃·Н₂О ⇄ 2[Ag(NН₃)₂]ОН + 3Н₂О,
где [Ag(NН₃)₂]ОН — это гидроксида диамминсеребра, получившийся при растворении оксида металла в водном растворе аммиака.
Важно! Реакция работает при слабых концентрациях аммиака — внимательно соблюдайте пропорции!
Так протекает окончательный этап реакции:
R (какой-либо альдегид)-CH=O + 2[Ag(NH₃)₂]OH → 2Ag (коллоид серебра, выпавший в осадок) ↓ + R-COONH₄ + 3NH₃ + H₂O
Второй этап реакции лучше проводить, аккуратно нагревая колбу над пламенем горелки — это увеличит шансы, что опыт пройдет успешно.
Что может показать реакция серебряного зеркала
Эта интересная химическая реакция демонстрирует не только определенные состояния вещества — с ее помощью можно выполнить качественное определение альдегидов. То есть подобная реакция решит вопрос: есть ли в растворе альдегидная группа или нет.
Например, в подобном процессе можно узнать, что содержится в растворе: глюкоза или фруктоза. Глюкоза даст положительный результат — получится «серебряное зеркало», а фруктоза содержит кетоновую группу и получить осадок серебра нельзя. Для того чтобы провести анализ, вместо раствора формальдегида необходимо добавлять 10%-ный раствор глюкозы. Рассмотрим, почему и как растворенное серебро превращается в твердый осадок:
2[Ag(NH₃)₂]OH + 3H₂O + C₆H₁₂O₆ (глюкоза) = 2Ag↓+ 4NH₃∙H₂O + C₆H₁₂O₇ (образуется глюконовая кислота).
http://paramitacenter.ru/node/462
http://melscience.com/RU-ru/articles/v-chem-sut-reakcii-serebryanogo-zerkala/