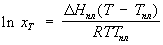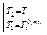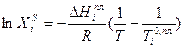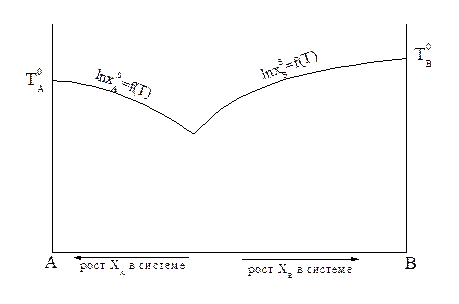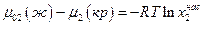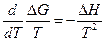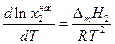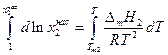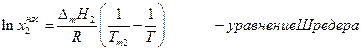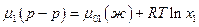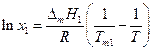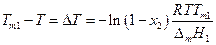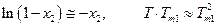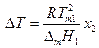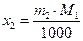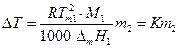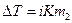Шредера уравнение
Шр е дера уравн е ние, математическое соотношение, выражающее связь между растворимостью кристаллического тела xt при температуре Т (в К), его теплотой плавления D Нпл (в кал/моль) и температурой плавления Тпл:
где R — газовая постоянная; D Нпл принимается постоянной в интервале Тпл — Т. Строгое применение Шредера уравнения ограничено идеальными растворами. Построив по Шредера уравнению кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Шредера уравнение выведено в 1890 И. Ф. Шредером. Оно известно также под названием «логарифмики Шредера» и уравнения Шредера — Ле Шателье (А. Ле Шателье ранее получил зависимость растворимости от температуры в дифференциальной форме, на основании которой в 1894 вывел уравнение, аналогичное Шредера уравнению).
Лит.: Кипнис А. Я., Развитие химической термодинамики в России, М.—Л., 1964. См. также лит. при ст. Растворы.
Равновесие раствор – кристаллический компонент
Если два компонента А и В смешать, расплавить до получения однородного раствора, а затем начать охлаждать, то при некоторой температуре из раствора начнут образовываться кристаллы, так как растворимость веществ с понижением температуры, как правило, уменьшается. В зависимости от состава исходного раствора при понижении температуры он становится насыщенным по отношению либо к компоненту А, либо В, что приводит к кристаллизации соответственно А или В. В зависимости от состава раствора температура начала кристаллизации будет также различной. Иначе говоря, состав раствора, насыщенного каким-либо компонентом, т.е. растворимость этого компонента, зависит от температуры.
Уравнением, описывающим зависимость растворимости кристаллических веществ в жидкостях от температуры, является уравнение Шредера:
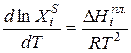
где 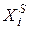
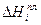
Уравнение Шредера справедливо только для идеальных растворов. Из анализа уравнения (2.7) следует, что растворимость твердых веществ в жидкостях растет с ростом температуры. Действительно, правая часть уравнения для идеальных растворов всегда больше нуля, следовательно, производная 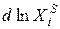
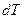
Интегрируя уравнение (2.7) для бинарной системы в пределах от Х1=1 (чистый компонент) до Х2 = X s (насыщенный раствор при любой температуре), получим уравнение Шредера в интегральной форме:
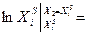
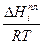
Пользуясь этим уравнением, можно найти растворимость i-гo компонента, выраженную в молярных долях Xi при любой температуре. Если раствор идеален и рассматривается во всём интервале концентраций от ХА = 1 до Хв = I, необходимо иметь в виду, что при одних составах раствор оказывается насыщенным компонентом А (здесь надо говорить о растворимости компонента А в В), при других — компонентом В (здесь уже идет речь о растворимости В в А). В первом случае применимо уравнение Шредера для компонента А; во втором – для компонента В:
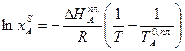
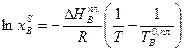
Очевидно, должен быть и такой раствор, который является насыщенным сразу обоими веществами, для него 
Рисунок 2.4 — Кривые зависимости растворимости компонентов А и В от температуры
Кривые охлаждения
Расчёт диаграмм растворимости (с равным правом их можно назвать диаграммами плавкости) возможен лишь для идеальных систем. Для реальных систем приходится экспериментально определять температуру, при которой раствор данной концентрации становится насыщенным. Это производится путем снятия так называемых кривых охлаждения для систем нескольких составов (метод называется термическим анализом), в координатах (температура; время).
При охлаждении однокомпонентной жидкости сначала происходит равномерное понижение температуры во времени. Появление кристаллов сопровождается выделением тепла, которое компенсирует теплоотвод, и дальнейшего понижения температуры в системе не происходит до полной кристаллизации жидкости, после чего температура снова понижается (рисунок 2.5 а).
Для двухкомпонентной системы наблюдается иной тип кривой охлаждения (рисунок 2.5 б). Сначала жидкая система охлаждается равномерно с определенной скоростью 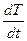
По мере выделения одного из компонентов в третью фазу, происходит накапливание второго компонента в растворе. Наконец при некоторой температуре раствор становится насыщенным по отношению и ко второму компоненту, т.е. начинается кристаллизация обоих компонентов одновременно.
Смесь кристаллов, образующихся при совместной кристаллизации двух компонентов, называется эвтектикой.
Эвтектика имеет определенный состав, наименьшую и всегда постоянную (эвтектическую) температуру кристаллизации (плавления) при данном давлении. Если взять расплав, соответствующий составу эвтектики, то кривая охлаждения будет иметь вид (рисунок 2.5 в). В сплавах, отличающихся по составу от эвтектического, всегда первым будет кристаллизоваться компонент, находящийся в избытке по сравнению с составом эвтектики, а затем, когда избыток выкристаллизуется, а состав станет равным эвтектическому, будет кристаллизоваться эвтектика. Таким образом, у сплавов с различным составом начинается кристаллизация при различных температурах, а заканчивается при одной и той же, эвтектической температуре. Анализируя кривые охлаждения, находят температуры начала кристаллизации расплавов и, нанеся эти точки на диаграмму Т – состав получают линию ликвидуса, а соединяя точки, отвечающие температуре конца затвердевания, вычерчивают линию солидуса. Так получают диаграмму плавкости.
Рисунок 2.5 – Типы кривых охлаждения:
а – для чистого вещества А;
б – для смеси веществ А + В;
в – для эвтектической смеси;
г – кривая охлаждения в случае оразования метастабильного состояния (переохлажденного состояния);
д – для системы, где нет фазовых превращений
Глава 11. Коллигативные свойства растворов.
11.1. Растворимость твердого вещества в идеальном растворе.
Растворимость твердого вещества в данном растворе измеряется концентрацией его насыщенного раствора при данной температуре и давлении. Насыщенный раствор – это раствор, находящийся в равновесии с кристаллами твердого вещества, следовательно в насыщенном растворе химические потенциалы растворенного вещества в жидкой и твердой фазах одинаковы:
Если при растворении твердого вещества образуется идеальный раствор, то химический потенциал этого вещества в насыщенном растворе будет:
где μ02 (ж) – химический потенциал чистого растворенного вещества в жидком состоянии. Тогда, очевидно,
Но 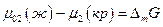
где Δ G иΔ Н относятся к одному и тому же процессу, поэтому получаем при постоянном давлении
В полученном уравнении отсутствуют величины, характеризующие индивидуальные свойства растворителя. Следовательно, идеальная растворимость твердых тел не зависит от природы растворителя. А поскольку 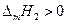
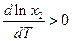
Разделим переменные и возьмем интеграл от 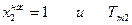

Теплоемкости жидкого и твердого вещества сравнительно мало отличаются друг от друга, поэтому можно предположить, что в интервале от Т до Тт2 ΔтН2 =const и после взятия интегралов имеем:
Поскольку Тт2 > T, то 1/Tm2 , V2(кр), поэтому с увеличением давления при постоянной температуре идеальная растворимость уменьшается.
11.2. Понижение температуры замерзания растворов. Криоскопия.
Будем понимать под температурой кристаллизации раствора ту температуру, при которой кристаллы растворителя находятся в равновесии с раствором, т.е. раствор при этой температуре становится насыщенным относительно растворителя. Из условий равновесия имеем :
Если раствор достаточно разбавлен, то давление пара растворителя подчиняется закону Рауля р1 =р01 ·х1, поэтому
и, повторив выкладки предыдущего параграфа, получим
где Тт1 –температура кристаллизации чистого растворителя, Т – температура кристаллизации раствора, имеющего концентрацию растворителя х1 . Так как
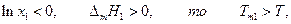
Преобразуем полученное уравнение:
Если х2 мало (раствор разбавлен), то
и
Поскольку в разбавленном растворе моляльность т2 и мольная доля х2 связаны соотношением
где М1 — мольная масса растворителя, то
Величина К называется криоскопической константой растворителя.
С помощью измерений ΔТ для данного растворителя с известной К можно определить мольную массу растворенного вещества :
где g1 и g2 навески растворителя и растворенного вещества в граммах.
Криоскопия – один из способов определения мольных масс или чистоты вещества. Надежные результаты получаются в растворителях с высокими значениями криоскопических постоянных при условии, что при растворении не происходит диссоциации или ассоциации молекул растворенного вещества. Диссоциация Растворенного вещества приводит к увеличению его числа частиц ( ионов ). Поэтому для растворов электролитов :
где i – изотонический коэфициент Вант-Гоффе, показывающий во сколько раз увеличилось число частиц в растворе вследствие диссоциации :
где α –степень диссоциации, п –число ионов, на которые распадается молекула.
| Растворитель | К |
| Вода | 1,86 |
| Бензол | 5,12 |
| Циклогексан | 20,0 |
| Сероуглерод | 3,8 |
| Камфора |
Если α = 1, то i = n. Однако i практически всегда меньше n, так как ионы в растворах не свободны, а связаны силами электростатического взаимодействия. Измерив ΔТ раствора известной моляльности можно определить изотонический коэффициент, а следовательно, степень диссоциации, что особенно пригодно для слабых электролитов. Приведем еще таблицу замерзания водноэтанольных растворов
| m | |||||||
| t 0 C | -3,6 | -7,92 | -12,3 | -22 | -30 | -36 | -42 |
11.3. Температура кипения растворов нелетучих веществ. Эбулиоскопия.
Раствор, как и любая жидкость, кипит, когда давление насыщенного пара станет равным внешнему давлению. Если растворенное вещество нелетуче, то пар будет содержать только растворитель и по закону Рауля давление пара растворителя над раствором всегда меньше, чем над чистым растворителем при той же температуре, поэтому раствор должен кипеть при более высокой температуре.
Если раствор достаточно разбавлен и соблюдается закон Рауля, то в точке кипения раствора
http://poznayka.org/s23275t1.html
http://helpiks.org/4-36434.html