Уравнение шредингера для электронов в атоме
3.1.2 Волновое уравнение. Квантовомеханическое объяснение строения атома
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома.

m – масса электрона Масса покоя электрона me=9,109 . 10 -31 кг ;
E – полная энергия электрона;
x , y , z – координаты.
Решением уравнения Шредингера является волновая функция Ψ и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции, т.е. величиной | Ψ | 2 . Для описания строения атома можно рассматривать электрон как бы “размазанным” в пространстве в виде электронного облака. Величина | Ψ | 2 , полученная из волнового уравнения, является мерой электронной плотности в данном элементе объема, или мерой вероятности нахождения электрона в данном элементе объема атома.
Таким образом, в квантовомеханической (вероятностной) модели атома исчезает смысл орбиты, на которой находится электрон. Взамен ее мы имеем дело с электронной плотностью, “размазанной” в пространстве атома. Тело, образованное “размазанным” электроном, называют орбиталью . Обычно под орбиталью понимают часть пространства, заключающую 90% электронного облака.
Наличие трех измерений пространства приводит к тому, что в выражении волновой функции Ψ , являющейся решением уравнения Шредингера, появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n , l и ml . Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.
а) Главное квантовое число ( n ) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ∞ . В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число ( l ). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l . Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n –1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s ( l=0), p ( l=1), d ( l=2), f ( l=3). Электроны, находящиеся в этих состояниях, называются s -, p -, d — и f-электронами.
Форма s-электронного облака . Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции Ψ расположен по одну сторону от оси абсцисс (рисунок 3.1), т.е. волновая функция s-электрона положительна.
Рисунок 3.1 – График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
Форма p-электронного облака . Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб (рисунок 3.2). По одну сторону от ядра Ψ положительна , а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат Ψ обращается в нуль. В отличие от s-орбитали , p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель (рисунок 3.2).
Рисунок 3.2 – График волновой функции p-электрона. Форма p-электронного облака
Знаки “+” и “–” от носятся не к вероятности нахождения электрона (она всегда положительна и равна | Ψ | 2 ), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
Еще более сложную форму имеют электронные облака d — и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются:
в) Магнитное квантовое число ( ml ). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от – l до + l . Таким образом, при данном l оно имеет (2 l+1) различных значений. Например, для s-подуровня ( l=0) имеется только одно значение ml , равное нулю. Поэтому s-подуровень содержит единственную орбиталь . Для p-подуровня ( l=1) возможны три значения: ml ∈ <–1,0,1>. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px , py , pz . Легко определить, что на d-подуровне ( l=2) содержится 2 l+1=5 орбиталей , а на f-подуровне ( l=3) – 7 орбиталей .
На рисунке 3.3 показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям ).
Рисунок 3.3 – Эволюция представлений о строении электронной оболочки атома. Энергетическая диаграмма уровней с 1-го по 3-й
г) Спиновое квантовое число ( ms ) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси «Spin» в переводе с английского — «кружение», «верчение». . Число ms принимает два значения: +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь , характеризующаяся определенными значениями n , l и ml , может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
Уравнение Шредингера
Вы будете перенаправлены на Автор24
Предпосылки вывода уравнения Шредингера
Основная идея волновой механики заключается в том, что для таких малых тел, как электрон, нельзя с определенностью сказать, где оно находится в данное время и куда направляется. Можно установить только относительную вероятность его нахождения в том или ином месте и наличие определенного количества движения в определенный момент времени.
В соответствии с волновой механикой какая-либо система – атом, молекула, электрон и т.д. – описывается функцией состояния или волновой функцией, обозначаемой $\psi$ («пси»), которая является функцией координат всех частиц, образующих эту систему. Следовательно, величина $\psi$ зависит только от положения всех частиц в пространстве.
В 1924 г. де Бройль предположил, что точно также, как свет, который, как обычно считают, имеет волновую природу, на самом деле при определенных обстоятельствах ведет себя, как будто он состоит из частиц – квантов, — так и очень малые частицы, такие, как электроны, также могут обладать волновыми свойствами. Де Бройль предположил, что с пучком электронов следует связывать длину волны, определяемую уравнением
где $\hbar$ – постоянная Планка ($6,626\cdot 1034 Дж\cdot с$ или $6,626\cdot 10-27 эрг\cdot с$), а $p$ – количество движения (импульс) электрона в пучке, т.е. его масса, умноженная на его скорость.
Физическое подтверждение волновой природы электрона было продемонстрировано в 1927 – 1928 гг. Дейвиссоном, Джермером и Томсоном, которые показали, что пучок электронов может испытывать дифракцию на подходящей решетке (атомы в кристалле золота), аналогичную дифракции пучка света.
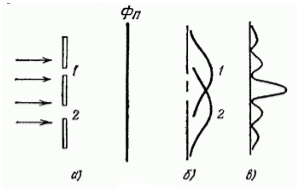
Рисунок 1. Дифракция пучка электронов
На преграду с двумя узкими щелями направлен параллельный пучок моноэнергетических (т.е. обладающих одинаковой кинетической энергией) электронов (рис. 1. а). За преградой находится фотопластина $Фn$. При закрытии щели номер $2$ и экспонировании в течение времени $t$ почернение на проявленной фотопластине будет характеризоваться кривой $1$ (рис. 1. б). При закрытии щели номер $1$, соответственно, почернение на фотопластине будет соответствовать кривой $2$. Однако в случае, когда открыты обе щели картина почернения фотопластины (рис. 1. в) отнюдь не эквивалентна наложению двух первых картин. Зато она аналогична картине, получающейся при интерференции двух когерентных световых волн.
Готовые работы на аналогичную тему
Тот факт, что системы малых частиц проявляют, по крайней мере, при определенных условиях, волновые свойства, предполагает возможность описания таких систем уравнениями, подобными те, которые описывают другие виды волнового движения, например, волны, которые распространяются вдоль колеблющейся струны, или волновое движение, приписываемое электромагнитному излучению. Действительно, можно начать с волнового уравнения, соответствующего электромагнитным волнам, и путем определенных замен, превратить его в уравнение, соответствующее нашему случаю. Хотя эти замены диктуются физическими причинами, они в основном произвольны и могут быть приняты только потому, что приводят к уравнению, которое, как показывает опыт, позволяет получить правильное решение физических задач. Поэтому следует принять волновое уравнение как постулат, так как у химиков основной интерес вызывает применение волнового уравнения к атомным и молекулярным системам, а не физические и математические соображения, которыми руководствовался Шредингер, впервые его предложивший в 1925 г.
Общий вид уравнения Шредингера
Рисунок 2. Эрвин Шрёдингер (1887 — 1961)
Волновое уравнение, применяемое для расчета стационарных состояний системы, можно записать в символическом виде:
где $H$ представляет собой определенный способ выражения общей энергии системы, а $E$ – числовое значение этой энергии. Для всех систем, которые обычно интересуют химиков, общая энергия представляет собой сумму кинетической энергии $Т$ и потенциальной энергии $V$:
Это соотношение было широко использовано физиком-теоретиком Гамильтоном, поэтому $H$ часто называют функцией Гамильтона, а $\mathcal H$ гамильтонианом системы.
Уравнение Шредингера на примере атома водорода
Рассмотрим модель атома водорода, предложенную Бором. Для простоты предположим, что тяжелое ядро закреплено (оно почти, но не совершенно неподвижно, когда электрон движется вокруг него). Тогда полная кинетическая энергия $Т$ системы представляет собой просто кинетическую энергию электрона
где $m$ – масса электрона и $\nu$ – его скорость. Потенциальная энергия системы есть просто энергия, возникающая вследствие электростатического взаимодействия (гравитационные силы приблизительно в $10^<18>$ раз меньше), и ее можно выразить как
где $e$ — заряд электрона, $r$ — радиус орбиты, знак минус появляется вследствие того, что заряд одной из частиц положителен $(+)$, а другой отрицателен $(-)$. Поэтому для атома водорода функция Гамильтона в классической (т.е. доквантовомеханической) физике равна:
Если использовать понятие количества движения электрона $p=m\nu$, данное уравнение запишется в следующем виде:
Теперь для перехода от классического описания этой или какой-либо другой системы к описанию при помощи волновой механики, необходимо взять функцию Гамильтона (уравнение 6) и произвести в ней определенные замены: в функции Гамильтона количество движения следует заменить выражением
Таким образом, гамильтониан для атома водорода в его квантовомеханической форме $<\mathcal H>$ следует записать в виде
Если теперь это выражение гамильтониана подставить в общее волновое уравнение (уравнение 1), то получим:
Это и есть волновое уравнение для атома водорода. Из уравнения 9 следует, что нужно вторые производные функции $\psi $ сложить и умножить на $-<<\hbar >^2>/<8<\pi >^2m>$, затем к этому добавить $\left(-
Атомная модель характеристик Шредингера, постулаты
Атомная модель Шредингера Он был разработан Эрвином Шредингером в 1926 году. Это предложение называется квантово-механической моделью атома и описывает волновое поведение электрона..
Для этого выдающийся австрийский физик был основан на гипотезе Бройля, который заявил, что каждая движущаяся частица связана с волной и может вести себя так.
Шредингер предположил, что движение электронов в атоме соответствует дуальности волны и частицы, и, следовательно, электроны могут быть мобилизованы вокруг ядра в виде стоячих волн..
Шредингер, который был удостоен Нобелевской премии в 1933 году за вклад в атомную теорию, разработал одноименное уравнение для расчета вероятности того, что электрон окажется в определенной позиции..
- 1 Характеристики атомной модели Шредингера
- 2 Эксперимент
- 2.1 Эксперимент Юнга: первая демонстрация дуальности волны-частицы
- 2.2 Уравнение Шредингера
- 3 постулата
- 4 Статьи интересов
- 5 ссылок
Характеристики атомной модели Шредингера
-Описывает движение электронов как стоячих волн.
-Электроны движутся постоянно, то есть они не имеют фиксированного или определенного положения внутри атома.
-Эта модель не предсказывает местоположение электрона и не описывает маршрут, который он совершает внутри атома. Он только устанавливает зону вероятности для обнаружения электрона.
-Эти области вероятности называются атомными орбиталями. Орбитали описывают движение переноса вокруг ядра атома.
-Эти атомные орбитали имеют разные уровни и подуровни энергии и могут быть определены между электронными облаками.
-Модель не рассматривает стабильность ядра, а относится только к объяснению квантовой механики, связанной с движением электронов внутри атома..
эксперимент
Атомная модель Шредингера основана на гипотезе Бройля и предыдущих атомных моделях Бора и Зоммерфельда..
Для этого Шредингер опирался на эксперимент Юнга и на основе собственных наблюдений разработал математическое выражение, носящее его имя..
Следуя научным основам этой атомной модели:
Эксперимент Юнга: первая демонстрация волновой двойственности
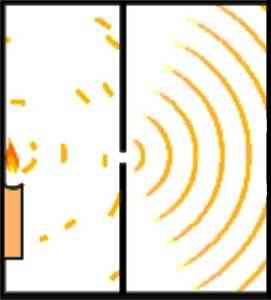
Гипотеза Бройля о волнообразной и корпускулярной природе материи может быть продемонстрирована экспериментом Янга, также известным как эксперимент с двумя щелями..
Английский ученый Томас Янг заложил основы атомной модели Шредингера, когда в 1801 году он провел эксперимент, чтобы проверить волновую природу света.
Во время своих экспериментов Янг разделил излучение луча света, который проходит через небольшое отверстие через камеру наблюдения. Это разделение достигается за счет использования 0,2-миллиметровой карты, расположенной параллельно балке..
Дизайн эксперимента был сделан таким образом, чтобы луч света был шире, чем карточка, поэтому при размещении карточки горизонтально луч делился на две примерно равные части. Выход световых лучей направлялся зеркалом.
Оба луча света попали в стену темной комнаты. Там картина интерференции между обеими волнами была очевидна, с которой было продемонстрировано, что свет может вести себя так же, как частица, как волна.
Спустя столетие Альберт Эйнстен подкрепил идею принципами квантовой механики..
Уравнение Шредингера
Шредингер разработал две математические модели, дифференцируя происходящее в зависимости от того, изменяется ли квантовое состояние во времени или нет.
Для атомного анализа Шредингер опубликовал в конце 1926 года независимое от времени уравнение Шредингера, основанное на волновых функциях, которые ведут себя как стоячие волны..
Это означает, что волна не движется, ее узлы, то есть ее точки равновесия, служат опорой для остальной части структуры, чтобы двигаться вокруг них, описывая определенную частоту и амплитуду.
Шредингер определил волны, которые описывают электроны как стационарные или орбитальные состояния и связаны, в свою очередь, с различными уровнями энергии.
Уравнение Шредингера, не зависящее от времени, выглядит следующим образом:
Е: константа пропорциональности.
Ψ: волновая функция квантовой системы.
Η: Гамильтонов оператор.
Не зависящее от времени уравнение Шредингера используется, когда наблюдаемая, представляющая полную энергию системы, известную как гамильтонов оператор, не зависит от времени. Однако функция, которая описывает полное движение волны, всегда будет зависеть от времени.
Уравнение Шредингера показывает, что если у нас есть волновая функция Ψ и на нее действует гамильтонов оператор, константа пропорциональности E представляет полную энергию квантовой системы в одном из ее стационарных состояний.
Применительно к атомной модели Шредингера, если электрон движется в определенном пространстве, существуют дискретные значения энергии, и если электрон движется свободно в пространстве, существуют непрерывные интервалы энергии.
С математической точки зрения, есть несколько решений для уравнения Шредингера, каждое решение предполагает различное значение для константы пропорциональности E.
Согласно принципу неопределенности Гейзенберга, невозможно оценить положение или энергию электрона. Следовательно, ученые признают, что оценка местоположения электрона внутри атома является неточной.
постулаты
Постулаты атомной модели Шредингера таковы:
-Электроны ведут себя как стоячие волны, которые распределены в пространстве в соответствии с волновой функцией Ψ.
-Электроны движутся внутри атома при описании орбиталей. Это области, где вероятность обнаружения электрона значительно выше. Приведенная вероятность пропорциональна квадрату волновой функции Ψ 2 .
Электронная конфигурация атомной модели Шредингера объясняет периодические свойства атомов и связей, которые образуют.
Однако модель атома Шредингера не рассматривает спин электронов и не учитывает изменения поведения быстрых электронов из-за релятивистских эффектов..
http://spravochnick.ru/himiya/atomnye_i_molekulyarnye_orbitali/uravnenie_shredingera/
http://ru.thpanorama.com/articles/fsica/modelo-atmico-de-schrdinger-caractersticas-postulados.html