Уравнение Шредингера
Вы будете перенаправлены на Автор24
Предпосылки вывода уравнения Шредингера
Основная идея волновой механики заключается в том, что для таких малых тел, как электрон, нельзя с определенностью сказать, где оно находится в данное время и куда направляется. Можно установить только относительную вероятность его нахождения в том или ином месте и наличие определенного количества движения в определенный момент времени.
В соответствии с волновой механикой какая-либо система – атом, молекула, электрон и т.д. – описывается функцией состояния или волновой функцией, обозначаемой $\psi$ («пси»), которая является функцией координат всех частиц, образующих эту систему. Следовательно, величина $\psi$ зависит только от положения всех частиц в пространстве.
В 1924 г. де Бройль предположил, что точно также, как свет, который, как обычно считают, имеет волновую природу, на самом деле при определенных обстоятельствах ведет себя, как будто он состоит из частиц – квантов, — так и очень малые частицы, такие, как электроны, также могут обладать волновыми свойствами. Де Бройль предположил, что с пучком электронов следует связывать длину волны, определяемую уравнением
где $\hbar$ – постоянная Планка ($6,626\cdot 1034 Дж\cdot с$ или $6,626\cdot 10-27 эрг\cdot с$), а $p$ – количество движения (импульс) электрона в пучке, т.е. его масса, умноженная на его скорость.
Физическое подтверждение волновой природы электрона было продемонстрировано в 1927 – 1928 гг. Дейвиссоном, Джермером и Томсоном, которые показали, что пучок электронов может испытывать дифракцию на подходящей решетке (атомы в кристалле золота), аналогичную дифракции пучка света.
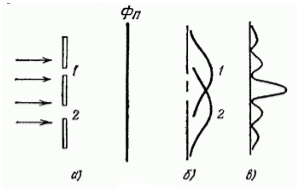
Рисунок 1. Дифракция пучка электронов
На преграду с двумя узкими щелями направлен параллельный пучок моноэнергетических (т.е. обладающих одинаковой кинетической энергией) электронов (рис. 1. а). За преградой находится фотопластина $Фn$. При закрытии щели номер $2$ и экспонировании в течение времени $t$ почернение на проявленной фотопластине будет характеризоваться кривой $1$ (рис. 1. б). При закрытии щели номер $1$, соответственно, почернение на фотопластине будет соответствовать кривой $2$. Однако в случае, когда открыты обе щели картина почернения фотопластины (рис. 1. в) отнюдь не эквивалентна наложению двух первых картин. Зато она аналогична картине, получающейся при интерференции двух когерентных световых волн.
Готовые работы на аналогичную тему
Тот факт, что системы малых частиц проявляют, по крайней мере, при определенных условиях, волновые свойства, предполагает возможность описания таких систем уравнениями, подобными те, которые описывают другие виды волнового движения, например, волны, которые распространяются вдоль колеблющейся струны, или волновое движение, приписываемое электромагнитному излучению. Действительно, можно начать с волнового уравнения, соответствующего электромагнитным волнам, и путем определенных замен, превратить его в уравнение, соответствующее нашему случаю. Хотя эти замены диктуются физическими причинами, они в основном произвольны и могут быть приняты только потому, что приводят к уравнению, которое, как показывает опыт, позволяет получить правильное решение физических задач. Поэтому следует принять волновое уравнение как постулат, так как у химиков основной интерес вызывает применение волнового уравнения к атомным и молекулярным системам, а не физические и математические соображения, которыми руководствовался Шредингер, впервые его предложивший в 1925 г.
Общий вид уравнения Шредингера
Рисунок 2. Эрвин Шрёдингер (1887 — 1961)
Волновое уравнение, применяемое для расчета стационарных состояний системы, можно записать в символическом виде:
где $H$ представляет собой определенный способ выражения общей энергии системы, а $E$ – числовое значение этой энергии. Для всех систем, которые обычно интересуют химиков, общая энергия представляет собой сумму кинетической энергии $Т$ и потенциальной энергии $V$:
Это соотношение было широко использовано физиком-теоретиком Гамильтоном, поэтому $H$ часто называют функцией Гамильтона, а $\mathcal H$ гамильтонианом системы.
Уравнение Шредингера на примере атома водорода
Рассмотрим модель атома водорода, предложенную Бором. Для простоты предположим, что тяжелое ядро закреплено (оно почти, но не совершенно неподвижно, когда электрон движется вокруг него). Тогда полная кинетическая энергия $Т$ системы представляет собой просто кинетическую энергию электрона
где $m$ – масса электрона и $\nu$ – его скорость. Потенциальная энергия системы есть просто энергия, возникающая вследствие электростатического взаимодействия (гравитационные силы приблизительно в $10^<18>$ раз меньше), и ее можно выразить как
где $e$ — заряд электрона, $r$ — радиус орбиты, знак минус появляется вследствие того, что заряд одной из частиц положителен $(+)$, а другой отрицателен $(-)$. Поэтому для атома водорода функция Гамильтона в классической (т.е. доквантовомеханической) физике равна:
Если использовать понятие количества движения электрона $p=m\nu$, данное уравнение запишется в следующем виде:
Теперь для перехода от классического описания этой или какой-либо другой системы к описанию при помощи волновой механики, необходимо взять функцию Гамильтона (уравнение 6) и произвести в ней определенные замены: в функции Гамильтона количество движения следует заменить выражением
Таким образом, гамильтониан для атома водорода в его квантовомеханической форме $<\mathcal H>$ следует записать в виде
Если теперь это выражение гамильтониана подставить в общее волновое уравнение (уравнение 1), то получим:
Это и есть волновое уравнение для атома водорода. Из уравнения 9 следует, что нужно вторые производные функции $\psi $ сложить и умножить на $-<<\hbar >^2>/<8<\pi >^2m>$, затем к этому добавить $\left(-
Уравнение Шрёдингера
Дуальная корпускулярно-волновая природа квантовых частиц описывается дифференциальным уравнением.
Согласно фольклору, столь распространенному среди физиков, случилось это так: в 1926 году физик-теоретик по имени Эрвин Шрёдингер выступал на научном семинаре в Цюрихском университете. Он рассказывал о странных новых идеях, витающих в воздухе, о том, что объекты микромира часто ведут себя скорее как волны, нежели как частицы. Тут слова попросил пожилой преподаватель и сказал: «Шрёдингер, вы что, не видите, что всё это чушь? Или мы тут все не знаем, что волны — они на то и волны, чтобы описываться волновыми уравнениями?» Шрёдингер воспринял это как личную обиду и задался целью разработать волновое уравнение для описания частиц в рамках квантовой механики — и с блеском справился с этой задачей.
Тут необходимо сделать пояснение. В нашем обыденном мире энергия переносится двумя способами: материей при движении с места на место (например, едущим локомотивом или ветром) — в такой передаче энергии участвуют частицы — или волнами (например, радиоволнами, которые передаются мощными передатчиками и ловятся антеннами наших телевизоров). То есть в макромире, где живём мы с вами, все носители энергии строго подразделяются на два типа — корпускулярные (состоящие из материальных частиц) или волновые. При этом любая волна описывается особым типом уравнений — волновыми уравнениями. Все без исключения волны — волны океана, сейсмические волны горных пород, радиоволны из далеких галактик — описываются однотипными волновыми уравнениями. Это пояснение нужно для того, чтобы было понятно, что если мы хотим представить явления субатомного мира в терминах волн распределения вероятности (см. Квантовая механика), эти волны также должны описываться соответствующим волновым уравнением.
Шрёдингер применил к понятию волн вероятности классическое дифференциальное уравнение волновой функции и получил знаменитое уравнение, носящее его имя. Подобно тому как обычное уравнение волновой функции описывает распространение, например, ряби по поверхности воды, уравнение Шрёдингера описывает распространение волны вероятности нахождения частицы в заданной точке пространства. Пики этой волны (точки максимальной вероятности) показывают, в каком месте пространства скорее всего окажется частица. Хотя уравнение Шрёдингера относится к области высшей математики, оно настолько важно для понимания современной физики, что я его все-таки здесь приведу — в самой простой форме (так называемое «одномерное стационарное уравнение Шрёдингера»). Вышеупомянутая волновая функция распределения вероятности, обозначаемая греческой буквой ψ («пси»), является решением следующего дифференциального уравнения (ничего страшного, если оно вам не понятно; главное — примите на веру, что это уравнение свидетельствует о том, что вероятность ведёт себя как волна):
где x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы.
Картина квантовых событий, которую дает нам уравнение Шрёдингера, заключается в том, что электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
Когда Шрёдингер впервые опубликовал свои результаты, в мире теоретической физики разразилась буря в стакане воды. Дело в том, что практически в то же время появилась работа современника Шрёдингера — Вернера Гейзенберга (см. Принцип неопределенности Гейзенберга), в которой автор выдвинул концепцию «матричной механики», где те же задачи квантовой механики решались в другой, более сложной с математической точки зрения матричной форме. Переполох был вызван тем, что ученые попросту испугались, не противоречат ли друг другу два в равной мере убедительных подхода к описанию микромира. Волнения были напрасны. Сам Шрёдингер в том же году доказал полную эквивалентность двух теорий — то есть из волнового уравнения следует матричное, и наоборот; результаты же получаются идентичными. Сегодня используется в основном версия Шрёдингера (иногда его теорию называют «волновой механикой»), так как его уравнение менее громоздкое и его легче преподавать.
Однако представить себе и принять, что нечто вроде электрона ведёт себя как волна, не так-то просто. В повседневной жизни мы сталкиваемся либо с частицей, либо с волной. Мяч — это частица, звук — это волна, и всё тут. В мире квантовой механики всё не так однозначно. На самом деле — и эксперименты это вскоре показали — в квантовом мире сущности отличаются от привычных нам объектов и обладают другими свойствами. Свет, который мы привыкли считать волной, иногда ведёт себя как частица (которая называется фотон), а частицы вроде электрона и протона могут вести себя как волны (см. Принцип дополнительности).
Эту проблему обычно называют двойственной или дуальной корпускулярно-волновой природой квантовых частиц, причем свойственна она, судя по всему, всем объектам субатомного мира (см. Теорема Белла). Мы должны понять, что в микромире наши обыденные интуитивные представления о том, какие формы может принимать материя и как она себя может вести, просто неприменимы. Сам факт, что мы используем волновое уравнение для описания движения того, что привыкли считать частицами, — яркое тому доказательство. Как уже отмечалось во Введении, в этом нет особого противоречия. Ведь у нас нет никаких веских оснований полагать, будто то, что мы наблюдаем в макромире, должно с точностью воспроизводиться на уровне микромира. И тем не менее дуальная природа элементарных частиц остается одним из самых непонятных и тревожащих аспектов квантовой механики для многих людей, и не будет преувеличением сказать, что все беды начались с Эрвина Шрёдингера.
Атомная модель характеристик Шредингера, постулаты
Атомная модель Шредингера Он был разработан Эрвином Шредингером в 1926 году. Это предложение называется квантово-механической моделью атома и описывает волновое поведение электрона..
Для этого выдающийся австрийский физик был основан на гипотезе Бройля, который заявил, что каждая движущаяся частица связана с волной и может вести себя так.
Шредингер предположил, что движение электронов в атоме соответствует дуальности волны и частицы, и, следовательно, электроны могут быть мобилизованы вокруг ядра в виде стоячих волн..
Шредингер, который был удостоен Нобелевской премии в 1933 году за вклад в атомную теорию, разработал одноименное уравнение для расчета вероятности того, что электрон окажется в определенной позиции..
- 1 Характеристики атомной модели Шредингера
- 2 Эксперимент
- 2.1 Эксперимент Юнга: первая демонстрация дуальности волны-частицы
- 2.2 Уравнение Шредингера
- 3 постулата
- 4 Статьи интересов
- 5 ссылок
Характеристики атомной модели Шредингера
-Описывает движение электронов как стоячих волн.
-Электроны движутся постоянно, то есть они не имеют фиксированного или определенного положения внутри атома.
-Эта модель не предсказывает местоположение электрона и не описывает маршрут, который он совершает внутри атома. Он только устанавливает зону вероятности для обнаружения электрона.
-Эти области вероятности называются атомными орбиталями. Орбитали описывают движение переноса вокруг ядра атома.
-Эти атомные орбитали имеют разные уровни и подуровни энергии и могут быть определены между электронными облаками.
-Модель не рассматривает стабильность ядра, а относится только к объяснению квантовой механики, связанной с движением электронов внутри атома..
эксперимент
Атомная модель Шредингера основана на гипотезе Бройля и предыдущих атомных моделях Бора и Зоммерфельда..
Для этого Шредингер опирался на эксперимент Юнга и на основе собственных наблюдений разработал математическое выражение, носящее его имя..
Следуя научным основам этой атомной модели:
Эксперимент Юнга: первая демонстрация волновой двойственности
Гипотеза Бройля о волнообразной и корпускулярной природе материи может быть продемонстрирована экспериментом Янга, также известным как эксперимент с двумя щелями..
Английский ученый Томас Янг заложил основы атомной модели Шредингера, когда в 1801 году он провел эксперимент, чтобы проверить волновую природу света.
Во время своих экспериментов Янг разделил излучение луча света, который проходит через небольшое отверстие через камеру наблюдения. Это разделение достигается за счет использования 0,2-миллиметровой карты, расположенной параллельно балке..
Дизайн эксперимента был сделан таким образом, чтобы луч света был шире, чем карточка, поэтому при размещении карточки горизонтально луч делился на две примерно равные части. Выход световых лучей направлялся зеркалом.
Оба луча света попали в стену темной комнаты. Там картина интерференции между обеими волнами была очевидна, с которой было продемонстрировано, что свет может вести себя так же, как частица, как волна.
Спустя столетие Альберт Эйнстен подкрепил идею принципами квантовой механики..
Уравнение Шредингера
Шредингер разработал две математические модели, дифференцируя происходящее в зависимости от того, изменяется ли квантовое состояние во времени или нет.
Для атомного анализа Шредингер опубликовал в конце 1926 года независимое от времени уравнение Шредингера, основанное на волновых функциях, которые ведут себя как стоячие волны..
Это означает, что волна не движется, ее узлы, то есть ее точки равновесия, служат опорой для остальной части структуры, чтобы двигаться вокруг них, описывая определенную частоту и амплитуду.
Шредингер определил волны, которые описывают электроны как стационарные или орбитальные состояния и связаны, в свою очередь, с различными уровнями энергии.
Уравнение Шредингера, не зависящее от времени, выглядит следующим образом:
Е: константа пропорциональности.
Ψ: волновая функция квантовой системы.
Η: Гамильтонов оператор.
Не зависящее от времени уравнение Шредингера используется, когда наблюдаемая, представляющая полную энергию системы, известную как гамильтонов оператор, не зависит от времени. Однако функция, которая описывает полное движение волны, всегда будет зависеть от времени.
Уравнение Шредингера показывает, что если у нас есть волновая функция Ψ и на нее действует гамильтонов оператор, константа пропорциональности E представляет полную энергию квантовой системы в одном из ее стационарных состояний.
Применительно к атомной модели Шредингера, если электрон движется в определенном пространстве, существуют дискретные значения энергии, и если электрон движется свободно в пространстве, существуют непрерывные интервалы энергии.
С математической точки зрения, есть несколько решений для уравнения Шредингера, каждое решение предполагает различное значение для константы пропорциональности E.
Согласно принципу неопределенности Гейзенберга, невозможно оценить положение или энергию электрона. Следовательно, ученые признают, что оценка местоположения электрона внутри атома является неточной.
постулаты
Постулаты атомной модели Шредингера таковы:
-Электроны ведут себя как стоячие волны, которые распределены в пространстве в соответствии с волновой функцией Ψ.
-Электроны движутся внутри атома при описании орбиталей. Это области, где вероятность обнаружения электрона значительно выше. Приведенная вероятность пропорциональна квадрату волновой функции Ψ 2 .
Электронная конфигурация атомной модели Шредингера объясняет периодические свойства атомов и связей, которые образуют.
Однако модель атома Шредингера не рассматривает спин электронов и не учитывает изменения поведения быстрых электронов из-за релятивистских эффектов..
http://elementy.ru/trefil/21/Uravnenie_Shryodingera
http://ru.thpanorama.com/articles/fsica/modelo-atmico-de-schrdinger-caractersticas-postulados.html