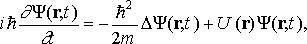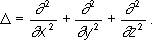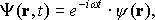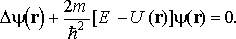5.3. Атом водорода
Стационарное уравнение Шредингера для водородоподобного атома (один электрон около ядра с зарядом Ze) имеет вид
Это уравнение удобно записать в сферических координатах:
Разумеется, мы не станем решать это уравнение, но просто внимательно на него посмотрим.
Заметим, что та часть уравнения (5.6), которая зависит от углов, входит только в состав оператора квадрата момента импульса (5.3). Довольно ясен физический смысл этого члена. Представим себе, что в поле центральных сил по орбите радиусом r движется классическая частица с импульсом 
где 

кинетическую энергию «ортогонального» движения. Ее можно выразить через квадрат момента количества движения:
Этот член добавляется к потенциальной энергии кулоновского притяжения к ядру, и его можно интерпретировать как потенциальную энергию в поле центробежных сил. Действительно, если 
В конечном выражении легко узнать известную из классической механики формулу для центробежной силы. Квантовая механика, как это и должно быть, воспроизводит на новом уровне результаты классической: теперь момент импульса стал оператором, но вошел на прежних правах в выражение для оператора полной энергии (гамильтониана).
Любой оператор коммутирует сам с собой, и так как оператор квадрата момента (5.3) вообще не зависит от радиальной переменной r, то
коммутирует с гамильтонианом (5.6). Кроме того, оператор проекции момента импульса
и, стало быть, с гамильтонианом. Следовательно, выполняются классические законы сохранения квадрата и одной проекции момента импульса. Эти законы сохранения справедливы для любого центрально-симметричного поля: специфика кулоновского взаимодействия пока нами не использовалась. Поэтому проекция и квадрат момента могут быть определены одновременно с энергией, и волновая функция стационарного состояния будет зависеть от квантовых чисел l и m. Однако в уравнении Шредингера (5.6) гамильтониан вовсе не зависит от оператора проекции момента импульса. Это значит, что энергия состояния не будет зависеть от магнитного квантового числа m. Иными словами, в любом центрально-симметричном поле имеется вырождение по n, кратность которого равна 21 + 1. Мы уже знаем, что источником вырождения должна служить та или иная симметрия. В классической физике движение частицы в центрально-симметричном поле всегда происходит по орбите, лежащей в одной плоскости. Но сама эта плоскость может быть произвольной в зависимости от начального положения и скорости частицы. Ясно, что значение полной энергии частицы не зависит при этом от ориентации плоскости орбиты в пространстве. Это и есть искомая симметрия, приводящая к вырождению по магнитному квантовому числу.
В кулоновском поле (равно как и в гравитационном) имеется еще одно специфическое вырождение, приводящее к тому, что энергия системы не зависит и от квантового числа l.
Вспомним опять классическую физику. В кулоновском поле финитное движение частицы совершается только по эллипсу. Возьмем в качестве аналогии искусственный спутник. Поместим его на каком-то расстоянии от Земли (то есть зададим потенциальную энергию) и придадим ему какую-то скорость (зададим кинетическую энергию). Таким образом, мы задали полную энергию спутника. Но определена ли его орбита? Разумеется, нет! При той же полной энергии направление скорости влияет на форму орбиты — от прямой линии (вертикальное падение) при нулевом моменте импульса до окружности максимально возможного радиуса при данной полной энергии. Нулевой момент соответствует чисто радиальным колебаниям сквозь центр притяжения, когда вовсе нет кругового движения, и эллипс вырождается в прямую линию (для спутника такое колебание невозможно, но микрочастицы — иное дело). Максимально возможный момент импульса достигается в обратном случае чисто круговой орбиты, когда совсем нет радиального движения. Важно, что его (максимального момента импульса) величина зависит от полной энергии спутника.
Подчеркнем, что ограничение сверху на возможную величину момента импульса 



Здесь 



или 
Эффективная потенциальная энергия при отличном от нуля моменте импульса L имеет минимум в точке 

Поскольку неравенство 


Если в последнее неравенство подставить боровское выражение (3.3) для энергии водородоподобного иона и выражение (5.5) для квадрата момента, то получим неравенство

которое имеет решение

Здесь n — боровский номер стационарной орбиты, или главное квантовое число (см. ниже). Основанная на решении уравнения Шредингера (5.6) строгая квантовая теория дает тот же результат.
Итак, классическая физика подсказывает нам следующие свойства решений уравнения Шредингера:
Вооружившись знанием классической механики, мы можем смело приступать к изучению квантовой. Теперь станут понятны свойства решений уравнения Шредингера для атома водорода. Его решениями являются волновые функции, нумеруемые тремя квантовыми числами: 


Рис. 5.6. Волновые функции трех первых состояний атома водорода с l = 0
Пример 1. Волновая функция основного состояния электрона в атоме водорода имеет вид
Найдем вероятности 



Вероятность обнаружить электрон в элементе объема dV равна
Так как волновая функция основного состояния не зависит от направления радиуса-вектора 


Теперь надо проинтегрировать вероятность 
Интеграл берется точно, и в результате получаем
Здесь e — основание натурального логарифма. Разность 




Иными словами, с вероятностью более 76% электрон в основном состоянии пребывает на расстоянии не более двух радиусов Бора от ядра.
Пример 2. Найдем электростатический потенциал, создаваемый атомом водорода в основном состоянии.
Возьмем любую точку на расстоянии R от ядра. Электростатический потенциал в ней создается, во-первых, положительным зарядом е ядра и, во-вторых, той частью заряда электрона, которая находится внутри сферы радиусом R. Хорошо известно, что сферически симметричное распределение заряда не создает поля во внутренних областях. Поэтому часть электронного облачка, находящаяся дальше выбранной точки, не внесет вклада в потенциал. Поскольку в уравнении (5.7) вычислена вероятность W(R) нахождения электрона внутри сферы радиусом R, то отрицательный заряд внутри этой сферы равен –eW(R). Поэтому потенциал в точке R, создаваемый эффективным зарядом
На больших расстояниях потенциал (5.8) убывает экспоненциально, то есть гораздо быстрее обычного кулоновского потенциала точечного заряда. Это — так называемый эффект экранировки: отрицательный заряд электрона компенсирует положительный заряд ядра. При
потенциал (5.8) переходит в обычный кулоновский потенциал: мы проникли внутрь электронного облачка, где оно уже не экранирует заряд ядра.
Для энергии из уравнения Шредингера получается в точности такая же формула, что и из теории Бора:
Как видно, энергия действительно не зависит от квантовых чисел l, m. При этом, как следует из свойств решений уравнения (5.6), азимутальное квантовое число l принимает целые значения от 0 до n – 1. И это свойство, угаданное нами на основе классической физики, воспроизвелось в квантовой механике.
Удивительно, как квантовая механика, низвергнувшая столько классических представлений, дает аналогичные результаты там, где в дело вступают свойства симметрии системы. Отсюда вывод: симметрия играет более важную роль, чем конкретные физические законы. Когда-нибудь будут открыты новые законы, которые обобщат и квантовую механику, и все теории, которые ныне находятся на переднем крае науки. Но свойства симметрии системы так или иначе проявят себя.
Отличие квантовой механики от теории Бора — более богатая структура состояний: состояние определяется тремя квантовыми числами, как и в трехмерном потенциальном ящике. Кстати, это не случайно. Три квантовых числа в потенциальной яме и в атоме водорода — отражение трехмерности нашего пространства. Подсчитаем кратность вырождения, то есть число различных состояний с одной и той же энергией (главным квантовым числом n). При данном значении n число l пробегает все целые числа от 0 до n – 1, и каждому из них соответствует 2l + 1 значение n. Поэтому кратность вырождения N определяется соотношением
При n = 1 имеем N = 1, то есть основной уровень не вырожден. При n=2 кратность вырождения равна 4: один уровень с l = 0 и три уровня с l = 1 и различными проекциями момента импульса n = –1, 0, +1. При n = 3 кратность вырождения N = 9: один уровень с l = 0, три уровня с l = 1 и пять уровней (по числу проекций) с l = 2. Для классификации состояний энергии по значению квантового числа l применяют условные обозначения, позаимствованные из спектроскопии, где они появились еще до создания теории атома:
Уравнение Шрёдингера для водородоподобных атомов. Распределение электронов по оболочкам и подоболочкам в атоме
Половинчатая, полуклассическая теория Бора явилась важным этапом в развитии квантовых представлений, введение которых в физику требовало кардинальной перестройки механики и электродинамики. Такая перестройка была осуществлена в 20-е – 30-е годы XX века.
Боровская модель атома позволила нам составить первое (хотя и довольно грубое) представление о строении атома. Она объяснила, почему атомы испускают и поглощают свет с дискретными длинами волн, и решила проблему стабильности атомов. Вычисленные в рамках боровской модели длины волн линейчатого спектра и энергии ионизации атома водорода и одноэлектронных ионов оказались в превосходном согласии с экспериментом. Но теория Бора имела и существенные ограничения. На её основе нельзя было предсказать линейчатые спектры более сложных атомов – даже нейтрального атома гелия всего лишь с двумя электронами. Теория Бора не смогла объяснить, почему линии испускания при более детальном изучении оказались состоящими из двух или большего числа очень близких линий (так называемая тонкая структура). Теория Боране смогла также объяснить, почему одни спектральные линии ярче других. Не получили объяснения и межатомные связи в молекулах, твёрдых телах и жидкостях. Представление Бора об определенных орбитах, по которым движутся электроны в атоме, оказалось весьма условным. На самом деле движение электрона в атоме очень мало похоже на движение планет или спутников. Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ| 2. Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шрёдингера.
Общее уравнение Шрёдингера:
здесь i — мнимая единица; m — масса частицы; r — радиус-вектор, определяющий ее положение; ∆ — оператор Лапласа, который в прямоугольной декартовой системе координат записывается в виде
Для любого стационарного состояния волновую функцию можно записать в виде
где функция зависит только от координат частицы; w — вещественный параметр (частота волновой функции).
Стационарное уравнение Шрёдингера
Волновая функция, входящая в это уравнение, описывает состояние микрочастицы в стационарных состояниях.
Чтобы решить волновое уравнение, надо разделить его переменные. Для этого заменяют декартовы координаты x, y, z на сферические r, θ, φ. Тогда волновую функцию можно представить в виде произведения трех функций, каждая из которых содержит только одну переменную:
Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) — её угловыми составляющими.
В сферической системе координат уравнение Шрёдингера преобразуется к виду:
, 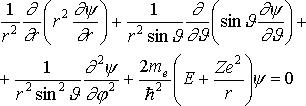
где Θ и φ — полярный и азимутальный углы соответственно.
В ходе решения волнового уравнения вводятся целые числа — так называемые квантовые числа (главное n, орбитальное 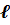
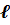
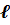
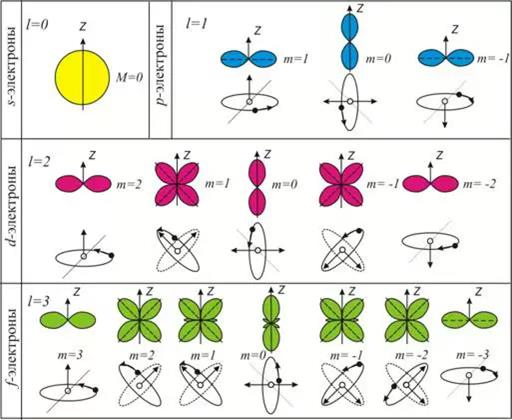
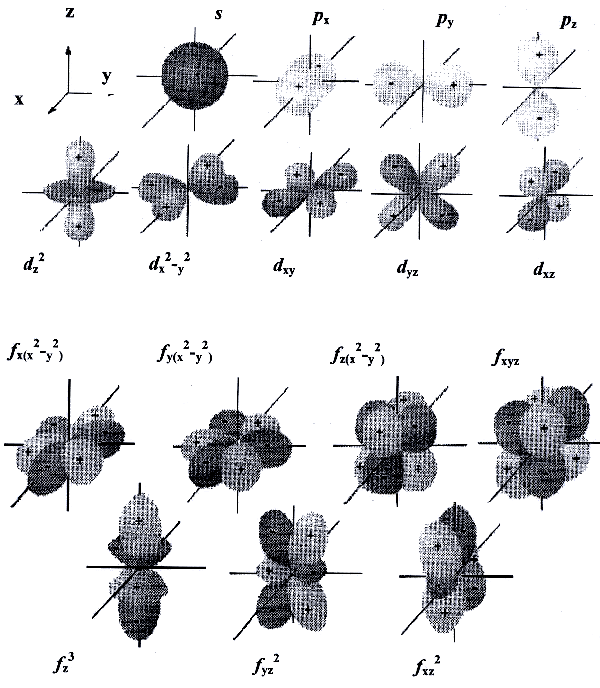
Геометрическим образом одноэлектронной волновой функции является атомная орбиталь. Она представляет собой область пространства вокруг ядра атома, в которой высока вероятность обнаружения электрона (обычно выбирают значение вероятности 90-95%). Это слово происходит от латинского «орбита» (путь, колея), но имеет другой смысл, не совпадающий с понятием траектории (пути) электрона вокруг атома, предложенным Н. Бором для планетарной модели атома. Контуры атомной орбитали — это графическое отображение волновой функции, полученной при решении волнового уравнения для одного электрона.
Квантовые числа
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трёх квантовых чисел: главного n, орбитального 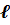
Главное квантовое число n определяет квантование энергии атома (см. ф.2)
Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода даёт следующее выражение для энергии электрона:
E = −2π 2 me 4 / n 2 h 2 = −1312,1 / n 2 (кДж/моль) 
Таким образом, каждому значению главного квантового числа отвечает определённое значение энергии электрона. Уровни энергии с определёнными значениями n иногда обозначают буквами K, L, M, N. (для n = 1, 2, 3, 4. ).
Для E 2 обнаружения электрона в различных точках пространства («электронное облако»).
Состояния, в которых орбитальное квантовое число 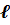

Состояния с 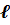
с 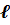
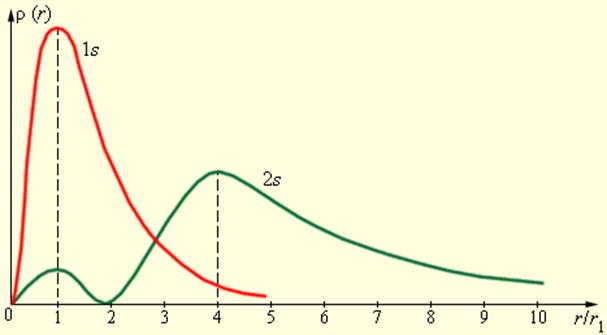
На рис. 1 изображены кривые распределения вероятности ρ (r) = 4πr 2 |Ψ| 2 обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях 1s и 2s.
Рисунок 1. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. r1 = 5,29·10 –11 м – радиус первой боровской орбиты
Как видно из рис. 1, электрон в состоянии 1s (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу r1 первой боровской орбиты. Вероятность обнаружения электрона в состоянии 2s максимальна на расстоянии r = 4r1 от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро.
Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью. Вид основных типов орбиталей показан на рис.2.
Электрон, занимающий определённую орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь. и четвёртым квантовым числом (спиновым) ms, которое характеризует спин электрона — одно из свойств (наряду с массой и зарядом) этой элементарной частицы.
СПИН
В 1925 году Гоуделлит и Уленбек выдвинули предположение, что еще одно квантовое число s, которое должно определять различие двух состояний при одинаковых значениях n и l может быть связано с вращением электрона вокруг своей оси. Действительно если электрон вращается вокруг своей оси, то он должен обладать механическим моментом количества движения s и (поскольку он имеет электрический заряд) магнитным моментом Pm.Этот собственный момент количества движения Ps получил название спина электрона.
Подобно тому, как орбитальный момент может располагаться под 2l+1 различными углами к выбранной за преимущественное направление координатной оси, а его проекции на это направление могут быть только кратны ћ, спин электрона должен располагаться под 2s+1 углами к этой координатной оси (например OZ).
Его величина 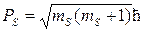
то есть 
За преимущественное направление у координатных осей при определении ориентации спина логично принять направление магнитного поля, образуемого за счет орбитального движения электрона, поскольку наличие этого поля должно (даже в отсутствие внешнего магнитного поля) приводить к расщеплению характеризующихся данными значениями квантовых чисел n, l уровней на 2s+1 подуровней.
Для объяснения расщепления каждого уровня на 2 подуровня следует, очевидно, записать равенство 2mS+1=2, то есть принять, что спиновое квантовое число имеет полуцелое значение mS = ½.При этом величина спина оказывается равной 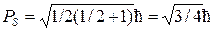
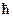
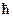

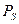
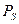
Спин — собственный магнитный момент количества движения элементарной частицы.Хотя это слово по-английски означает «вращение», спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
| | | следующая лекция ==> |
| | | Физические основы вакуумной и плазменной электроники |
Дата добавления: 2017-01-26 ; просмотров: 2656 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://poznayka.org/s84301t1.html