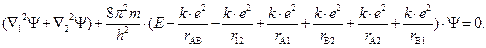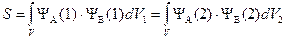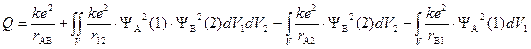Метод валентных связей (ВС)
Основы метода ВС разработали в 1927 г. Вальтер Гайтлер (Heitler) и Фриц Лондон (London). Модельной частицей для этого метода является молекула водорода Н2. При построении волновой функции молекулы в методе валентных связей считается, что: 1)атомы в молекуле сохраняют свою индивидуальность – каждый электрон принадлежит ядру своего атома, 2) известны волновые функции электронов атома А (YА) и атома В (YВ) –атомные орбитали, 3) считается, что частицы (электроны и ядра атомов) неразличимы.
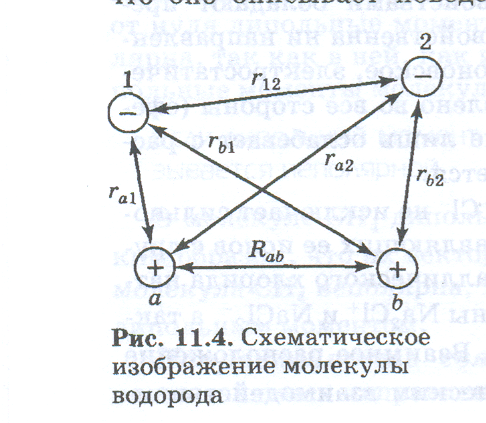
Уравнение Шрёдингера для молекулы водорода. Составим уравнение Шрёдингера для молекулы водорода. Входящая в него потенциальная энергия включает в себя сумму энергий электростатического взаимодействия всех частиц между собой (двух электронов -e и двух ядер +e). Из рис. 3.3 видно, что суммарная потенциальная энергия складывается из двух положительных членов: энергии отталкивания электронов и ядер между собой и четырех отрицательных – энергий притяжения электронов к ядрам:
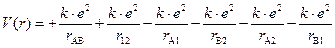

Рис. 3‑3 Схема электростатического взаимодействия электронов и ядер в молекуле водорода
Таким образом, уравнение Шрёдингера для молекулы водорода имеет вид
Аналитическое решение данного уравнения практически невозможно, поэтому нахождение энергии химической связи DE(r) и волновой функции электронов, показывающей распределение электронной плотности в молекуле, производят приближенным методом.
Функция первого приближения. Поскольку вероятность нахождения электрона в элементарном объеме пропорциональна Y-функции, а по условиям метода ВС атомы при образовании связи сохраняют свои атомные орбитали, то в первом приближении функция, описывающая состояние электронов в молекуле водорода, может быть представлена как произведение волновых функций электронов в отдельных изолированных атомах водорода:
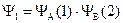
где Y1 – функция, описывающая состояния электронов в молекуле водорода; YА(1) – функция, описывающая состояния электрона 1, принадлежащего атому А (Y1s – функция основного состояния атома водорода); YВ(2) функция, описывающая состояния электрона 2, принадлежащего атому В (Y1s).
Поскольку электроны и ядра атомов принципиально неразличимы, то безразлично, какой из них будет находиться у определенного ядра. Поэтому необходимо составить и вторую функцию:
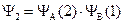
Первая функция рассматривает 1 электрон как принадлежащий атому А, а 2 – атому В, вторая функция, наоборот, считает, что 2 электрон принадлежит атому А, а 1 – атому В. Обе функции являются решениями уравнения Шрёдингера. Для простоты изложения нормировочные множители приняты равными единице.
Расчет с использованием этих функций качественно правильно описывал молекулу водорода, но величины энергии и длины связи сильно отличались от величин, определенных экспериментально.
Более точным приближением к истинной волновой функции явилась линейная комбинация первой и второй функции:
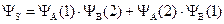
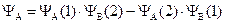
Физический смысл этих двух функций заключается в следующем: YS – симметричная функция – соответствует случаю, когда электроны в молекуле водорода имеют разные по знаку значения спинового квантового числа, – спины электронов антипараллельны. YА – антисимметричная функция – описывает состояние, когда оба электрона имеют одинаковое значение спинового числа – спины электронов параллельны.
Изменение энергии системы двух взаимодействующих атомов водорода описывается выражением
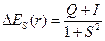
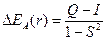
Q – «кулоновский интеграл», характеризующий изменение энергии системы вследствие электростатического взаимодействия электронов и ядер между собой. I – «обменный интеграл», интеграл, характеризующий понижение энергии системы вследствие неразличимости электронов; S – «интеграл перекрывания», характеризующий изменение энергии системы вследствие перекрывания атомных орбиталей.
Для выяснения физического смысла этих интегралов проанализируем их выражения.
характеризует область пространства перекрывания атомных орбиталей.
показывает изменение энергии системы в результате отталкивания ядер друг от друга (первый член суммы), электронов (второй член) и притяжения электронов к ядрам «несвоего атома» (третий и четвертый члены). Последние два интеграла равны между собой, поскольку атомы одинаковы. Физический смысл интегралов очевиден: yi 2 dVj – вероятность нахождения j-электрона в элементарном объеме пространства, e×yi 2 dVj – величина заряда. Согласно закону Кулона энергия электростатического взаимодействия прямо пропорциональна произведению величины зарядов и обратно пропорциональна расстоянию между ними.
Энергия притяжения электронов к ядрам «своего атома» – энергия невзаимодействующих атомов (E0) – в энергии химической связи не учитывается (полная энергия молекулы водорода E = 2×E0+DE(r)).
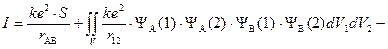
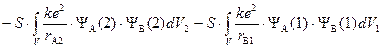
S – «интеграл перекрывания».
«Обменный интеграл» похож на «кулоновский», но вместо квадрата волновой функции для данного электрона стоит произведение волновых функций разных атомов, что придает ему достаточно абстрактный характер — «неклассическое электростатическое взаимодействие». Энергия системы изменяется вследствие неразличимости электронов, то есть возможность замены одного электрона на другой приводит к изменению энергии системы.
На расстояниях r®¥ кулоновский, обменный интегралы и интеграл перекрывания стремятся к нулю: Q®0, I®0 и S®0. На расстояниях, близких к длине связи, кулоновский и обменный интегралы отрицательны Q
Дата добавления: 2017-02-20 ; просмотров: 702 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Метод валентных связей
Основные положения метода валентных связей.В. Гейтлер и Ф. Лондон в 1927 г. впервые нашли приближенное решение уравнения Шрёдингера для молекулы Н2. Позднее Л. Полинг, Дж. Слейтер и другие распространили этот метод на более сложные молекулы.
Отличие уравнения Шрёдингера для молекулы водорода от уравнения Шрёдингера для атома водорода состоит в том, что оно описывает поведение сразу двух электронов, которые находятся в поле двух протонов ядер (нарисовать рисунок), а не одного электрона в поле одного ядра, как это было у атома водорода. При этом поведение двух электронов описывается одной общей для них волновой функцией Ѱ. Потенциальная энергия Еп суммируется из шести слагаемых, четыре из которых характеризуют электростатическое взаимодействие противоположно заряженных частиц — взаимное притяжение, а два других — взаимное отталкивание частиц с одинаковым знаком заряда:
Как и для атомов, каждое из решений уравнения Шрёдингера должно состоять из волновой функции Ѱ и полной энергии Е и определяться набором квантовых чисел. Однако даже для такой простой системы, какой является молекула водорода, чисто математическое решение уравнения Шрёдингера невозможно. Поэтому решают уравнение Шрёдингера путем подбора такой волновой функции, при подстановке которой в уравнение получаются значения энергии связи Еса и равновесного межъядерного расстояния d0, точно соответствующие экспериментальным значениям этих величин. Величины Есв и d0 можно определить, например, из спектров молекулы Н2.
В. Гейтлер и Ф. Лондон предложили использовать в качестве приближенной общей волновой функции двух электронов молекулы Н2 линейную комбинацию (т. е. сумму или разность) произведений волновых функций двух атомов водорода:
Оба произведения включают в себя волновые функции двух независимых атомов водорода. Волновые функции Ѱa(1) и Ѱb(2), входящие в первое произведение, описывают ситуацию, когда электрон 1 принадлежит только ядру а, а электрон 2 — только ядру Ь. Волновые функции Ѱa(2) и Ѱb(1) получаются в результате так называемого электронного обмена, т. е. они означают, что электрон 2 полностью переходит к ядру а, а электрон 1 наоборот — к ядру Ь. Каждое из произведений в правой части уравнения в отдельности не отражает реального состояния электронов в системе из двух сблизившихся атомов водорода. Так как различить электроны невозможно, в молекуле водорода вообще нельзя определить, какому же из двух ядер принадлежит каждый из электронов: оба электрона в равной мере принадлежат обоим ядрам. Это обобществление электронов в молекуле водорода и отражает волновая функция Гейтлера и Лондона.
Выражение для Ѱ равноценно двум волновым функциям: Ѱs, называемой симметричной, так как она не изменяется при замене электрона 1 на электрон 2, и ѰA, называемой антисимметричной, так как она при такой замене меняет свой знак:
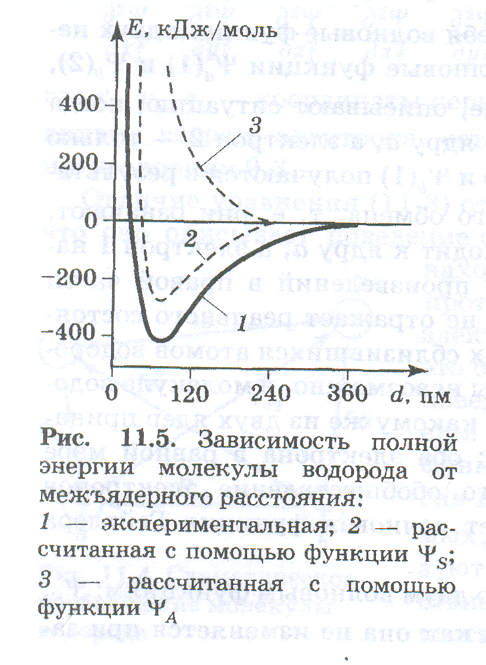
Решение уравнения Шредингера для молекулы водорода с использованием волновой функции ѰS приводит к получению зависимости полной энергии системы из двух атомов водорода от расстояния между ними. Эта зависимость изображена на рис.(нарисовать рисунок) кривой 2, Минимум этой кривой означает уменьшение полной энергии системы при сближении атомов, т. е. образование химической связи. Рассчитанные с помощью волновой функции ѰS энергия связи и равновесное межъядерное расстояние довольно хорошо согласуются с экспериментальными данными.
Волновая функция ѰS, общая для двух электронов, описывает электронную пару, В соответствии с принципом Паули эти электроны различаются значениями спиновых квантовых чисел, так как три других квантовых числа для одной и той же волновой функции совпадают. Отсюда можносделать вывод: образование химической связи за счет спаривания электронов возможно только тогда, когда взаимодействующие электроны имеют антипараллельные спины.
Позже для расчета молекулы водорода были использованы волновые функции, состоящие из нескольких десятков членов, посредством которых удалось гораздо точнее описать электронное облако молекулы Н2. Одновременно было достигнуто весьма хорошее совпадение расчетных и экспериментальных значений энергии и длины связи в этой молекуле, но главными слагаемыми Ѱs в улучшенных расчетах неизменно остаются Ѱa(1)Ѱb(2)+Ѱa(2)Ѱb(1),предложенные Гейтлером и Лондоном и символизирующие электронную пару.
Зависимость полной энергии системы от межъядерного расстояния, полученная при использовании волновой функции ѰA, изображена на рис. кривой 3. На этой кривой отсутствует минимум. Это означает, что химическая связь образоваться не может, так как между атомами действуют только силы отталкивания. Волновая функция ѰA описывает систему из двух электронов с параллельными спинами. В соответствии с принципом Паули такая система не может быть устойчивой, электронные облака не перекрываются, а, наоборот, отталкиваются одно от другого.
Метод, использованный для расчета молекулы водорода, явился обоснованием метода валентных связей. Основные положения метода валентных связей можно сформулировать следующим образом.
• Одинарная ковалентная химическая связь между двумя атомами образуется обобществленной электронной парой. Электронная пара — это два электрона, имеющие общую волновую функцию и отличающиеся значениями спинового квантового числа.
• Связывающая электронная пара образуется при обобществлении, «перекрывании» орбиталей двух взаимодействующих атомов. Перекрываться могут только орбитали валентных электронных уровней. Перекрывание атомных орбиталей приводит к образованию связи только при совпадении знаков волновых функций для перекрывающихся частей орбиталей. Электронные остовы атомов участия в образовании связи не принимают.
Уменьшение энергии системы при образовании ковалентной химической связи вызвано действием сил электрической природы: остовы взаимодействующих атомов притягиваются к зоне повышенной электронной плотности, которая возникает в пространстве между ядрами при перекрывании электронных орбиталей. Чем больше перекрываются орбитали, тем прочнее связь и тем она короче.
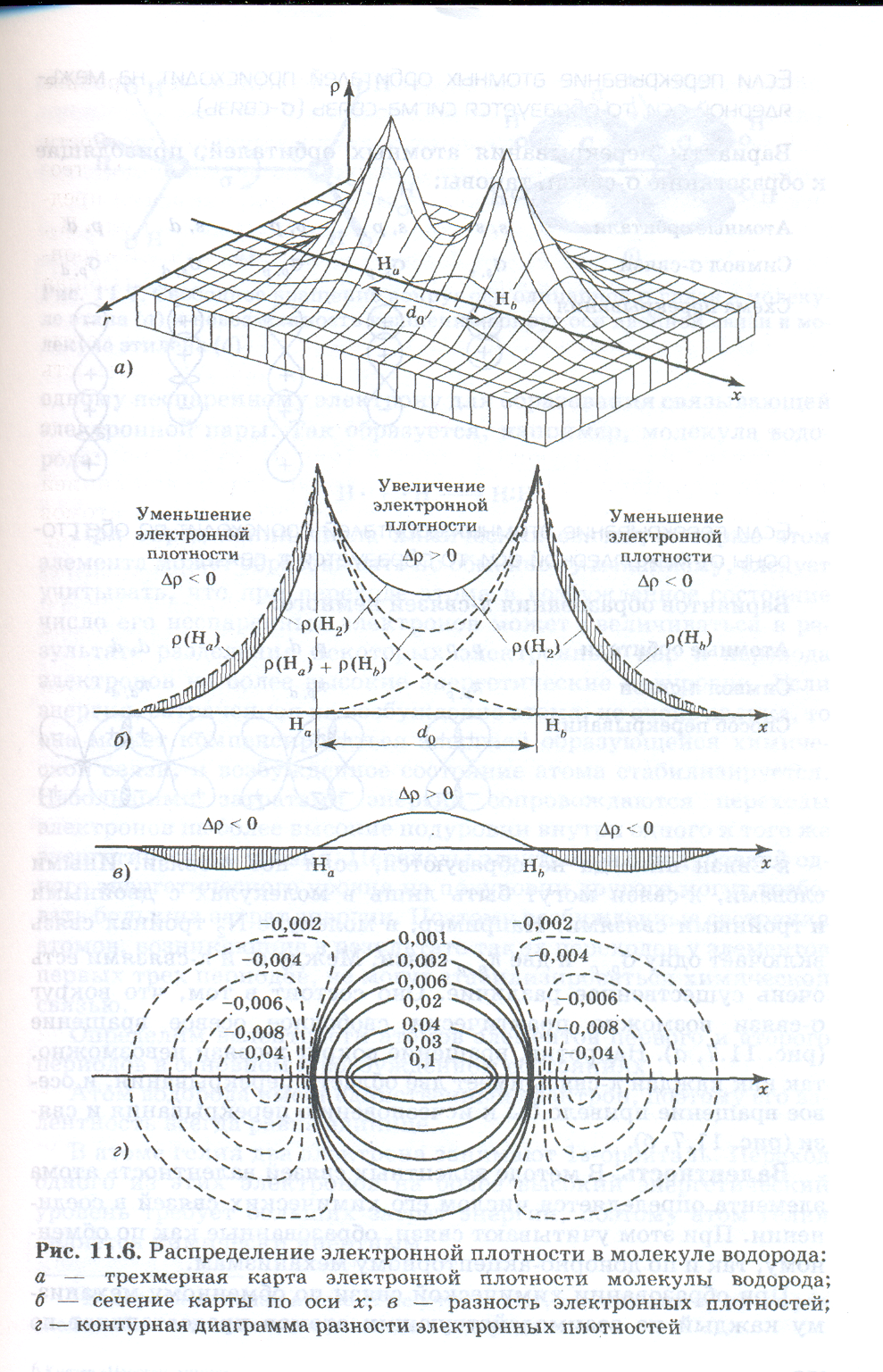
Молекула водорода. Распределение электронной плотности в молекуле водорода имеет принципиальное значение для теории ковалентной связи. На рис. (показать рисунок) четырьмя способами представлены результаты точных квантовых расчетов молекулы Н2. Рис. а — это трехмерная карта распределения электронной плотности ρ в координатах х, r, где х — ось, соединяющая ядра атомов водорода, r — расстояние от этой оси.
На рис. б показано вертикальное сечение этой карты по оси х. Сплошная линия изображает электронную плотность молекулы водорода ρ(Н2), а штриховые линии слева и справа от ядер атомов — электронные плотности ρ(Нa) и ρ(Нb) каждого из атомов, не образующих друг с другом связь, но сблизившихся на длину связи d0. Между ядрами штриховой линией показана сумма электронных плотностей несвязанных атомов
ρ(На) + ρ(Нb). В средней точке связи электронная плотность молекулы ρ(Н2) существенно больше, чем сумма плотностей несвязанных атомов. Это говорит о том, что при образовании химической связи возникает область повышенной электронной плотности между ядрами атомов,
На рис. в изображена разность электронных плотностей молекулы водорода и несвязанных атомов Δρ =ρ(Н2) — [ρ(На) + ρ(Нb)]. Эта кривая наглядно показывает, что между ядрами возникает избыток, сгущение электронной плотности, а с обеих сторон от ядер электронная плотность уменьшается.
На рис. г разность электронных плотностей передана в виде контурной диаграммы. Здесь линии соединяют точки с равными значениями Δρ. Сплошные линии соответствуют положительным значениям Δρ: они охватывают область сгущения электронного облака. Штриховые линии отвечают отрицательным значениям Δρ: они показывают, где электронная плотность в молекуле меньше, чем в несвязанных атомах.
Рис. наглядно показывает, что физическая причина электростатического стягивания ядер двух атомов водорода и образования ковалентной связи Н —Н заключается в убыли электронной плотности по обеим сторонам от ядер и ее увеличение в области между ядрами. Любая другая одинарная ковалентная связь имеет аналогичную картину распределения электронной плотности.
Кратныесвязи. Если два атома обобществляют две или три электронные пары, то образуется кратная (двойная или тройная) связь. При образовании кратных связей электронные облака могут перекрываться разными способами.
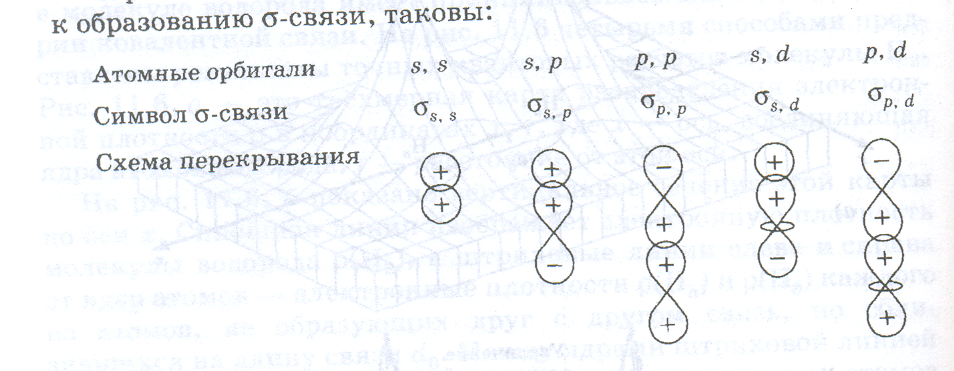
Если перекрытие атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь (σ-связь).
Варианты перекрывания атомных орбиталей, приводящих к образованию σ-связи , таковы:
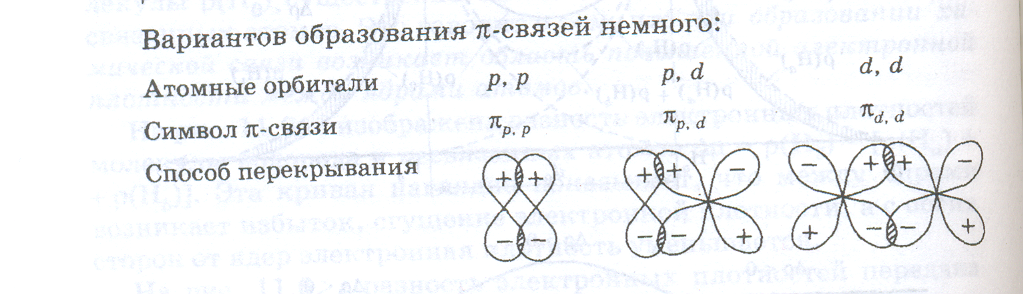
Если перекрытие атомных орбиталей происходит по обе стороны от межъядерной оси, то образуется пи-связь (π-связь).
Вариантов образования π-связей немного:
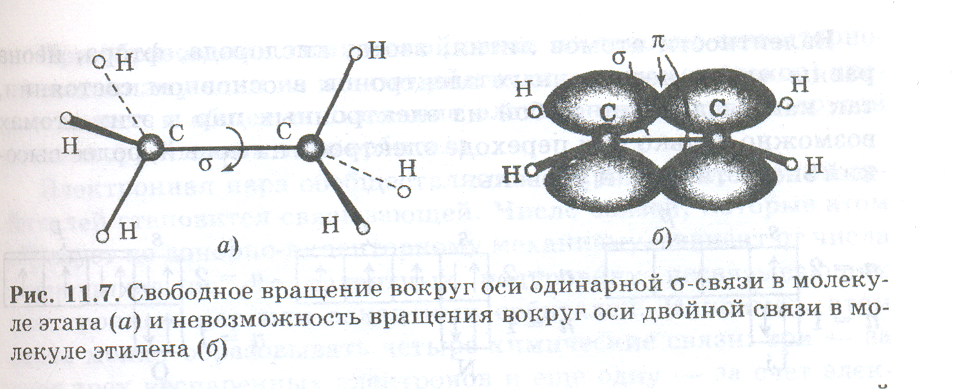
π-связи никогда не образуются, если нет σ-связи. Иными словами, π-связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну σpp — и две πpp -связи. Между σ- и π-связями есть очень существенное различие. Оно состоит в том, что вокруг σ -связи возможно практически свободное осевое вращение (нарисовать рисунок, а). Напротив, вращение вокруг π-связи невозможно, так как каждая π-связь имеет две области перекрывания, и осевое вращение привело бы к исчезновению перекрывания и связи (нарисовать рисунок, б).
Валентность.В методе валентных связей валентность атома элемента определяется числом его химических связей в соединении. При этом учитывают связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов предоставляет по
одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода:
При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбужденное состояние число его неспаренных электронов может увеличиваться в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбужденное состояние атома стабилизируется. Небольшими затратами энергии сопровождаются переходы электронов на более высокие подуровни внутри одного и того же энергетического уровня. Переходы электронов с подуровней одного энергетического уровня на подуровни другого могут требовать больших затрат энергии. Поэтому возбужденные состояния атомов, возникающие в результате таких переходов у элементов первых трех периодов, не могут стабилизироваться химической связью.
Определим валентности атомов элементов первого и второго периодов в основном и возбужденном состояниях.
Атом водорода имеет единственный электрон, поэтому его валентность всегда равна единице.
В атоме гелия два электрона занимают 1s-орбиталь. Переход одного из этих электронов на более высокий энергетический уровень требует больших затрат энергии, поэтому атом гелия является химически инертным.
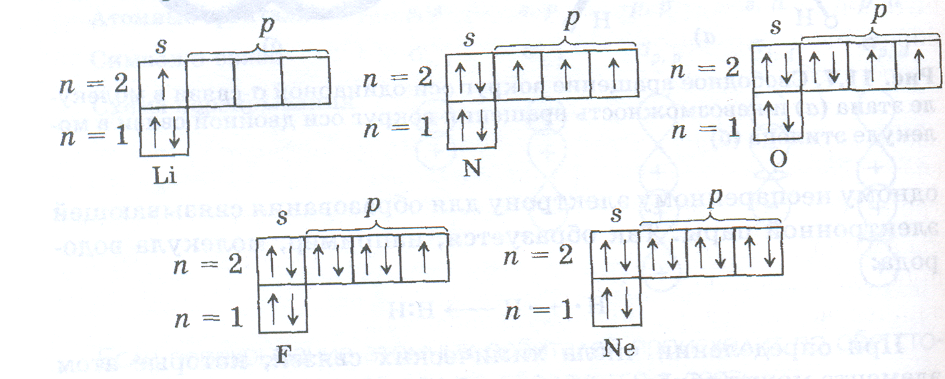
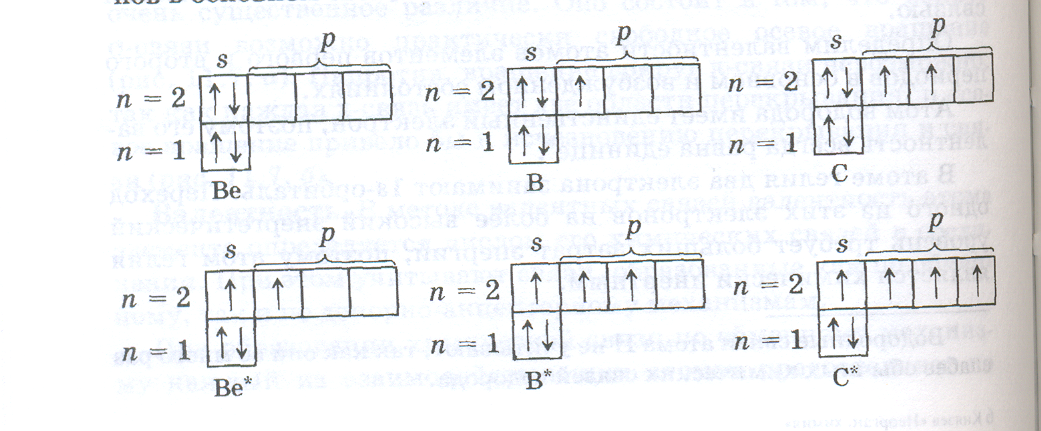
Валентности атомов лития, азота, кислорода, фтора, неона равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электрона на новый, более высокий энергетический уровень:
Из приведенных электронно-структурных формул видно, что валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0. В атомах бериллия, бора, углерода может происходить разделение электронных пар за счет перехода электронов с 2s-подуровня на 2р-подуровень, так как в атомах этих элементов на 2р-подуровне имеются вакантные орбитали. Такой переход на более высокий энергетический подуровень внутри данного энергетического уровня не требует больших затрат энергии, может быть скомпенсирован за счет образования химической связи и осуществляется в условиях обычных химических реакций. Поэтому валентности 2, 3 и 4, присущие атомам Ве, В, С, в возбужденном состоянии более характерны для этих элементов, чем валентности, определяемые числом неспаренных р-электронов в основном состоянии:
При образовании химической связи по донорно-акцепторному механизму один из взаимодействующих атомов (донор) предоставляет в общее пользование электронную пару, а другой (акцептор) — вакантную орбиталь.
Электронная пара обобществляется и при перекрывании орбиталей становится связывающей. Число связей, которые атом образует по донорно- акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три — за счет трех неспаренных электронов и еще одну — за счет электронной пары. Так образуется катион аммония NH4 + из молекулы аммиака, в которой донорный атом азота имеет несвязывающую электронную пару, и катиона водорода, предоставляющего в качестве акцептора свободную орбиталь:
Атом бора образует молекулу фторида бора ВF3 за счет перекрывания электронных орбиталей, занятых в возбужденном состоянии неспаренными электронами, с электронными орбиталями фтора. При этом у атома бора сохраняется одна вакантная орбиталь, за счет которой по донорно-акцепторному механизму может образоваться четвертая химическая связь:
Лекция №1. Квантов0механическ0е обоснование теории строения молекул и химической связи. Строение атома (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Из различных методов определения СЭ наиболее прямой и точный — измерение минимальной энергии фотоотрыва электрона от отрицательного иона.
Для большинства атомов присоединение электрона — экзотермический процесс. Наиболее высоким по абсолютной величине сродством к электрону обладают атомы галогенов в последовательности Cl > F > Вг > I. Энергии ионизации и сродство к электрону молекул определяют также, как это сделано для атома.
ТЕОРЕТИЧЕСКИЕ МЕТОДЫ, ПРИМЕНЯЕМЫЕ ПРИ ИЗУЧЕНИИ СТРОЕНИЯ МОЛЕКУЛ И ХИМИЧЕСКОЙ СВЯЗИ
1. Молекула. Потенциальная поверхность. Равновесная конфигурация
2. Теория химической связи и её задачи.
3. Вариационный метод решения уравнения Шрёдингера.
§1. Молекула. Потенциальная поверхность. Равновесная конфгурация.
В химии молекулой называют наименьшую частицу данного вещества, обладающую его химическими свойствами, способную к самостоятельному существованию. Если отвлечься от поступательного движения молекулы как целого, то в ее энергию вносят вклад три вида движения: 1) движение электронов в поле ядер, 2) колебание ядер около положения равновесия и вращение молекулы вокруг оси, проходящей через центр масс, причем Еэл >> Екол >>Евр.
Хотя эти движения взаимосвязаны, можно приближенно рассматривать их как независимые и считать энергию молекулы равной сумме электронной, колебательной и вращательной энергий:
Е = Еэл + Екол +Евр. (6.1)
Волновая функция молекулы в этом приближении равна произведению функций, описывающих указанные три вида движения:

Остановимся на наиболее важной составляющей энергии молекулы — электронной энергии. Так как скорость тяжелых ядер во много раз меньше скорости легких электронов, приближенно можно рассматривать движение электронов в молекуле в каждый данный момент, считая ядра неподвижными (приближение Борна — Оппенгеймера). Выбранному фиксированному положению ядер R отвечает определенная энергия электронов 







При сближении ядер электронная энергия 

Данная потенциальная кривая соответствует классическим представлениям. Однако в нее надо внести поправки, так как равновесное состояние неосуществимо с точки зрения квантовой механики: в этом состоянии ядра неподвижны, значит, одновременно точно определены координата (R = rе) и импульс (р = 0), что противоречит соотношению неопределенностей Гейзенберга. Параметры rе и De (рис. 6.1) относятся таким образом к гипотетическому равновесному состоянию. В действительности даже и при 0К ядра не зафиксированы при R — rе, а совершают колебания около положения равновесия. Реальная энергия молекулы при этом выше, чем предполагалась, на величину энергии «нулевых колебаний» 
Определяемая на опыте энергия диссоциации молекулы D0 отсчитывается не от минимума потенциальной кривой как De, а от уровня нулевых колебаний (рис.и связана с De соотношением

Энергия диссоциации D0, служит мерой прочности химической связи и определяется как изменение энергии в процессе — АВ = А + В при 0 К в идеально-газовом состоянии. Если специальных указаний нет, то понимается, что как молекула АВ, так и атомы А и В находятся в основном электронном состоянии. Это определение сохраняет силу и для многоатомных молекул. Например, для молекулы AmBn энергией диссоциации будет изменение энергии в процессе AmBn = mA + nB.
Потенциальная поверхность. Равновесная конфигурация. При описании потенциальной кривой вместо Eэл. мол обычно используют символ E(R) или Е. Для многоатомной молекулы Е является функцией уже не одной, а нескольких пространственных координат Rij. Например, потенциальная энергия молекулы ABC является функцией трех независимых координат — R1(A — В), R2(B — С) и угла о(АВС) или расстояний R1(A — В), R2(B — С) и R3(А — С).
Для линейной молекулы с фиксированным углом α- 180° эта функция изобразится поверхностью в трехмерном пространстве (потенциальная поверхность) Устойчивому состоянию молекулы отвечает минимальное значение ее энергии E(АВС) и определенное относительное расположение ядер в пространстве, называемое равновесной конфигурацией молекулы с параметрами rе(А — В) и rе(В — С). Глубина потенциальной ямы определяет энергию химической связи De и по формуле (5.4) энергию диссоциации молекулы D0.
Для более сложной молекулы, чем линейная ABC, равновесная конфигурация и энергия равновесного состояния определяются положением минимума на потенциальной поверхности в многомерном пространстве. Если потенциальная поверхность имеет два (или более) минимума, для молекулы возможны два изомера или более, отличающиеся параметрами равновесной конфигурации и энергией. Если минимума на потенциальной поверхности нет, данная система нестабильна, при любом расположении ядер она распадается на невзаимодействующие атомы.
Так же как и атом, молекулу можно перевести в возбужденные электронные состояния (энергия возбуждения Те), каждому из которых отвечает своя потенциальная поверхность или кривая (кривая б на рис. 6.1).
Рассмотрев потенциальную кривую (поверхность), можно дать еще одно определение молекулы молекула — физически устойчивая система, состоящая из двух (или более) ядер и определенного числа электронов, состояние которой описывается потенциальной кривой (поверхностью) с минимумом.
Говоря о физической устойчивости, понимают, что соединение атомов в молекулу сопровождается понижением энергии системы. Данным здесь определением охватываются кроме обычных молекул (Н2, СН4 и др.) также радикалы (СН, ОН, СН3 и др.) и молекулярные ионы (Н+, O2— и др.). Этому отвечает одинаковый подход теории строения к изучению перечисленных типов частиц. В тех случаях, когда молекулы одноатомны (благородные газы, пары металлов), сохраняет силу аналогичное определение для атома.
Равновесная конфигурация предполагает жесткую фиксацию всех межъядерных расстояний в молекуле. Однако реальная молекула не является жесткой системой. Вместе с тем у огромного большинства молекул амплитуды колебаний ядер весьма малы по сравнению с межъядерными расстояниями и можно, пренебрегая колебаниями, рассматривать молекулы как жесткие системы («квазижесткие» или «квазитвердые» молекулы).
Равновесные конфигурации молекул принято относить к тем или иным точечным группам симметрии.
Двухатомные молекулы подразделяются на молекулы с одинаковыми ядрами, или гомонуклеарные (например, Н2), и с неодинаковыми ядрами, или гетеронуклеарные (например, HCI). Свойства симметрии их различны.
Симметрия равновесной конфигурации определяет и симметрию электронного облака молекулы. В связи с этим гомонуклеарные и гетеронуклеарные молекулы различаются по электрическим и оптическим свойствам, таким, как дипольный момент, поляризуемость и магнитная восприимчивость, правила отбора в спектрах. То же относится и к многоатомным молекулам, различающимся по симметрии, как, например, СН4 и СН3С1.
Рассмотренные молекулярные параметры: энергия диссоциации, межъядерные расстояния, равновесная конфигурация важны для химии не только как индивидуальные характеристики молекул. По ним можно рассчитать термодинамические свойства веществ и константы равновесия химических реакций.
§2. Теория химической связи и ее задачи. Уравнение Шредингера для молекул
Взаимодействие атомов, приводящее к образованию молекул простых и сложных веществ, а также кристаллов, называют химической связью. Взаимодействие атомов многообразно, поэтому многообразны и химические связи, которые часто сводят к нескольким основным типам: ковалентной, ионной, донорно-акцепторной, водородной связи и др. Однако все эти взаимодействия можно описать с позиций единой теории химической связи.
1) Эта теория призвана объяснить, какие силы действуют между атомами, как атомы объединяются в молекулы, что обеспечивает устойчивость образовавшейся сложной частицы (то же относится к кристаллам, жидкостям и другим телам).
2) Теория должна объяснить опытные факты, лежащие в основе классического понятия валентности, и наряду с этим существование и устойчивость многочисленных соединений, не укладывающихся в привычные рамки классических структурно-химических представлений.
3) Теория должна разработать единые методы расчета молекулярных параметров, интерпретировать молекулярные спектры.
4) Наконец, теория должна сделать возможным априорный расчет скорости химического процесса, зависимости ее от строения молекул реагирующих веществ.
 |
Современная теория химической связи, теория строения молекул и кристаллов базируется на квантовой механике: молекулы, как и атомы, построены из ядер и электронов, и теория химической связи должна учитывать корпускулярно-волновой дуализм микрочастиц. До применения методов квантовой механики к химии не удавалось создать непротиворечивую теорию химической связи.
Её фундамент был заложен в 1927 г. Гейтлером и Лондоном. Выполнив на основе квантовой механики расчет свойств молекулы водорода, они показали, что природа химической связи электрическая, никаких особых сил химического взаимодействия не существует. Действующие в молекуле между ядрами и электронами гравитационные и магнитные силы пренебрежимо малы по сравнению с электрическими силами.
Квантовомеханический подход к исследованию строения атома и молекулы один и тот же: нужно составить и решить уравнение Шредингера для системы из электронов и ядер и дать физическую интерпретацию полученным решениям. Составляя уравнение Шрёдингера для электронной энергии молекулы в приближении Борна — Оппенгеймера, считают ядра неподвижными.
Следовательно, электронная энергия для молекулы не зависит от координат ядер, а только от фиксированного расстояния R между ними (рис. 6.2). Во внимание принимаются лишь изменения координат электронов. Простейшая из молекул молекулярный ион 


Для молекулярного иона 

включает притяжение электрона 1 к ядрам А и В (первые два члена) и отталкивание ядер (ядра А и В у 


где Ψ — одноэлектронная волновая функция (собственная функция Шредингера для системы с одним электроном). Индексы «эл. мол.» при E и Ψ — опущены для упрощения записи.
Состояние молекулы Н2 описывается уже двухэлектронной функцией Ψ, зависящей от координат двух электронов (см. рис. 6.2).
Многоэлектронными будут и волновые функции более сложных молекул. Уравнение Шредингера для молекулы Н2 имеет вид

Индексы 1 и 2 при операторах Лапласа указывают, что волновая функция молекулы 



В (6.9) первые четыре члена обозначают потенциальную энергию притяжения электронов 1 и 2 к ядрам А и В соответственно, пятый член — потенциальную энергию взаимного отталкивания электронов 1 и 2, последний член — энергию отталкивания ядер. Аналогично записывается уравнение Шредингера и для многоатомных молекул. В уравнениях (6.7) и (6.8) используется координатная молекулярная функция Ψ. Полная волновая функция молекулы Фмол, учитывающая и спин, должна удовлетворять принципу Паули антисимметрии волновых функций и строится в виде определителя.
Для молекулы, так же как и для атома, точное решение уравнения Шредингера возможно лишь для системы, содержащей один электрон — для молекулярного иона типа 

§3. Вариационный метод решения уравнения Шрёдингера
Одним из широко применяемых при рассмотрении теории химической связи приближенных методов решения уравнения Шредингера является вариационный метод. Здесь коротко излагается его сущность.
Уравнение Шредингера (1.1) может быть представлено в так называемой операторной форме. Для этого разделим все члены уравнения на 

Сумма двух действий, производимых над функцией Ψ в левой части, дифференцирование и умножение, может быть записана с помощью оператора 
который называют оператором энергии, оператором Гамильтона или гамильтонианом. Уравнение приобретает лаконичную форму:
По такому же принципу строится оператор Гамильтона для многоатомных систем, например, для молекулы Н2

Умножим обе части уравнения Шредингера (6.10) на функцию Ψ*, комплексно сопряженную с волновой функцией

Если Ψ — действительная функция, то Ψ*=-Ψ. (Левую сторону уравнения (6.12) нельзя записать аналогично правой в виде 



Если функция Ψ нормирована, знаменатель обращается в единицу и

Если известно точное выражение для Ψ, то энергия системы может быть рассчитана по формулам (6.13) или (6.14). Однако, обычно не известны ни Ψ ни Е либо неизвестна Ψ. Тогда для отыскания Ψ и Е можно воспользоваться вариационным принципом: подставив в (6.13) или (6.14) вместо истинной функции приближенную к ней так называемую пробную функцию Ψпробн, получим отвечающее ей значение Е. Оно обязательно будет не ниже энергии основного состояния системы E0

http://mydocx.ru/6-91552.html
http://pandia.ru/text/78/418/15321-4.php