Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
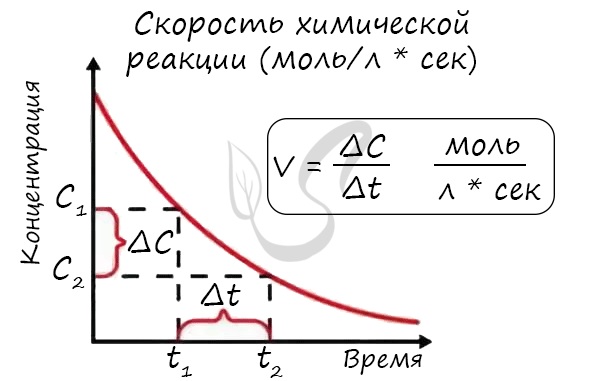
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Скорость химической реакции
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
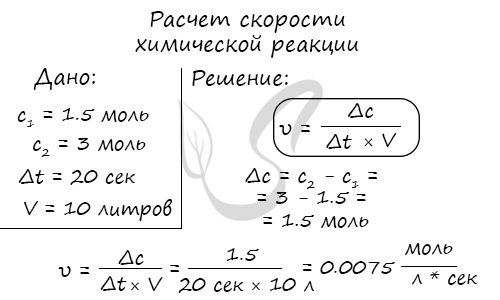
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
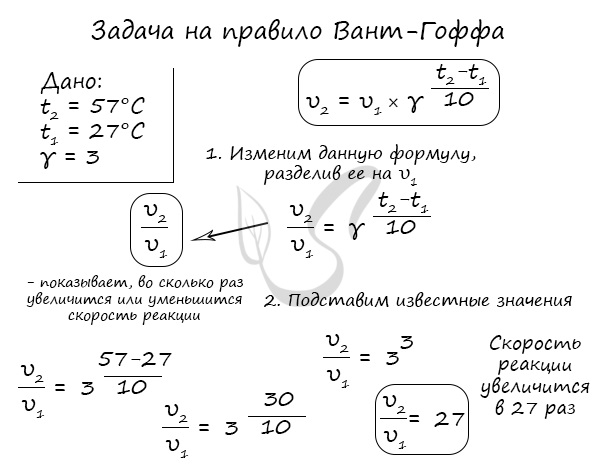
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
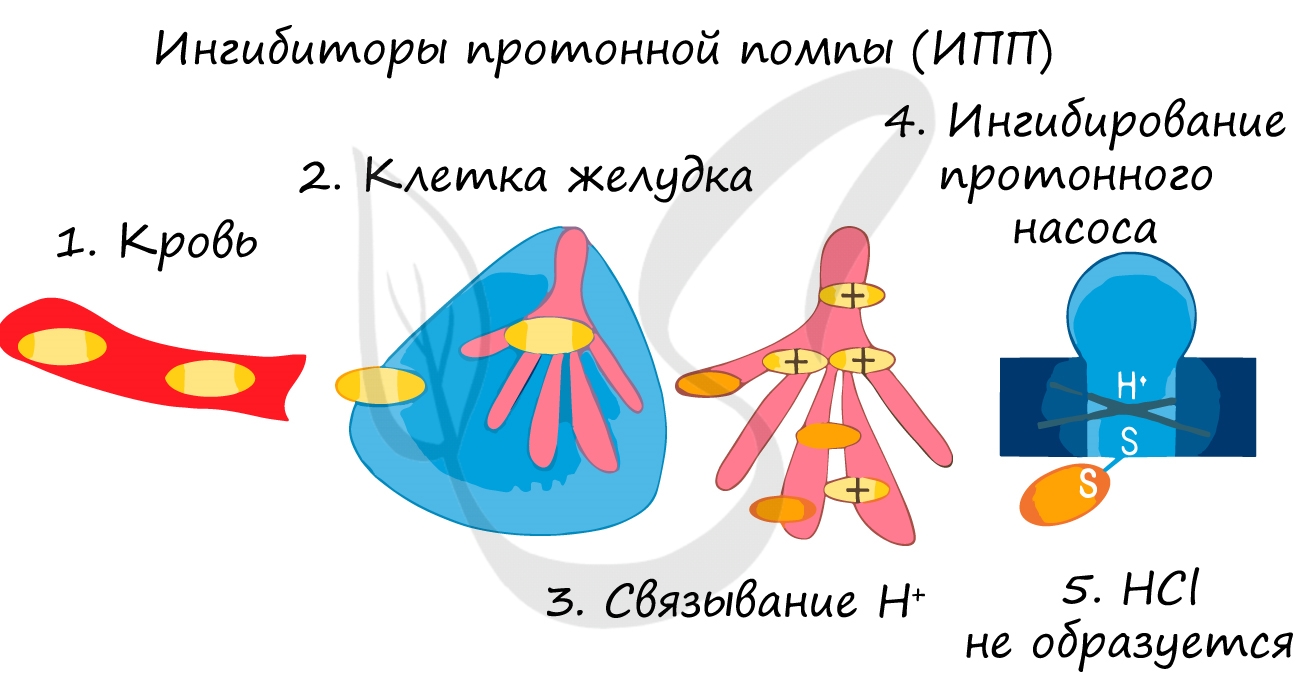
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Скорость химических реакций в химии
Содержание:
Скорость химической реакции — это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Скорость химических реакций
Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты.
Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции, и по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных. Обычно концентрацию выражают в моль/л, а время — в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна (1—0,6)/4= 0,1 моль/(л
Рассмотрим в общем виде скорость реакции, протекающей по уравнению
По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1).
Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени 






Знак минус ставится потому, что, несмотря на убывание концентрации вещества А и, следовательно, на отрицательное значение разности 
Поскольку скорость реакции все время изменяется, то в химической кинетике рассматривают только истинную скорость реакции 
Факторы, влияющие на скорость реакции
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации С, температуры t, присутствия катализаторов, а также от некоторых других факторов (например, от давления — для газовых реакций, от измельчения — для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда иа основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции (I) этот закон выразится уравнением
где 


Из уравнения (4.2) нетрудно установить физический смысл константы скорости 
Константа скорости реакции 
Уравнение (4.2), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Основной закон химической кинетики не учитывает реагирующие вещества, находящиеся в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности. Так, например, для реакции горения угля: 





Влияние температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
при повышении температуры на каждые 10° скорость большинства реакций увеличивается в 2—4 раза.
Математически эта зависимость выражается соотношением
где 




Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Энергия активации
Сильное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, — этот процесс называется активацией. Один из способов активации — увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.
Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации.
Ее определяют опытным путем, обозначают буквой 


Энергия активации 






Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая. Примером эндотермической реакции служит обратный процесс — образование из вещества АВ веществ 





Как видно из рис. 4.2, разность энергий конечного состояния системы (

Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
Понятие о катализе и катализаторах
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Одни катализаторы сильно ускоряют реакцию — положительный катализ, или просто катализ, другие — замедляют — отрицательный катализ. Примерами положительного катализа могут служить получение серной кислоты, окисление аммиака в азотную кислоту с помощью платинового катализатора и др. Примерами отрицательного катализа являются замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты (0,0001 мае. частей) и др. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, — ингибиторами (механизм действия последних отличен от действия катализаторов).
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Каталитическое воздействие может быть оказано на большинство химических реакций. Число катализаторов очень велико, а их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Различают два вида катализа — гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему — газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор — твердое вещество, а реагирующие вещества — газы или жидкости. Примерами могут служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или оксида марганца (IV) (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, — к снижению высоты энергетического барьера (см. рис. 4.2, пунктирная кривая). При этом образуется активированный комплекс с более низким уровнем энергии и скорость реакции сильно возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А+В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействуете другим исходным веществом, при этом катализатор высвобождается:
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение быстро протекающей реакции:
Приведем конкретный пример — окисление 


Эта реакция протекает медленно. Но при введении катализатора образуется промежуточное соединение:
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. И в этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы. В производственных условиях реагирующие вещества подвергают очистке от каталитических ядов, а уже отравленные катализаторы регенерируют.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому, применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Так, например, в присутствии катализатора оксида алюминия 

При той же температуре, но в присутствии мелко раздробленной меди, из этилового спирта образуются водород и уксусный альдегид:
Опыт показывает, что для каждой реакции имеется свой оптимальный катализатор.
Роль катализаторов в химическом производстве исключительно велика. Получение серной кислоты, синтез аммиака, получение из твердого угля жидкого топлива, переработка нефти и природного газа, получение искусственного каучука, пластмасс, гидрогенизация жиров — вот далеко не полный перечень важнейших производств, где применяются катализаторы. Очевидно, поиски новых, все более совершенных катализаторов будут способствовать повышению производительности труда и снижению себестоимости продукции.
Особую роль играют биологические катализаторы — ферменты. При их участии протекают сложные химические процессы в растительных и животных организмах.
Необратимые и обратимые реакции
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например
2) образуется малодиссоциированное (см. § 5.10) соединение, например вода:
3) реакция сопровождается большим выделением энергии, например горение магния
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака (§ 10.4) равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно,
химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ — как исходных, так и образующихся — остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например 





На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ — и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Принцип Ле Шателье
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье:
если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Поясним это на примере реакции синтеза аммиака:
Если внешнее воздействие выражается в увеличении концентрации азота или водорода, то оно благоприятствует реакции, вызывающей уменьшение концентрации этих веществ, и, следовательно, равновесие сместится в сторону образования аммиака. Соответственно увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышение температуры смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесие сместится в сторону исходных веществ; понижение температуры вызовет смещение равновесия в сторону продукта реакции.
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится две молекулы, а в правой — одна. Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению числа молекул, то в данном случае равновесие сместится в сторону продукта реакции. Очевидно, уменьшение давления сместит равновесие в сторону исходных веществ.
Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например
то изменение, давления не вызывает смещения химического равновесия.
Следует заметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Способы смещения равновесия в желаемом направлении, основанные на принципе Лe Шателье, играют огромную роль в химии. Синтез аммиака и многие другие промышленные процессы были освоены благодаря применению способов смещения равновесия в направлении, обеспечивающем высокий выход получаемого вещества.
Во многих процессах смещение химического равновесия в сторону продуктов реакции достигается путем вывода образующихся веществ из сферы реакции. Так, например, чтобы сместить равновесие в реакции этерификации
в сторону образования метилацетата, в систему вводят серную кислоту, поглощающую воду.
Скорость химических реакций очень кратко и подробно
Вы знаете, что химия изучает не только свойства и строение веществ, но и процессы превращения веществ друг в друга — химические реакции. На практике вы встречались с реакциями, которые протекают медленно, месяцами, как, например, коррозия железа. Многие реакции в растворах (между основаниями и кислотами, между солями) заканчиваются очень быстро, а некоторые реакции происходят мгновенно, например, взрывы. Следовательно, различные химические реакции происходят с самыми разными скоростями. Раздел химии, изучающий скорости химических реакций, называют химической кинетикой. Основным понятием в химической кинетике является понятие о скорости реакции. Для количественной характеристики скорости реакции используют изменение количества вещества или концентрации либо реагента, либо продукта химической реакции.
Скоростью химической реакции называют изменение концентрации реагента или продукта химической реакции во времени. Пусть для реакции 



Знак «минус» ставят по следующей причине. По мере протекания реакции 
будет иметь отрицательное значение, а скорость реакции всегда положительна, то перед дробью следует ставить знак «минус». Скорость реакции измеряют в
Существуют гомогенные и гетерогенные химические реакции.
Гомогенными называют химические реакции, протекающие в однородной среде (например, в жидком растворе или газовой фазе).
Гетерогенными называют реакции, происходящие между веществами, находящимися в разных фазах (например, газовой и жидкой, твердой и жидкой и др.).
Скорость гомогенной реакции определяется изменением количества одного из реагирующих веществ, вступивших в реакцию или образующихся в результате реакции веществ в единицу времени в единице объема:
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности:
где 

Химическая реакция является результатом столкновения частиц (атомы, молекулы, ионы) исходных веществ; чем чаще столкновения, тем быстрее осуществляется химическая реакция.
Химические реакции происходят с самыми разными скоростями. Раздел химии, изучающий скорости химических реакций, называют химической кинетикой. Основным понятием в химической кинетике является понятие о скорости реакции. Скоростью химической реакции называют изменение концентрации реагента или продукта химической реакции во времени. Химическая реакция является результатом столкновения частиц реагирующих веществ; чем чаще столкновения, тем быстрее осуществляется химическая реакция.
Существуют гомогенные и гетерогенные химические реакции. Гомогенными называют химические реакции, протекающие в однородной среде. Гетерогенными называют реакции, происходящие между веществами, находящимися в разных фазах.
Факторы влияющие на скорость химической реакции
Скорость химической реакции зависит от ряда факторов, из которых важнейшими являются химическая природа реагирующих веществ, их концентрация, температура и присутствие катализатора. Рассмотрим факторы, влияющие на скорость химических реакций.
Природа реагирующих веществ
Природа реагирующих веществ оказывает решающее влияние на скорость реакции. Например, водород с фтором реагирует очень энергично (со взрывом) уже при комнатной температуре, а реакция водорода с йодом — только при нагревании до 
Влияние концентрации реагентов
Скорость химической реакции зависит от концентрации реагирующих веществ. Известно, что химическое взаимодействие осуществляется при столкновении частиц, поэтому чем больше их концентрация, тем чаще сталкиваются молекулы реагирующих веществ во время своего хаотического движения. Влияние концентрации взаимодействующих веществ распространяется на газовые смеси и растворы.
На скорость реакций с участием газов также влияет давление, потому что оно непосредственно определяет их концентрации.
Гомогенные реакции протекают во всем объеме, и скорость гомогенных реакций зависит от концентраций реагентов.
Гетерогенные реакции протекают на поверхности твердых веществ.
Скорость гетерогенной реакции зависит от поверхности соприкосновения реагирующих веществ. Так, например, кусочек мела с соляной кислотой реагирует с замедленной скоростью, а мелко измельченный мел реагирует достаточно бурно. При размельчении мела поверхность соприкосновения увеличивается, следовательно, увеличивается количество молекул, соответственно возрастает и скорость реакции.
Зависимость скорости реакции от темпера туры
Большое влияние на скорость химической реакции оказывает температура. С повышением температуры скорость химической реакции, как правило, возрастает. При повышении температуры на Ю С скорость реакции увеличивается в 2—4 раза, потому что при повышении температуры возрастает скорость движения молекул веществ, и соответственно увеличивается число столкновений между ними. Таким образом, скорость химических реакций зависит от природы реагирующих веществ, концентрации (от давления газа), температуры и др.
На скорость химических реакций влияет природа реагирующих веществ, концентрация (от давления газа), температура и др. Влияние концентрации взаимодействующих веществ распространяется на газовые смеси и растворы. С повышением температуры скорость химической реакции, как правило, возрастает. При повышении температуры на 
Катализаторы и ингибиторы
Большое влияние на скорость реакции оказывает присутствие в реагирующей системе катализатора.
Вещества которые изменяют химические реакции» но сами в итоге не расходуются» называют катализаторами.
Например, добавка небольшого количества диоксида марганца 
Реакции, протекающие под действием катализаторов, называют каталитическими. Влияние катализаторов на скорость реакции называется катализом. Различают гомогенный и гетерогенный катализ.
Гомогенным называют катализ» при котором реагенты и катализатор находятся в одном агрегатном состоянии (газообразном или жидком). Типичными гомогенными катализаторами являются кислоты и основания.
Гетерогенным называют катализ при котором реагенты и катализатор находятся в различных агрегатных состояниях: чаще всего катализатор — в твердом, а реагирующие — в жидком или газообразном. В качестве гетерогенных катализаторов применяют металлы, их оксиды и др.
Катализ широко распространен в природе, он играет огромную роль в жизнедеятельности организмов. Особенно сильно воздействуют на скорость реакции биологические катализаторы — ферменты. Превращения в организме белков, жиров и углеводов происходят с участием ферментов, поэтому биохимические процессы идут с очень большой скоростью. Следовательно, катализаторы способствуют более быстрому переходу системы из начального в конечное состояние. Наряду с катализаторами существуют вещества, которые замедляют химические процессы.
Вещества которые замедляют скорость химических реакций, называют ингибиторами.
Ингибиторы служат человеку: уменьшают скорость коррозии металлов, продлевают сохранность пищевых продуктов, предотвращают случайные взрывы чувствительных к сотрясениям, но необходимых в промышленности веществ, замедляют некоторые вредные для живого организма процессы, вызывающие заболевания, и поэтому используются в виде лекарств.
Таким образом, одним из важнейших факторов, влияющих на скорость химических реакций, является присутствие катализаторов.
На скорость химических реакций влияет присутствие катализаторов. Вещества, которые ускоряют химические реакции, но сами в итоге не расходуются называют катализаторами.
Реакции, протекающие под действием катализаторов, называют каталитическими. Влияние катали-____заторов на скорость реакции называется катализом.
Различают гомогенный и гетерогенный катализ.
Гомогенным называют катализ, при котором и реагенты и катализатор находятся в одном агрегатном состоянии.
Гетерогенным называют катализ, при котором реагенты и катализатор находятся в различных агрегатных состояниях. Наряду с катализаторами существуют вещества, которые замедляют химические процессы. Вещества. которые замедляют скорость химических реакций называют ингибиторами.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://studarium.ru/article/155
http://natalibrilenova.ru/skorost-himicheskih-reaktsij-v-himii/