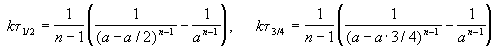Производство аммиака
Тема кодификатора ЕГЭ по химии: Общие научные принципы химического производства на примере промышленного получения аммиака, серной кислоты, метанола.
В этой статье мы рассмотрим принципы химического производства на примере получения аммиака в объеме, достаточном для решения заданий по этой теме в ЕГЭ по химии.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550 о С и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Уравнение скорости реакции синтеза аммиака
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
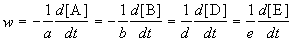
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
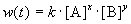
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
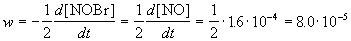
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
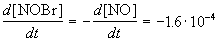
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
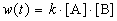
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
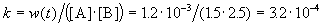
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
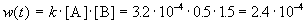
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
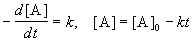
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
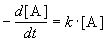
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
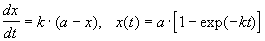
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
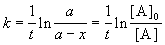
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
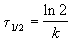
Реакции 2-го порядка. В реакциях типа A + B 
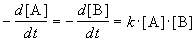
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
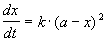
Решение этого уравнения записывают в различных формах:
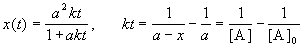
Период полураспада веществ A и B одинаков и равен:
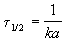
2) Начальные концентрации веществ A и B различны: a 
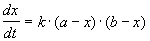
Решение этого уравнения можно записать следующим образом:
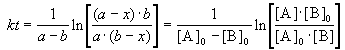
Периоды полураспада веществ A и B различны: 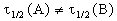
Реакции n-го порядка nA 
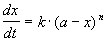
Решение кинетического уравнения:
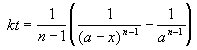
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
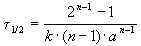
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
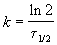
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
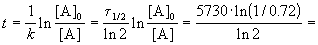
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
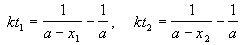
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
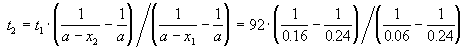
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
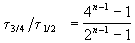
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
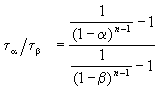
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Технология синтеза аммиака. Аппаратное обеспечение производства
Аммиак является ключевым продуктом для получения большинства азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве. В наибольших количествах он используется для получения азотсодержащих удобрений — карбамида CO(NН2); аммиачной селитры NН3NО3; сульфата аммония, нитрофоса, нитрофоски, жидких комплексных удобрений (ЖКУ) и др. Его применяют также для получения полимерных материалов и многих других продуктов.
Это одно из самых многотоннажных химических производств в мире.
а) Физико-химические основы производства
Синтез аммиака осуществляется из азота и водорода по реакции:
Реакция обратимая, экзотермическая и характеризуется большим тепловым эффектном.
Согласно принципу Ле-Шателье равновесие ее смещается вправо с повышением давления и понижением температуры. Зависимость константы равновесия КР от температуры и давления имеется в справочной литературе.
Однако без использования катализаторов скорость реакции даже при температуре равной 1000 °С практически равна нулю. Это объясняется очень высокой энергией активации этой реакции.
Поэтому процесс проводят в присутствии твердых катализаторов. Как известно, гетерогенно-каталитические реакции имеют несколько стадий, в том числе:
А) диффузия молекул азота и водорода к поверхности зерен катализатора;
Б) хемосорбция этих молекул на поверхности катализатора;
В) поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействие между ними;
Г) десорбция продукта — аммиака с поверхности катализатора;
Д) диффузия молекул аммиака от поверхности катализатора в газовую фазу.
Исследования показали, что наиболее медленной (лимитирующей) этого сложного процесса является стадия хемосорбции молекул азота, так как он имеет наибольшую молекулярную массу.
На основании этого вывода можно описать механизм синтеза аммиака упрощенной схемой:
где К — свободный активный центр поверхности катализатора;
N2 . К — хемосорбированный активный комплекс на поверхности катализатора.
Скорость обратимой реакции синтеза аммиака из водорода и азота на большинстве известных катализаторов можно описать уравнением Темкина- Пыжова:
где k1 и k2 — константы скоростей образования и разложения аммиака;
(Рис. а). Зависимость содержания аммиака в АВС от температуры при различных объемных скоростях АВС.
Давление 30 МПа
(Рис. б). Зависимость содержания аммиака в АВС от температуры при различных давлениях.
Объемная скорость АВС 30000 час -1
(Рис. в). Зависимость содержания аммиака в АВС от давления при различных температурах.
Объемная скорость АВС 30000 час -1
Так как реакция синтеза аммиака обратима, то возможная степень превращения исходного сырья на железных катализаторах не превышает 20-40%. Поэтому все современные схемы производства являются циркуляционными, то есть подается в колонну синтеза многократно с постоянным выделением образовавшегося аммиака путем его конденсации при низких температурах. Достичь полной конденсации также не удается Зависимость остаточной концентрации аммиака в газовой фазе после его конденсации при давлении 30 МПа следующая:
Температура, град. С
аммиака в газовой фазе, % об.
б) Катализаторы синтеза аммиака
Наибольшей активностью обладают металлы восьмой группы таблицы Менделеева (Fe; Ru; Re и Os). В промышленности применяют железный катализаторы. Их получают сплавлением оксидов железа (FeO + Fe2O3) с активаторами и последующим восстановлением оксидов железа. В качестве активаторов применяют кислотного и амфотерного характера (Al2O3; SiO2; TiO2 и др.), а так оксиды щелочных и щелочноземельных металлов (K2O; Na2O; CaO; MgO и др.). Полученный катализатор имеет марку СА-1.
Восстановление смеси оксидов железа производится водородом по реакции:
Образующееся железо имеет тонкопористую губчатую структуры с большой удельной поверхностью.
ПРИНЦИПИАЛЬНАЯ ТЕХНОЛОГИЧЕСКАЯ СХЕМА
В зависимости от величины используемого давления различают:
— агрегаты низкого давления (10-16 МПа);
— агрегаты среднего давления (20-50 МПа);
— агрегаты высокого давления (80-100 МПа).
В мировой практике наиболее широко используются агрегаты среднего давления. В нашей стране агрегаты работают под давлением 30-36 МПа, а также несколько установок с давлением 45 МПа. Новые агрегаты строятся для давления 32 МПа, температур синтеза 420-500 °С, объемной скорости газа в единице объема слоя катализатора количеств 15-25 тыс. м 3 /(м 3. час). При этом удельная производительность катализатора составляет 20-40 т аммиака в сутки.
1 — огневой подогреватель природного газа; 2 — колонна синтеза аммиака; 3 — подогреватель воды; 4 — выносной теплообменник; 5 — циркуляционный компрессор; 6 — сепаратор жидкого аммиака; 7 — блок АВО; 8 — конденсационная колонна; 9 — конденсационная колонна продувочных газов; 10 — испаритель жидкого аммиака; 11 — сборник жидкого аммиака; 12 — испаритель жидкого аммиака на линии танковых газов; 13 — сепаратор; 14 — промежуточная дренажная емкость; 15 — испаритель жидкого аммиака; 16 — магнитный фильтр.
Свежая АВС сжимается в четырехступенчатом ц/б компрессоре до 32 МПа и после охлаждения в АВО поступает в нижнюю часть конденсационной колонны 8, где барботирует через слой сжиженного холодного аммиака и окончательно очищается от остаточных примесей СО, СО2, Н2О и паров масла. Сама она при этом насыщается аммиаком до 3-5 % и смешивается с циркуляционным газом. Далее смесь проходит по трубкам встроенного теплообменника в верхней части колонны 8, и направляется в межтрубное пространство выносного теплообменника4. здесь он нагревается до 185-195 °С за счет тепла газов выходящих из колонны синтеза 2. Здесь он проходит снизу вверх по кольцевому зазору между корпусом колонны и кожухом насадки и поступает в межтрубное пространство встроенного теплообменника4. Здесь он нагревается до температуры зажигания железного катализатора марки СА-1 (420-440 °С) за счет теплоты прореагировавших газов и затем последовательно проходит четыре слоя катализатора, при этом концентрация аммиака возрастает до 15-20 %.
Пройдя через центральную трубу при 500-520 °С азотоводородоаммиачная смесь попадает в трубки встроенного теплообменника, где охлаждается до 330 °С. Дальнейшее охлаждение этой смеси до 215 °С осуществляется в подогревателе питательной воды 3 и выносном теплообменнике 4 до 65 °С. далее она охлаждается в АВО 7 до 40 °С. при этом достигается точка росы и часть аммиака конденсируется. Жидкий аммиак отделяется в сепараторе 6, а газовая смесь содержащая 10-15 % аммиака поступает в циркуляционный компрессор 5, где вновь дожимается до 31,5 МПа компенсируя потери давления в системе. Далее циркуляционный газ поступает в систему вторичной конденсации в конденсационную колонну 8 и испаритель жидкого аммиака 15. В колонне 8 газ охлаждается до 18 °С, а в трубках испарителей 15 до минус 5 °С за счет кипения в межтрубном пространстве жидкого аммиака, поступающего из холодильной станции. При этом из газа конденсируется дополнительное количество жидкого аммиака и смесь поступает в сепарационную часть конденсационной колонны 8, где газ отделяется от капелек жидкого аммиака и смешивается со свежей АВС и циркуляционным газом. Газовая смесь проходит вверх по колонне через трубки встроенного т/о, затем выносной т/о 4 и попадает в колонну синтеза 2. Жидкий аммиак из первичного сепаратора 6 проходит через магнитный фильтр 16 где освобождается от катализаторной пыли и смешивается с жидким аммиаком образующимся в колонне 8. Затем его дросселируют до 4 МПа и отводят в сборник 11. При дросселировании из жидкого аммиака выделяется растворенные в нем газы (водород, азот, метан), это так называемые «танковые» газы, которые содержат 16-18 % аммиака. Эти газы направляются в испаритель 12 для отделения аммиака путем его конденсации при охлаждении до минус 25 °С.
Далее они проходят сепаратор 13, где отделяются от капелек жидкого аммиака и используются как топливо совместно с продувочными газами.
В циркулирующем газе постепенно накапливаются инертные примеси (метан, аргон, гелий и др.). Для того чтобы их количество не превышало 8-10 % производится так называемая «продувка» циркуляционного газа после первичной конденсации аммиака (после сепаратора 6). Эти газы содержат 8-9% аммиака, который выделяют за счет охлаждения до -25..-30 °С в конденсационной колонне 9 и испарителе 10 продувочных газов. После этого продувочные газы, содержащие не более 2 % аммиака присоединяются к танковым газам и используются как топливо.
ОСНОВНОЕ ТЕХНОЛОГИЧЕСКОЕ ОБОРУДОВАНИЕ
Огневой подогреватель АВС
Это цилиндрическая трубчатая печь с двухпоточным змеевиком диаметром труб 102х16 мм. Наружный диаметр корпуса составляет 3612 мм, внутренний (футерованный) 3280 мм. Поверхность нагрева 137 м 2 . Природный газ сжигают в 4 горелках, размещенных в нижней части аппарата. Общая высота с дымовой трубой 24 м.
Огневой подогреватель АВС:
1 — дымовая труба; 2 — заслонка; 3 — штуцер
для измерения температуры дыма; 4 — корпус конуса;
5 — взрывное окно; 6 — штуцер для измерения температуры
змеевиков; 7 — змеевики; 8 — корпус; 9 — футеровка;
10 — смотровое окне; 11 — горелка; 12 — опора
Колонна синтеза аммиака с полочной насадкой для катализатора
Представляет собой вертикальный аппарат, состоящий из двух корпусов высокого давления и внутренней насадки. Насадка состоит из катализаторной коробки и теплообменника. Катализаторная коробка размещена в корпусе высокого давления внутренним диаметром 2400 мм, высотой 22 м; толщина стенки основного корпуса составляет 250 мм. Теплообменник установлен в верхней части основного корпуса и в корпусе, расположенном сверху основного корпуса (диаметром 1000 мм, толщиной стенки 110 мм и высотой 6,5 м).
Между корпусами высокого давления и насадкой имеется зазор, по которому снизу вверх проходит газ, подаваемый колонну. Расчетная температура корпусов составляет 250 °С, расчетное давление 32 МПа.
Оба корпуса рулонированные их стали марки 10Г2С1, крышка и днище кованые из стали 22Х3М; насадка из стали 12Х18Н10Т и 0Х18Н12М2Т. Общая масса колонны без катализатора 484 т. Катализаторная коробка из корпуса высокого давления не извлекается. Поэтому загрузку и выгрузку катализатора ведут через люки. Выравнивание слоя катализатора на полках производится вручную. В колонну загружают 43 м 3 катализатора. Объем по полкам: первая — 7 м 3 ; вторая — 8,5 м 3 ; третья — 12,8 м 3 ; четвертая — 14,7 м 3 .
Через все полки катализатора проходят два «кармана» для многозонных термопар. Температуру замеряют в двух точках на входе и выходе газа из слоя катализатора на каждой полке. В теплообменнике размещено 1920 трубок диаметром 12х1,5 мм.
Колонна синтеза аммиака с полочной насадкой:
1 — корпус колонны; 2 — корпус теплообменника; 3 — катализаторная коробка;
4 — теплообменник; 5 — центральная труба; 6 — опорная обечайка;
7 — холодный байпас; 8 — опора; 9 — корпус насадки; 10 — волнистый компенсатор;
11 — переточная труба; 12 — теплоизоляция; 13 — люк для загрузки катализатора; 14 — заглушка.
Техническая характеристика: рабочее давление 32 МПа; допустимая температура стенки корпуса 250 °С; емкость (геометрическая 96,6 м 3 ); диаметр внутренний корпуса 2400 мм; длина корпуса 28750 мм; общая высота колонны 31620 мм; масса колонны без катализатора 450000 кг, масса катализатора 116000 кг; объем катализатора 43 м 3 ; допустимый перепад давлений 1,5 МПа.
Колонна синтеза аммиака с двойными теплоотводящими трубками
Представляет собой вертикальный аппарат, состоящий из корпуса высокого давления и насадки. Корпус рулонированный из стали марки 10Г2С1, крышка и днище кованые из стали 22Х3М; насадка из стали 12Х18Н10Т и 0Х18Н12М2Т.
Внутренний диаметр корпуса колонны составляет 2400, толщина стенки 265 мм, высота 18,4 м. Насадка состоит из катализаторной коробки, теплообменника и электроподогревателя.
Катализаторная коробка вмещает в себя 35 м 3 катализатора. В слое катализатора на всю его высоту равномерно размещены 363 двойные теплообменные трубки Фильда. Диаметр наружных труб 45х2 мм, внутренних 28х2 мм. В три кармана вставлены двенадцатизонные терпопары, замеряющие температуру по всей высоте катализатора.
Электроподогреватель мощностью 1,1 МВт, размещенный в центральной трубе катализаторной коробки, предназначен для зарогрева и восстановления катализатора, а также для поднятия температуры до начала процесса образования аммиака после остановок агрегата.
Теплообменник расположен под катализаторной коробкой. Количество теплообменных трубок равно 4698 штук, диаметр 20х2 мм, длина 3,5 м. Насадка снаружи теплоизолирована.
Газ при температуре 180 °С входит в колонну сверху, проходит вниз по кольцевому зазору между корпусом высокого давления и корпусом насадки, защищая корпус высокого давления от воздействия высоких температур из зоны катализа. Далее газ поступает в межтрубное пространство теплообменника где нагревается газом, выходящем из поднимается вверх по центральной трубе и поступает во внутренние теплообменные трубки Фильда. Температуру газа на входе в катализаторную коробку регулируют добавлением с основному потоку газа, байпасного газа. Во внутренних трубках газ нагревается от встречного потока газа в наружных трубках и кольцевое пространство между наружными и внутренними трубками, где нагревается до необходимой температуры начала реакции (температуры зажигания катализатора).
Выйдя из трубок Фильда, газ распределяется по всему, проходит сверху вниз весь объем катализатора. Из коробки газ поступает в трубки встроенного теплообменника, охлаждается и выходит из колонны при температуре 330 °С. Распределение температуры по высоте слоя катализатора показано на рис.
Насадка полностью извлекается из корпуса. Поэтому загрузку катализатора проводится вне корпуса. Расчетная температура корпуса высокого давления 250 °С, расчетное давление 32 МПа.
Корпус высокого давления выполнен из стали 10Г2С1 и 22Х3М, насадка из стали 12Х18Н10Т. Масса корпуса и деталей высокого давления 409 т, масса насадки без катализатора 96 т.
Колонна синтеза аммиака с двойными теплоотводящими трубками Фильда:
1 — корпус высокого давления; 2 — катализаторная коробка; 3 — трубчатый теплообменник; 4 — электронагреватель; 5 — многозонная термопара;
6 — крышка; 7 — центральная труба; 8 — труда холодного байпаса; 9 — подпятнник; 10 — обтюратор.
Техническая характеристика: рабочее давление 32 МПа; масса колонны с катализатором 600 т; Объем катализатора 35 м 3 ; геометрическая емкость 85 м 3 ; поверхность теплообмена 826 м 2 ; число трубок 4698; диаметр трубок 20х2 мм; длина трубок 3090 мм; допустимое гидравлическое сопротивление 2,0 МПа.
Распределение температуры по высоте слоя катализатора.
Температурный режим в колоннах синтеза аммиака по высоте катализаторной зоны:
а — колонна с двойными трубками Фильда в слое катализатора (О — вход газа в трубки; Б — вход в слой катализатора; А — горячая точка в зоне реакции).
б — полочная колонна (О, Б, В, Г — вход газа в первую, вторую, третью и четвертую полки катализатора, соответственно).
Подогреватель питательной воды
Представляет собой вертикальный аппарат кожухотрубчатого типа диаметром 1600 мм и высотой 16,85 м и имеет 1722 теплообменные трубки диаметром 22х3,5 мм. Поверхность теплообмена составляет 925 м 2 . Корпус выполнен из стали 22Х3М. трубки — из стали 12Х18Н10Т. Масса аппарата 180,3 т. Газ проходит по трубкам, вода по межтрубному пространству.
Подогреватель питательной воды паровых котлов:
1 — штуцер воздушника; 2 — люк; 3, 11 — днища;
4, 10 — камеры высокого давления; 5, 9 — трубные доски;
6 — корпус; 7 — теплообменные трубки;
8 — труба; 12 — люк: 13 — штуцер спуска.
Выносной теплообменник
Представляет собой вертикальный кожухотрубчатый аппарат внутренним диаметром 1600 мм, высотой 19,36 м с толщиной стенки 140 мм, имеет 7112 трубок диаметром 12х1,5 мм. Поверхность теплообменника 3200 м 2 . К трубным решеткам приварены камеры с патрубками. Корпус выполнен из стали 22Х3М, трубки — из стали 12Х18Н10Т. Масса аппарата 186,4 т.
1 — сальник; 2 — крышка; 3, 10 — камеры;
4, 8 — трубные доски; 5 — корпус;
6 — теплообменные трубки; 7 — перегородки;
9 — днище; 11 — опора.
Аппараты воздушного охлаждения
Для охлаждения газа используют 15 — либо 18 — секционные аппараты горизонтального типа. Газовая смесь по оребренным трубами, охлаждающий воздух нагнетается осевым вентилятором, расположенным под каждой секцией. Для охлаждения воздуха в летнее время предусмотрен впрыск тонкораспыленной воды в поток воздуха. Для 15 — секционного аппарата поверхность теплообмена по оребренным трубам составляет 29300 м 2 , диаметр труб 25х4,5.
Конденсационная колонна
Представляет собой вертикальный цилиндрический аппарат высотой 18,9 м и состоит из теплообменника и сепаратора Внутренний диаметр рулонированного корпуса составляет 2000 мм, толщина стенки 195 мм. В верхней части аппарата размещен теплообменник с поперечными перегородками в межтрубном пространстве. Диаметр трубок 14х2 мм, количество 7800 шт. Поверхность теплообмена 2120 м 2 .
Встроенный сепаратор находится в нижней части аппарата и снабжен устройством для тангенциального движения газа и сепарирующей насадкой из полуфарфовых колец Рашига. Выполнен из стали 10Г2С1, Ст. 20 и др. Масса аппарата 270 т.
1 — крышка; 2 — корпус: 3 — теплообменник; 4 — кольца
Рашига; 5 — труба с тангенциальными выводами газа;
Испаритель жидкого аммиака
Горизонтальный аппарат длиной 14,23 м и диаметром 3200 мм. Внутри корпуса размещены U — образные трубки высокого давления, в количестве 900 штук диаметром 22х3,5 мм. Поверхность теплообмена 940 м 2 .
В некоторых агрегатах используют два параллельно работающих испарителя с поверхностью теплообмена каждого 520 м 2 . Диаметр корпуса 2200 мм, длина аппарата 11,75 м, количество U — образных трубок 526 штук диаметром 22х3,5 мм.
Испаритель жидкого аммиака:
1 — камера высокого давления; 2 — трубная решетка; 3 — корпус; 4 — U-образные трубки; 5 — брызгоотбойник; 6 — камера для испаряющегося жидкого аммиака; 7 — седловая опора.
Техническая характеристика: рабочее давление в трубном пространстве 32 МПа, в межтрубном — 0,2 МПа; расчетное давлений в межтрубном пространстве 2,5 МПа; поверхность теплообмена 520 м 2 ; число U-образных трубок — 526 шт.; диаметр трубок 22х3,5 мм; геометрическая емкость межтрубного пространства 33 м 3 ; трубного 1,7 33 м 3 ; температура трубного +20…-5 °С; межтрубного при испарении жид- кого аммиака -10 °С.
Штуцеры: А — вход циркуляционного газа; Б — выход циркуляционного газа; Г — воздушник; Д — для манометра; Е — выход газообразного аммиака; В — штуцер резервный; Ж — для предохранительного клапана; И — люк-лаз; Л — вход жидкого аммиака; М — дренаж.
Сепаратор
Представляет собой горизонтальный аппарат диаметром 2400 мм и длиной 9 м. Газ входит в трубу диаметром 480 мм, имеющей по всей длине с двух сторон отверстия для выхода газа в сепарационный объем. Окончательное отделение мельчайших капелек жидкого аммиака происходит в пакетах из металлических сеток (демисторе).
Схема сепаратора: 1 — корпус; 2 — сепарационное устройство;
3 — труба; 4, 6 — штуцеры для регулирования уровня; 5 — лаз.
http://www.chem.msu.su/rus/teaching/eremin/1-2.html
http://proplast.ru/articles/tehnologiya-sinteza-ammiaka-apparatnoe-obespecheni/