3.5.1. Теория быстрой коагуляции
Поскольку, как говорилось выше, при быстрой коагуляции любое столкновение оказывается эффективным, то разработка теории быстрой коагуляции оказалась более простой задачей и именно такая теория была разработана М. Смолуховским в 1916 г.
При разработке своей теории он исходил из следующих предпосылок:
1) частицы дисперсной фазы сферические, а сами дисперсные системы являются монодисперсными, т.е. содержат частички одного размера;
2) скорость коагуляции определяется тремя факторами:
– радиусом сферы сил притяжения частиц;
– интенсивностью броуновского движения, которая определяет число столкновений в единицу времени и характеризуется коэффициентом диффузии D;
3) между частицами существуют только силы притяжения.
Последняя предпосылка означает, что в какой-то момент времени, который можно обозначить как t0, внезапно и полностью исчезают силы, приводившие к отталкиванию частиц при их сближении. После этого времени любое столкновение частиц обязательно приведет к их агрегированию.
Смолуховский предложил рассматривать процесс коагуляции как попарное слипание частиц, чем формально уподобил процесс коагуляции химической реакции второго порядка. Считается, что вероятность одновременного столкновения трех частиц столь мала, что такие столкновения можно не учитывать.
Очевидно, что вначале будут образовываться агрегаты частиц, состоящие из двух первичных, затем первичная частица может объединяться с агрегатом из двух первичных частиц и образуется новый агрегат, состоящий из трех первичных частиц. Затем к нему присоединится еще одна частица и будет сформирован агрегат из четырех частиц и т.д. Назовем число частиц в агрегате порядком агрегата и будем считать, что при коагуляции последовательно будут сформированы агрегаты второго n2, третьего n3, четвертого n4, пятого n5 и т.д. порядков. В любой момент времени после начала коагуляции в дисперсной системе будет присутствовать набор агрегатов частиц, так что частичная концентрация будет определяться суммой всех агрегатов:
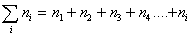
Выражая скорость коагуляции через уменьшение числа частиц в единице объема за единицу времени и учитывая, что общее число частиц может только уменьшаться, записываем
v = – dn/dt = kn 2 , (2.3.138)
где v – скорость коагуляции, k – постоянная скорости коагуляции, n – частичная концентрация (частиц/м 3 ).
Выяснение физического смысла постоянной скорости коагуляции проводится при рассмотрении диффузионного механизма сближения частиц.
Вначале решают задачу диффузионного сближения произвольной частицы с некоторой закрепленной в пространстве центральной частицей. Столкновение этой неподвижной частицы с другой происходит каждый раз, когда частицы сближаются на расстояние, равное их двойному радиусу(R = 2r). Таким образом, рассматривается диффузия точечных частиц к сфере радиуса R. При этом концентрация единичных (первичных) частиц на поверхности такой сферы равна нулю, поскольку на этой поверхности частицы образуют агрегаты.
Распределение частичной концентрации в дисперсной системе находят решением дифференциального уравнения диффузии (второго закона Фика)
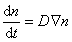
где 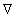
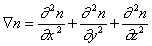
В операторе Лапласа x, y, z характеризуют координаты точечной частицы относительно центра сферы радиуса R. Считается, что в начальный момент распределение частиц в объеме дисперсной системы можно принять равномерным, поэтому их концентрация относительно центра сферы определяется исключительно расстоянием до начала координат. Обозначим это расстояние h, тогда от полярных координат можно перейти к линейным и закон Фика в этом случае приобретает вид
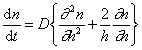
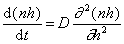
Граничные условия интегрирования уравнения (2.3.142) вытекают из соображений, что при t = 0 n = n0 , если h > R, а при t > 0 n = 0 , если h = R.
Решение уравнения (2.3.139) при граничных условиях имеет вид
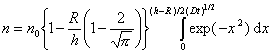
В стационарном процессе частичная концентрация n на расстоянии h не зависит от времени коагуляции, поэтому вторым членом в уравнении (2.3.143) можно пренебречь. Тогда уравнение (2.3.143) приводят к виду
В стационарном процессе поток частиц к сфере радиуса R, т.е. число всех частиц, которые пересекают поверхность этой сферы за 1 с. согласно первому закону Фика будет
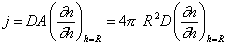
где А – площадь поверхности сферы.
Производную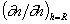

Следовательно для диффузионного потока
Поскольку в реальных условиях ни одну из частиц невозможно сделать неподвижной, то и центральная частица перемещается в пространстве подобно диффундирующим к ней частицам. Поэтому необходимо рассматривать не движение диффундирующих частиц к некоторой неподвижной центральной частице, а относительное движение двух подвижных частиц.
Поскольку частицы перемещаются независимо друг от друга, то постоянная диффузии будет складываться из постоянных диффузии различных частиц, т.е.
Если частицы имеют одинаковый размер, то
Доказательство справедливости уравнений (2.3.148) и (2.3.149) проводят при рассмотрении относительного среднего сдвига частиц. Из теории броуновского движения известно, что
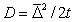
где 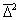
Относительное смещение частиц будет
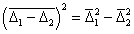
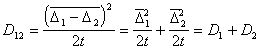
Для одинаковых частиц
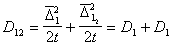
Для потока j частиц через сферу радиуса R, движущуюся вместе с одной из них, подставляя вместо D12 =2 D, получаем
Поток j выражает скорость агрегирования по отношению к одной частице, для всех n0 частиц в 1 м 3 она будет в n0 раз больше, следовательно,
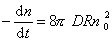
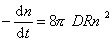
так как уравнение (2.3.155) справедливо для любой концентрации частиц в любой момент времени от начала коагуляции.
Таким образом, постоянная скорости коагуляции имеет физический смысл
Интегрирование уравнения (2.3.156) проводим в пределах от 0 до t и, соответственно, от n0 до n. В результате интегрирования получаем
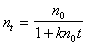
Это уравнение может быть использовано для расчета кинетической кривой коагуляции, однако экспериментальное определение постоянной скорости коагуляции встречает определенные трудности. В процессе коагуляции в результате слипания частиц происходит изменение их размера и, следовательно, коэффициента диффузии и радиуса сферы сил притяжения. При этом постоянная скорости коагуляции оказывается связанной с двумя неопределенными величинами. Поэтому кинетическое уравнение приводят к виду, не содержащему постоянной скорости коагуляции.
Прием, который применил Смолуховский, заключается в определении времени половинной коагуляции, когда
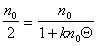
где Q – время половинной коагуляции, определяемое по времени, в течение которого начальная частичная концентрация изменится в два раза.
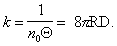
Подставляя значение постоянной скорости коагуляции из уравнения (2.3.161) в уравнение (2.3.158), получаем
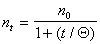
Определение постоянной скорости коагуляции можно проводить графическим методом после построения графика в координатах линейной формы уравнения Смолуховского
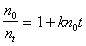
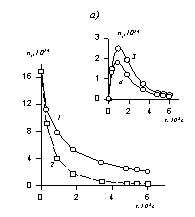
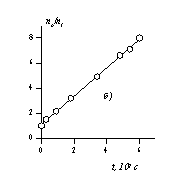
В соответствии с этим уравнением постоянную скорости коагуляции можно определить по тангенсу угла наклона, если известна величина начальной частичной концентрации n0. Пример такой зависимости приведен на рис. 2.25.
В процессе коагуляции в результате слипания частиц происходит изменение их размера и, следовательно, коэффициент диффузии и радиуса сферы сил притяжения. При этом постоянная скорости коагуляции оказывается связанной с двумя неопределенными величинами. Поэтому кинетическое уравнение приводят к виду, не содержащему постоянной скорости коагуляции.
Для расчета концентрации агрегатов частиц любого порядка была получена формула
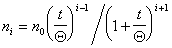
где i – порядок, т.е. число соединившихся в агрегат частиц.
Расчет кинетических кривых по уравнениям (2.3.162) и (2.3.164) приводит к зависимостям, показанным на рис.2.25, а. На рис. 2.25, б приведена кинетическая кривая коагуляции в линейных координатах уравнения Смолуховского (2.3.163), используемая для определения постоянной скорости коагуляции.
Иногда расчеты постоянной скорости проводят теоретически, для чего используют уравнение Эйнштейна, связывающее коэффициент диффузии и размер частиц
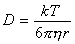
При выводе выражения для постоянной скорости коагуляции принимаем, что столкновение и слипание частиц происходит при их сближении на расстояние R = 2r, поэтому
D = kT /(3phR) . (2.3.166)
Подставляя уравнение (2.3.166) в выражение для постоянной скорости (2.3.161), получаем
к = 8kT/3h . (2.3.167)
Из этого выражения видим, что постоянная скорости коагуляции не зависит от размеров частиц, а определяется лишь вязким сопротивлением среды и температурой системы.
Для времени половинной коагуляции из уравнений (2.3.161) и (2.3.167) получаем уравнение
Следовательно, время половинной коагуляции также не зависит от свойств частиц, а является функцией начальной частичной концентрации, вязкости среды и температуры.
Рис. 2.25. Кинетические кривые коагуляции: а- порядок частиц (1 — суммарное число частиц, 2 – первый, 3 – второй, 4 – третий); б- кинетическая кривая, линейная форма уравнения Смолуховского
Лекция №9.
План лекции:
АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ
Под агрегативной устойчивостью подразумевают сохранение межфазовой поверхности и поверхностной энергии.
Агрегативная устойчивость определяется способностью дисперсных систем противодействовать слипанию частиц. Взаимодействие и слипание твердых частиц приводит к образованию агрегатов. В результате происходит укрупнение частиц, структура дисперсной фазы изменяется, а агрегаты приобретают способность оседать или всплывать. Агрегация и укрупнение частиц называется коагуляцией.
Все дисперсные системы по механизму образования классифицируются:
1. Лиофильные — получаются при самопроизвольном диспергировании одной из фаз.
2. Лиофобные — получаются в результате диспергировании с конденсацией с пересыщением (не самопроизвольно)
В лиофобных системах, если они не закреплены стабилизатором, идут самопроизвольные процессы укрупнения частиц. Такие системы называют агрегативно-неустойчивыми.
Укрупнение может идти двумя путями:
1. изотермическая перегонка — перенос вещества от мелких частиц к крупным,
2. коагуляция — слипание частиц.
Агрегативная устойчивость нестабилизированных систем носит кинетический характер и судить о ней можно по скорости процессов, вызываемых избытком поверхностной энергии. Агрегативная устойчивость может носить и термодинамический характер, если дисперсная система не обладает избытком поверхностной энергии.
ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ ФАКТОРЫ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
1. Электростатический — уменьшение межфазного натяжения из-за возникновения ДЭС на поверхности частиц.
2 .Адсорбционно-сольватный — уменьшение межфазного натяжения при взаимодействии частиц дисперсной фазы со средой.
3. Энтропийный — действует в системах, где частицы участвуют в тепловом движении.
4. Структурно-механический — на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение их требует затраты энергии.
5. Гидродинамический — уменьшение скорости коагуляции, благодаря изменению вязкости среды.
ИЗОТЕРМИЧЕСКАЯ ПЕРЕГОНКА
Изотермическая перегонка может происходить практически во всех системах. Частицы разных размеров обладают неодинаковыми химическими потенциалами, что создает движущую силу переноса вещества от мелких частиц к крупным. Этот процесс ведет к исчезновению мелких частиц, уменьшению средней дисперсности, уменьшению свободной энергии поверхности.
1.растворение и испарение мелких частиц,
2.перенос вещества к крупным частицам,
3.рост крупных частиц.
(1) и (3) стадии — химические процессы, (2) стадия диффузионная.
Скорость изотермической перегонки часто лимитируется (2) стадией, которая подчиняется закону Фика и зависит от градиента концентраций или давлений, которые, в свою очередь, определяются размером частиц

где D с — скорость диффузионного массопереноса (разность концентраций у поверхности малой и большой частиц, V М — мольный объем, r ср — средний радиус частиц, s — поверхностное натяжение.
То есть перенос вещества зависит от:
3.растворимости дисперсной фазы,
Если дисперсная фаза хорошо растворима в дисперсионной среде, то система обладает малой устойчивостью по отношению к изотермической перегонке. Этим объясняется невозможность получения высокодисперсных систем при хорошей растворимости дисперсной фазы. Межфазное натяжение способствует переносу вещества.
КИНЕТИКА КОАГУЛЯЦИИ
Коагуляция протекает в термодинамически неустойчивых дисперсных системах. Смолуховским была рассмотрена коагуляция монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения.
Чтобы определить число столкновений, рассматривают диффузный поток частиц через сферу, окружающую одну частицу, фиксированную в начале координат. Коэффициент диффузии движущейся частицы равен сумме коэффициентов диффузии сталкивающихся n — и m -мерных частиц.
Поток через сферическую частицу по закону Фика:
концентрация частиц : n n m = k n m n m n n (9.4),
Умножим (9.2) на (9.3), получим:

При каждом столкновении два агрегата дают один.
d n / d t = k n t 2 , решение этого выражения дает уравнение Смолуховского:

t к — время коагуляции, n 0 — исходная концентрация системы.
Различают кинетику медленной и быстрой коагуляции.
Быстрая коагуляция.
При быстрой коагуляции все столкновения частиц эффективны, то есть приводят к слипанию частиц. Быстрой коагуляции отвечает условие равенства нулю потенциального барьера D Е = 0 и равенство единице стерического множителя Р = 1.(Р учитывает благоприятные пространственные расположения частиц при столкновении).
Константа скорости быстрой коагуляции равна :
Если учесть, что R = 2 r , D = k БТ/(6 p h r ),то
Из соотношения (9.9) следует, что константа скорости быстрой коагуляции зависит только от температуры и вязкости среды. Вязкость жидкостей, как правило, уменьшается с повышением температуры, что обуславливает резкую зависимость константы скорости коагуляции от температуры.
Медленная коагуляция.
D Е не равна нулю.
Связь эффективности соударений с потенциальным барьером была показана Фуксом. Он ввел понятие коэффициента замедления W , который показывает, во сколько раз Км меньше Кб.
ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ АГРЕГАТИВНОЙ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
Лиофильные (термодинамически агрегативно устойчивые) дисперсные системы могут образовываться самопроизвольно. То есть из любого агрегатного состояния система переходит в данное состояние с уменьшением D G , то есть лиофильные системы — равновесные и обратимые.
D G = D Н — Т D S 0
D Н характеризует межфазное натяжение, D Н не может уменьшаться до 0, так как система должна оставаться гетерогенной.
Наличие D S возможно у дисперсных систем, частицы которых способны к броуновскому движению. То есть из свободнодисперсных систем термодинамически устойчивыми могут быть только ультрамикрогетерогенные — золи.
Условие термодинамической агрегативной устойчивости.
( ¶ D G / d S ) s 0 и ( ¶ D G / d r ) s 0 (9.12)
Это означает, что D G не должно увеличиваться с ростом межфазной поверхности или с уменьшением размера частиц.
Наиболее типичные представители лиофильных коллоидных систем — растворы коллоидных поверхностно активных веществ (ПАВ) и высокомолекулярных соединений (ВМС).
Термодинамически устойчивые к коагуляции лиофобные системы могут быть рассмотрены аналогично лиофильным, если представить уже раздробленную и стабилизированную фазу.
Стабилизаторы увеличивают энтропийную составляющую. Такие системы не могут образовываться самопроизвольно, но могут самопроизвольно пептизировать после коагуляции.
Энергия Гиббса смешения D G N — мера термодинамической агрегативной устойчивости дисперсных систем.

SHAPE \* MERGEFORMAT
n = n + + n — — стехиометрический коэффициент диссоциирующей частицы.
Условие т/д агрегативной устойчивости: D G N 0,
Критическое значение межфазного натяжения, выше которого система теряет агрегативную устойчивость ( D G N = 0).

При отсутствии ДЭС ( n = 1)

d — средний размер частиц, n — безразмерный множитель, учитывающий влияние концентрации и формы частиц.
Чтобы использовать это уравнение для более конкретного рассмотрения влияния различных факторов на агрегативную устойчивость ионно-стабилизированных систем, оно было преобразовано: Стехиометрический коэффициент можно представить с помощью числа способных к диссоциации поверхностных функциональных групп А0 на единице поверхности, степени их диссоциации a и заряда противоионов z :

Подставим в это выражение (9.14), получим:

Из общих критериальных соображений следует, что критическое межфазное натяжение тем выше, чем больше стехиометрический коэффициент диссоциирующей частицы и меньше размер частиц и их концентрация. Диссоциация частиц лиофильных систем облегчает образование системы. Для стабилизации лиофобных систем необходимо обеспечить достаточную плотность способных к диссоциации групп на поверхности частиц, их диссоциацию, а также образование ДЭС.
Таким образом, т/д устойчивость к коагуляции лиофобных систем может быть обеспечена путем формирования поверхностных слоев, способных уменьшить межфазное натяжение и увеличить энтропию до требуемых значений.
Коагуляция дисперсной системы. Скорость коагуляции. Причины, вызывающие процесс самопроизвольной коагуляции
98. Коагуляция дисперсной системы. Скорость коагуляции. Причины, вызывающие процесс самопроизвольной коагуляции.
Коагуляция – процесс самопроизвольного укрупнения (слипания) дисперсных частиц, который может происходить при действии на дисперсную систему различных факторов: при интенсивном перемешивании или встряхивании, нагреве или охлаждении, облучении светом или пропускании электрического тока, при добавлении к системе электролитов или неэлектролитов и др. При разных способах воздействия на систему происходит уменьшение энергии связи диспергированных частиц с окружающей их дисперсионной средой. Так, добавление электролита вызывает сжатие диффузного слоя в коллоидной частице, следовательно, понижение величины электрокинетического потенциала. Это приводит к уменьшению электростатического отталкивания коллоидных частиц и, как следствие, к большей вероятности их слипания.
Минимальная концентрация электролита, добавляемого к дисперсной системе, при которой наступает явная коагуляция за определенный промежуток времени, носит название порога коагуляции 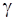
Порог коагуляции рассчитывается следующим образом:
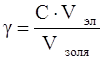
где порог коагуляции, кмоль/м 3 ;
С – молярная концентрация раствора электролита, кмоль/м 3 ;
Vэл – объем раствора электролита, м 3 ;
Vзоля – объем золя, м 3 .
Теорию быстрой скорости коагуляции разработал Смолуховский. Он автор уравнения для расчета константы скорости коагуляции K:
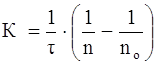
где n0 и n – число частиц в единице объема системы до начала коагуляции и к моменту времени 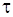
время коагуляции, с.
Константа скорости коагуляции зависит от коэффициента диффузии для частиц и их радиуса следующим образом:
Учитывая уравнение (2) и уравнение Эйнштейна, окончательное уравнение для константы скорости коагуляции принимает вид:
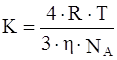
где К – константа скорости коагуляции, м 3 /с;
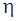
NA – число Авогадро.
Смолуховский ввел также понятие о времени половинной коагуляции, согласно которому время, необходимое для уменьшения первоначального числа частиц в 2 раза, связано с их исходным числом следующим образом:
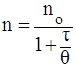
где – время половинной коагуляции, с;
– время от начала коагуляции, с.
Из уравнения, преобразованного к виду:
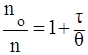
следует, что если построенный в координатах nо/n = f ( график представляет собой прямую линию, то это служит показателем соответствия экспериментальных данных теории Смолуховского.
108. Суспензии. Условия их образования и свойства. Пасты – концентрированные суспензии. Примеры суспензий среди продуктов питания.
Суспензии – это взвеси порошков в жидкости (тип Т/Ж). Дисперсная фаза в суспензиях содержит частицы сравнительно больших размеров (более 10 –4 см), поэтому суспензии седиментационно (т.е. по способности к оседанию) неустойчивы. Им не свойственны осмотическое давление, броуновское движение и диффузия. Частицы могут нести на своей поверхности двойной электрический слой, что способствует их стабилизации, но под влиянием электролитов суспензии коагулируют или образуют агрегаты, причем коагулированная суспензия, обычно легко пептизируется. Суспензии гидрофильных частиц стойки в воде, но нестойки в углеводородах. Их стойкость повышается в присутствии поверхностно-активных веществ. Повышению стабильности суспензий способствует также образование заряда на поверхности частиц (мицеллирование).
Пасты – это высококонцентрированные стабилизированные суспензии (типа Т/Ж), в которых частицы дисперсной фазы связаны за счет молекулярных сил и по этой причине не способны к взаимному перемещению. В таких высоковязких (пластично-вязких) системах почти вся дисперсионная среда сольватно связана с дисперсной фазой. Таким образом, пасты занимают промежуточное положение между порошками и суспензиями. В них могут протекать процессы, характерные для коллоидных систем с внутренней структурой (синерезис и др.) Большое практическое значение таких концентрированных систем обусловлено их пластичностью.
Примерами суспензий среди продуктов питания являются все пищевые пасты: томатная, шоколадная, сырная и т.д.
1. Ахметов Б. В. Задачи и упражнения по физической и коллоидной химии. – Л.: Химия, 1989.
2. Гамеева О. С. Физическая и коллоидная химия. – М.: Высшая школа, 1983.
3. Евстратова К. И., Купина Н. А., Малахова Е. М. Физическая и коллоидная химия. – М.: Высшая школа, 1990.
4. Зимон А. Д., Лещенко Н. Ф. Коллоидная химия. – М.: Химия, 2001.
5. Зимон А. Д., Лещенко Н. Ф. Физическая химия. – М.: Химия, 2000.
6. Киселев Е. В. Сборник примеров и задач по физической химии. – М.: Высшая школа, 1983.
7. Кнорре Д. Г. Физическая химия. – М.: Высшая школа, 1990.
8. Стромберг А. Г. Физическая химия. – М.: Высшая школа, 2001.
9. Степин Б. Д. Международные системы единиц физических величин в химии. – М.: Высшая школа, 1990.
10. Фридрихсберг Д. А. Курс коллоидной химии. – Л.: Химия, 1995.
11. Хмельницкий Р. А. Физическая и коллоидная химиия. – М.: Высшая школа, 1988.
http://www.trotted.narod.ru/collchem/lec-9.htm
http://kazedu.com/referat/101292/3