3.5.1. Теория быстрой коагуляции
Поскольку, как говорилось выше, при быстрой коагуляции любое столкновение оказывается эффективным, то разработка теории быстрой коагуляции оказалась более простой задачей и именно такая теория была разработана М. Смолуховским в 1916 г.
При разработке своей теории он исходил из следующих предпосылок:
1) частицы дисперсной фазы сферические, а сами дисперсные системы являются монодисперсными, т.е. содержат частички одного размера;
2) скорость коагуляции определяется тремя факторами:
– радиусом сферы сил притяжения частиц;
– интенсивностью броуновского движения, которая определяет число столкновений в единицу времени и характеризуется коэффициентом диффузии D;
3) между частицами существуют только силы притяжения.
Последняя предпосылка означает, что в какой-то момент времени, который можно обозначить как t0, внезапно и полностью исчезают силы, приводившие к отталкиванию частиц при их сближении. После этого времени любое столкновение частиц обязательно приведет к их агрегированию.
Смолуховский предложил рассматривать процесс коагуляции как попарное слипание частиц, чем формально уподобил процесс коагуляции химической реакции второго порядка. Считается, что вероятность одновременного столкновения трех частиц столь мала, что такие столкновения можно не учитывать.
Очевидно, что вначале будут образовываться агрегаты частиц, состоящие из двух первичных, затем первичная частица может объединяться с агрегатом из двух первичных частиц и образуется новый агрегат, состоящий из трех первичных частиц. Затем к нему присоединится еще одна частица и будет сформирован агрегат из четырех частиц и т.д. Назовем число частиц в агрегате порядком агрегата и будем считать, что при коагуляции последовательно будут сформированы агрегаты второго n2, третьего n3, четвертого n4, пятого n5 и т.д. порядков. В любой момент времени после начала коагуляции в дисперсной системе будет присутствовать набор агрегатов частиц, так что частичная концентрация будет определяться суммой всех агрегатов:
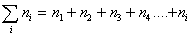
Выражая скорость коагуляции через уменьшение числа частиц в единице объема за единицу времени и учитывая, что общее число частиц может только уменьшаться, записываем
v = – dn/dt = kn 2 , (2.3.138)
где v – скорость коагуляции, k – постоянная скорости коагуляции, n – частичная концентрация (частиц/м 3 ).
Выяснение физического смысла постоянной скорости коагуляции проводится при рассмотрении диффузионного механизма сближения частиц.
Вначале решают задачу диффузионного сближения произвольной частицы с некоторой закрепленной в пространстве центральной частицей. Столкновение этой неподвижной частицы с другой происходит каждый раз, когда частицы сближаются на расстояние, равное их двойному радиусу(R = 2r). Таким образом, рассматривается диффузия точечных частиц к сфере радиуса R. При этом концентрация единичных (первичных) частиц на поверхности такой сферы равна нулю, поскольку на этой поверхности частицы образуют агрегаты.
Распределение частичной концентрации в дисперсной системе находят решением дифференциального уравнения диффузии (второго закона Фика)
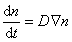
где 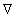
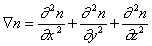
В операторе Лапласа x, y, z характеризуют координаты точечной частицы относительно центра сферы радиуса R. Считается, что в начальный момент распределение частиц в объеме дисперсной системы можно принять равномерным, поэтому их концентрация относительно центра сферы определяется исключительно расстоянием до начала координат. Обозначим это расстояние h, тогда от полярных координат можно перейти к линейным и закон Фика в этом случае приобретает вид
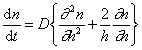
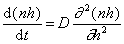
Граничные условия интегрирования уравнения (2.3.142) вытекают из соображений, что при t = 0 n = n0 , если h > R, а при t > 0 n = 0 , если h = R.
Решение уравнения (2.3.139) при граничных условиях имеет вид
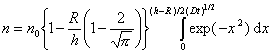
В стационарном процессе частичная концентрация n на расстоянии h не зависит от времени коагуляции, поэтому вторым членом в уравнении (2.3.143) можно пренебречь. Тогда уравнение (2.3.143) приводят к виду
В стационарном процессе поток частиц к сфере радиуса R, т.е. число всех частиц, которые пересекают поверхность этой сферы за 1 с. согласно первому закону Фика будет
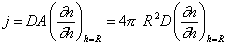
где А – площадь поверхности сферы.
Производную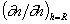

Следовательно для диффузионного потока
Поскольку в реальных условиях ни одну из частиц невозможно сделать неподвижной, то и центральная частица перемещается в пространстве подобно диффундирующим к ней частицам. Поэтому необходимо рассматривать не движение диффундирующих частиц к некоторой неподвижной центральной частице, а относительное движение двух подвижных частиц.
Поскольку частицы перемещаются независимо друг от друга, то постоянная диффузии будет складываться из постоянных диффузии различных частиц, т.е.
Если частицы имеют одинаковый размер, то
Доказательство справедливости уравнений (2.3.148) и (2.3.149) проводят при рассмотрении относительного среднего сдвига частиц. Из теории броуновского движения известно, что
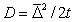
где 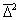
Относительное смещение частиц будет
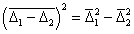
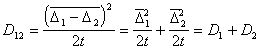
Для одинаковых частиц
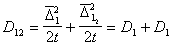
Для потока j частиц через сферу радиуса R, движущуюся вместе с одной из них, подставляя вместо D12 =2 D, получаем
Поток j выражает скорость агрегирования по отношению к одной частице, для всех n0 частиц в 1 м 3 она будет в n0 раз больше, следовательно,
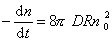
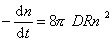
так как уравнение (2.3.155) справедливо для любой концентрации частиц в любой момент времени от начала коагуляции.
Таким образом, постоянная скорости коагуляции имеет физический смысл
Интегрирование уравнения (2.3.156) проводим в пределах от 0 до t и, соответственно, от n0 до n. В результате интегрирования получаем
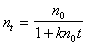
Это уравнение может быть использовано для расчета кинетической кривой коагуляции, однако экспериментальное определение постоянной скорости коагуляции встречает определенные трудности. В процессе коагуляции в результате слипания частиц происходит изменение их размера и, следовательно, коэффициента диффузии и радиуса сферы сил притяжения. При этом постоянная скорости коагуляции оказывается связанной с двумя неопределенными величинами. Поэтому кинетическое уравнение приводят к виду, не содержащему постоянной скорости коагуляции.
Прием, который применил Смолуховский, заключается в определении времени половинной коагуляции, когда
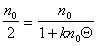
где Q – время половинной коагуляции, определяемое по времени, в течение которого начальная частичная концентрация изменится в два раза.
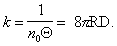
Подставляя значение постоянной скорости коагуляции из уравнения (2.3.161) в уравнение (2.3.158), получаем
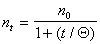
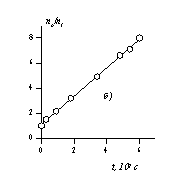
Определение постоянной скорости коагуляции можно проводить графическим методом после построения графика в координатах линейной формы уравнения Смолуховского
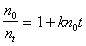
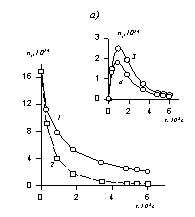
В соответствии с этим уравнением постоянную скорости коагуляции можно определить по тангенсу угла наклона, если известна величина начальной частичной концентрации n0. Пример такой зависимости приведен на рис. 2.25.
В процессе коагуляции в результате слипания частиц происходит изменение их размера и, следовательно, коэффициент диффузии и радиуса сферы сил притяжения. При этом постоянная скорости коагуляции оказывается связанной с двумя неопределенными величинами. Поэтому кинетическое уравнение приводят к виду, не содержащему постоянной скорости коагуляции.
Для расчета концентрации агрегатов частиц любого порядка была получена формула
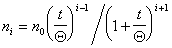
где i – порядок, т.е. число соединившихся в агрегат частиц.
Расчет кинетических кривых по уравнениям (2.3.162) и (2.3.164) приводит к зависимостям, показанным на рис.2.25, а. На рис. 2.25, б приведена кинетическая кривая коагуляции в линейных координатах уравнения Смолуховского (2.3.163), используемая для определения постоянной скорости коагуляции.
Иногда расчеты постоянной скорости проводят теоретически, для чего используют уравнение Эйнштейна, связывающее коэффициент диффузии и размер частиц
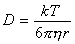
При выводе выражения для постоянной скорости коагуляции принимаем, что столкновение и слипание частиц происходит при их сближении на расстояние R = 2r, поэтому
D = kT /(3phR) . (2.3.166)
Подставляя уравнение (2.3.166) в выражение для постоянной скорости (2.3.161), получаем
к = 8kT/3h . (2.3.167)
Из этого выражения видим, что постоянная скорости коагуляции не зависит от размеров частиц, а определяется лишь вязким сопротивлением среды и температурой системы.
Для времени половинной коагуляции из уравнений (2.3.161) и (2.3.167) получаем уравнение
Следовательно, время половинной коагуляции также не зависит от свойств частиц, а является функцией начальной частичной концентрации, вязкости среды и температуры.
Рис. 2.25. Кинетические кривые коагуляции: а- порядок частиц (1 — суммарное число частиц, 2 – первый, 3 – второй, 4 – третий); б- кинетическая кривая, линейная форма уравнения Смолуховского
Лекция №9.
План лекции:
АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ
Под агрегативной устойчивостью подразумевают сохранение межфазовой поверхности и поверхностной энергии.
Агрегативная устойчивость определяется способностью дисперсных систем противодействовать слипанию частиц. Взаимодействие и слипание твердых частиц приводит к образованию агрегатов. В результате происходит укрупнение частиц, структура дисперсной фазы изменяется, а агрегаты приобретают способность оседать или всплывать. Агрегация и укрупнение частиц называется коагуляцией.
Все дисперсные системы по механизму образования классифицируются:
1. Лиофильные — получаются при самопроизвольном диспергировании одной из фаз.
2. Лиофобные — получаются в результате диспергировании с конденсацией с пересыщением (не самопроизвольно)
В лиофобных системах, если они не закреплены стабилизатором, идут самопроизвольные процессы укрупнения частиц. Такие системы называют агрегативно-неустойчивыми.
Укрупнение может идти двумя путями:
1. изотермическая перегонка — перенос вещества от мелких частиц к крупным,
2. коагуляция — слипание частиц.
Агрегативная устойчивость нестабилизированных систем носит кинетический характер и судить о ней можно по скорости процессов, вызываемых избытком поверхностной энергии. Агрегативная устойчивость может носить и термодинамический характер, если дисперсная система не обладает избытком поверхностной энергии.
ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ ФАКТОРЫ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
1. Электростатический — уменьшение межфазного натяжения из-за возникновения ДЭС на поверхности частиц.
2 .Адсорбционно-сольватный — уменьшение межфазного натяжения при взаимодействии частиц дисперсной фазы со средой.
3. Энтропийный — действует в системах, где частицы участвуют в тепловом движении.
4. Структурно-механический — на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение их требует затраты энергии.
5. Гидродинамический — уменьшение скорости коагуляции, благодаря изменению вязкости среды.
ИЗОТЕРМИЧЕСКАЯ ПЕРЕГОНКА
Изотермическая перегонка может происходить практически во всех системах. Частицы разных размеров обладают неодинаковыми химическими потенциалами, что создает движущую силу переноса вещества от мелких частиц к крупным. Этот процесс ведет к исчезновению мелких частиц, уменьшению средней дисперсности, уменьшению свободной энергии поверхности.
1.растворение и испарение мелких частиц,
2.перенос вещества к крупным частицам,
3.рост крупных частиц.
(1) и (3) стадии — химические процессы, (2) стадия диффузионная.
Скорость изотермической перегонки часто лимитируется (2) стадией, которая подчиняется закону Фика и зависит от градиента концентраций или давлений, которые, в свою очередь, определяются размером частиц

где D с — скорость диффузионного массопереноса (разность концентраций у поверхности малой и большой частиц, V М — мольный объем, r ср — средний радиус частиц, s — поверхностное натяжение.
То есть перенос вещества зависит от:
3.растворимости дисперсной фазы,
Если дисперсная фаза хорошо растворима в дисперсионной среде, то система обладает малой устойчивостью по отношению к изотермической перегонке. Этим объясняется невозможность получения высокодисперсных систем при хорошей растворимости дисперсной фазы. Межфазное натяжение способствует переносу вещества.
КИНЕТИКА КОАГУЛЯЦИИ
Коагуляция протекает в термодинамически неустойчивых дисперсных системах. Смолуховским была рассмотрена коагуляция монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения.
Чтобы определить число столкновений, рассматривают диффузный поток частиц через сферу, окружающую одну частицу, фиксированную в начале координат. Коэффициент диффузии движущейся частицы равен сумме коэффициентов диффузии сталкивающихся n — и m -мерных частиц.
Поток через сферическую частицу по закону Фика:
концентрация частиц : n n m = k n m n m n n (9.4),
Умножим (9.2) на (9.3), получим:

При каждом столкновении два агрегата дают один.
d n / d t = k n t 2 , решение этого выражения дает уравнение Смолуховского:

t к — время коагуляции, n 0 — исходная концентрация системы.
Различают кинетику медленной и быстрой коагуляции.
Быстрая коагуляция.
При быстрой коагуляции все столкновения частиц эффективны, то есть приводят к слипанию частиц. Быстрой коагуляции отвечает условие равенства нулю потенциального барьера D Е = 0 и равенство единице стерического множителя Р = 1.(Р учитывает благоприятные пространственные расположения частиц при столкновении).
Константа скорости быстрой коагуляции равна :
Если учесть, что R = 2 r , D = k БТ/(6 p h r ),то
Из соотношения (9.9) следует, что константа скорости быстрой коагуляции зависит только от температуры и вязкости среды. Вязкость жидкостей, как правило, уменьшается с повышением температуры, что обуславливает резкую зависимость константы скорости коагуляции от температуры.
Медленная коагуляция.
D Е не равна нулю.
Связь эффективности соударений с потенциальным барьером была показана Фуксом. Он ввел понятие коэффициента замедления W , который показывает, во сколько раз Км меньше Кб.
ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ АГРЕГАТИВНОЙ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
Лиофильные (термодинамически агрегативно устойчивые) дисперсные системы могут образовываться самопроизвольно. То есть из любого агрегатного состояния система переходит в данное состояние с уменьшением D G , то есть лиофильные системы — равновесные и обратимые.
D G = D Н — Т D S 0
D Н характеризует межфазное натяжение, D Н не может уменьшаться до 0, так как система должна оставаться гетерогенной.
Наличие D S возможно у дисперсных систем, частицы которых способны к броуновскому движению. То есть из свободнодисперсных систем термодинамически устойчивыми могут быть только ультрамикрогетерогенные — золи.
Условие термодинамической агрегативной устойчивости.
( ¶ D G / d S ) s 0 и ( ¶ D G / d r ) s 0 (9.12)
Это означает, что D G не должно увеличиваться с ростом межфазной поверхности или с уменьшением размера частиц.
Наиболее типичные представители лиофильных коллоидных систем — растворы коллоидных поверхностно активных веществ (ПАВ) и высокомолекулярных соединений (ВМС).
Термодинамически устойчивые к коагуляции лиофобные системы могут быть рассмотрены аналогично лиофильным, если представить уже раздробленную и стабилизированную фазу.
Стабилизаторы увеличивают энтропийную составляющую. Такие системы не могут образовываться самопроизвольно, но могут самопроизвольно пептизировать после коагуляции.
Энергия Гиббса смешения D G N — мера термодинамической агрегативной устойчивости дисперсных систем.

SHAPE \* MERGEFORMAT
n = n + + n — — стехиометрический коэффициент диссоциирующей частицы.
Условие т/д агрегативной устойчивости: D G N 0,
Критическое значение межфазного натяжения, выше которого система теряет агрегативную устойчивость ( D G N = 0).

При отсутствии ДЭС ( n = 1)

d — средний размер частиц, n — безразмерный множитель, учитывающий влияние концентрации и формы частиц.
Чтобы использовать это уравнение для более конкретного рассмотрения влияния различных факторов на агрегативную устойчивость ионно-стабилизированных систем, оно было преобразовано: Стехиометрический коэффициент можно представить с помощью числа способных к диссоциации поверхностных функциональных групп А0 на единице поверхности, степени их диссоциации a и заряда противоионов z :

Подставим в это выражение (9.14), получим:

Из общих критериальных соображений следует, что критическое межфазное натяжение тем выше, чем больше стехиометрический коэффициент диссоциирующей частицы и меньше размер частиц и их концентрация. Диссоциация частиц лиофильных систем облегчает образование системы. Для стабилизации лиофобных систем необходимо обеспечить достаточную плотность способных к диссоциации групп на поверхности частиц, их диссоциацию, а также образование ДЭС.
Таким образом, т/д устойчивость к коагуляции лиофобных систем может быть обеспечена путем формирования поверхностных слоев, способных уменьшить межфазное натяжение и увеличить энтропию до требуемых значений.
Основы процессов коагуляции и осаждения
Глава третья
Физико — химические основы коагуляции
коллоидных примесей воды
Содержание
3.1. Характеристика коллоидных систем
3.2. Основы теории двойного электрического слоя
3.3. Электрокинетический потенциал
3.4. Основы теории устойчивости коллоидных систем
3.5. Кинетика коагуляции
Если очистка воды от грубодисперсных примесей (ГДП) может быть принципиально осуществлена обычным отстаиванием, время которого определяется размером и удельной массой частиц, то коллоидные примеси за счет их агрегативной устойчивости могут быть выделены из воды только методом коагуляции. Коагуляция — физико-химический процесс укрупнения коллоидных частиц за счет их слипания под действием молекулярных сил притяжения. В практике водоподготовки под коагуляцией понимают очистку воды от коллоидных веществ с одновременной очисткой от ГДП и обесцвечиванием воды путем дозировки в обрабатываемую воду специального реагента — коагулянта.
Для коллоидных систем характерны два основных признака: гетерогенность и дисперсность. Первый из признаков указывает на наличие межфазной поверхности (поверхностного слоя), определяющего самые существенные и характерные свойства коллоидных систем. Второй признак — дисперсность (раздробленность) — либо определяется по трем измерениям тела, либо характеризуется величиной, обратной минимальному размеру и названной дисперсностью, либо, наконец, используется третья характеристика раздробленности — удельная площадь поверхности Sуд (отношение межфазной поверхности к объему тела, табл. 3.1).
Таблица 3.1. Изменение удельной площади поверхности частиц при измельчении
| Размер ребра кубика, см | Число частиц | Удельная площадь поверхности Sуд, см 2 /см 3 | Дисперсность, см -1 |
|---|---|---|---|
| 1 | 1 | 6 | 1 |
| 10 -1/ (мм) | 10 3 | 60 | 10 |
| 10 -4 (мкм) | 10 12 | 6*10 4 (6м 2 см 3 ) | 10 4 |
| 10 -7 (нм) | 10 21 | 6*10 7 (6000м 2 /см 3 ) | 10 7 |
Учитывая эти признаки, коллоидные системы можно охарактеризовать и определенным видом энергии, которым они обладают. Гетерогенность предопределяет наличие поверхностного натяжения Sг, причем чем сильнее различаются фазы по своей природе, тем выше поверхностное натяжение.
Коллоидные системы, обладающие большим избытком поверхностной энергии, стремятся уменьшить ее за счет снижения поверхностного натяжения благодаря поверхностной адсорбции других веществ, что формирует структуру поверхностного слоя и наделяет этот слой свойствами, отличными от свойств основной фазы. Избирательная адсорбция приводит к приобретению соприкасающимися фазами зарядов противоположного знака, но различной величины,т. е. возникает двойной электрический слой, обусловливающий различные электрокинетические явления.
Возможны три механизма образования двойного электрического слоя (ДЭС): во-первых, за счет перехода ионов или электронов из одной фазы в другую (поверхностная ионизация), во-вторых, благодаря адсорбции соединений — примесей водных сред и, в-третьих, за счет определенного ориентирования молекул сопряженных фаз в результате их взаимодействия. Для водных коллоидных систем характерны все три возможных вида ДЭС, причем роль каждого из них в значительной мере связана со значением рН среды и химическими свойствами коллоидных соединений. Так как все явления на межфазных поверхностях коллоидных систем обусловлены наличием ДЭС и количественные связи между коллоидными частицами зависят от его строения, то представляется важным оценить строение ДЭС.
Двойной электрический слой впервые рассмотрен Гельмгольцем в виде плоского конденсатора с расстоянием между двумя рядами разноименно заряженных ионов, близким к размеру диаметра молекул. На этом участке потенциал линейно снижался от значения ——(ро——— до нуля. Однако такое строение слоя не учитывает теплового движения ионов. Гуи и Чепмен предположили, что ДЭС имеет размытое (диффузионное) строение, а концентрация противоионов (ионов, находящихся в растворе, со знаком заряда, противоположным заряду адсорбированных ионов и называемых потенциалообразующими) в поле действия поверхностного потенциала распределяется исходя из теплового движения в соответствии с законом Больцмана.
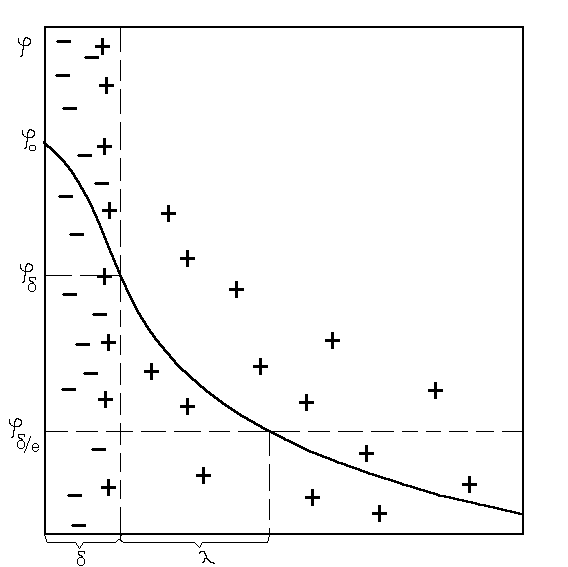
Современная теория строения ДЭС, логически развивающая представления Гельмгольца, Штерна, Гуи и Чепмена, рассматривает слой в виде двух частей (рис. 3.1). Одна его часть находится непосредственно у межфазной поверхности и образует адсорбционный слой (слой Гельмгольца) толщиной б, соответствующий диаметру гидратированных ионов, находящихся в нем.
Рис 3.1. Двойной электрический слой и изменение в нем потенциала
Остальная часть противоионов находится в диффузной части толщиной К, зависящей от свойства и состава раствора и коллоидной системы. Значение потенциала в слое Гельмгольца при удалении от потенциалообразующих ионов снижается линейно от фо до потенциала диффузного слоя ——(ре———, а затем изменяется по экспоненте. Толщина диффузного слоя К соответствует, как было условно принято, расстоянию, на котором потенциал диффузного слоя снижается в е раз, т. е. в 2,718 раза.
Концентрация ионов в диффузном слое на расстоянии х от границ раздела фаз пропорциональна распределению Больцмана:
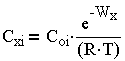 | 3.1 |
где С-концентрация иона; i, z- валентности ионов в объеме раствора за пределами диффузного слоя; WX=zFфX характеризует работу по перемещению 1 моля ионов из объема раствора на расстояние X до границы раздела фаз; F — число Фарадея; (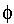
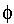
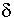
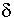
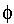
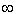
Использовав уравнение (3.1), можно оценить объемную плотность заряда р для сферического электрического поля в диффузном слое:
в присутствии одного электролита:
| Px=F(Z+CX++Z—CX-) | 3.2 |
в присутствии же нескольких электролитов:
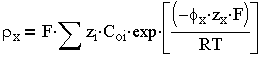 | 3.3 |
Для плоского двойного электрического слоя, радиус кривизны поверхности которого значительно больше толщины ДЭС, соотношение между объемной плотностью заряда 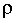
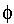
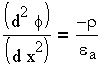 | 3.4 |
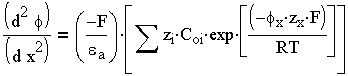 | 3.5 |
С помощью преобразований и решения этого уравнения можно численно оценить толщину диффузного слоя 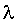
=81, Т ==293 К, R=8,3Дж/(моль.К). F=9,64*10 4 кл/моль и при концентрациях С=10 -1 , 10 -3 и 10 -5 моль/кг составляют соответственно 1, 10, 100 нм.
Кроме свойств раствора на формирование ДЭС у поверхности твердой фазы оказывает влияние ее природа. В настоящее время сформировалось представление о том, что на поверхности оксидов, находящихся в водных растворах, потенциалообразующими ионами ДЭС являются ионы Н + или ОН — в зависимости от рН среды и кислотно — основных свойств оксидов. Например, гидроксид кремния обладает ярко выраженными кислотными свойствами, и поэтому при рН выше изоэлектрической точки [рН изоэлектрической точки (рНиэ) — это то значение рН, при котором данное вещество не диссоциирует:рНиэ SiO2 =2] его поверхность заряжена отрицательно:
[SiO2]m*nOH — (n-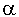 )H + )H + 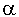 H + H + | 3.6 |
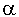 показывает долю диссоциированных молекул вещества. Этот же результат можно получить, рассмотрев диссоциацию поверхностных молекул коллоидных поликремниевых кислот:
показывает долю диссоциированных молекул вещества. Этот же результат можно получить, рассмотрев диссоциацию поверхностных молекул коллоидных поликремниевых кислот:(H2O)n(SiO2)m=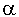 H+ [(n- H+ [(n-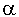 )H+nOH(SiO2)m] — )H+nOH(SiO2)m] — |
Подобным же образом возникает ДЭС и на поверхности между природной водой и органическими кислотами (гуминовыми, таниновыми и др.), для которых рН=(3.5-4.5), поэтому диссоциация их молекул поверхностного слоя при рН водной среды (6.5-8.0) протекает по кислотному характеру с возникновением отрицательного потенциала.
Гидроксид железа имеет основные свойства, что определяет положительный заряд его поверхности, так же как и органических оснований (аминов).
Для амфотерных гидроксидов, например для гидроксида алюминия, значительно влияние рН среды на изменение и знака заряда поверхности: так, в кислой и нейтральной средах гидроксид алюминия (рНИЭ =7.6 — 8.2) имеет положительно заряженную поверхность, а в щелочной среде (при рН>рНИЭ) она заряжена отрицательно.
В коллоидных системах ДЭС возникает на поверхности частиц. Частицу дисперсной фазы вместе с ДЭС называют мицеллой. Внутреннюю часть мицеллы составляет агрегат основного вещества <[SiO2]m>, на поверхности которого расположены потенциалообразующие ионы <ОН - >. Агрегат с потенциалообразующими ионами образуют ядро мицеллы <[SiO2]mnOH — >. Ядро с противоионами плотной части ДЭС составляет гранулу <[Si02]mnOH — (n-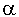
При тепловом движении молекул коллоидные частицы вовлекаются в молекулярно-кинетическое движение среды. Это явление было обнаружено в 1927 г. английским ботаником Робертом Броуном, наблюдавшим в микроскоп непрерывное движение (броуновское движение) очень мелких частичек — спор цветочной пыльцы, взвешенных в воде. В настоящее время теоретически и экспериментально доказано, что молекулы среды (жидкости или газа) сталкиваются с частицей дисперсной фазы, в результате чего она получает огромное число ударов со всех сторон (более 10 20 толчков/с). При больших размерах частицы результирующий импульс огромного числа ударов со всех сторон согласно соответствующему закону статически оказывается равным нулю, и частица большой массы и инерционности не будет двигаться под действием теплового движения молекул. Очень малые частицы имеют значительно меньшую массу и поверхность, на которую будет приходиться гораздо меньшее число ударов, поэтому увеличивается вероятность неравномерности распределения импульсов с разных сторон, в результате чего частица приобретает колебательное и поступательное движение.
Эйнштейн (1905 г.) и Смолуховский (1906г.) независимо друг от друга, постулируя единство броуновского и молекулярно-кинетического движений, установили количественную связь между средним сдвигом частицы А (называемым иногда амплитудой смещения) и коэффициентом диффузии D за время r:
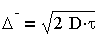 | 3.7 |
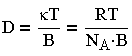 | 3.8 |
где k-постоянная Больцмана; Na — число Авогадро; В — коэффициент трения; Т — температура. Уравнение (3.7) в предположении применения закона Стокса к движению частиц:
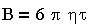 | 3.9 |
трансформируется к виду:
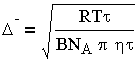 | 3.10 |
Из уравнения (3.10) следует, что частицы перемещаются тем быстрее, чем меньше размер частиц г, вязкость жидкой фазы и чем выше температура.
При движении коллоидных частиц в жидкости, т. е. при относительном перемещении фаз, происходит разрыв ДЭС по плоскости скольжения. Часть диффузного слоя захватывает частица, а часть ионов остаются в растворе, в результате чего устанавливается разность потенциалов между движущейся коллоидной частицей и окружающей ее средой на поверхности скольжения при отрыве части диффузного слоя. Потенциал на поверхности скольжения называется электрокинетическим, потенциалом или s (дзета) — потенциалом.
Значение дпотенциала всегда меньше потенциала ДЭС, и это различие тем больше, чем меньше толщина диффузной части слоя (рис. 3.2). Поэтому такие факторы, как понижение температуры, введение в раствор электролита (C3>C2>C1), не взаимодействующего с поверхностью, а также увеличение заряда его ионов, снижая толщину диффузного слоя, уменьшают электрокинетический потенциал.
Электрокинетические характеристики системы зависят в большой степени от свойств поверхности контактирующих фаз и рН среды, поскольку ионы H + и ОН — обладают высокой специфической адсорбционной способностью.
Так, многие неорганические оксиды (кремния, железа, алюминия) характеризуются активной поверхностью, содержащей ионогенные группы, диссоциация которых в зависимости от рН раствора, как отмечалось, определяет заряд поверхности. Потенциал таких коллоидных оксидов может достигать 100 мВ, а при изменении рН среды в интервале выше и ниже значения рНиэ возможна перезарядка фазы.
На инертных поверхностях (графите, масле и др.), лишенных ионогенных групп, заряд возникает в результате специфической адсорбции ионов.
Экспериментально значение электрокинетического потенциала определяют методом электрофореза, используя модифицированное расчетное уравнение Гельмгольца — Смолуховского:
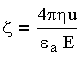 | 3.11 |
где u — средняя линейная скорость движения частиц; Е — градиент потенциала внешнего электрического поля. Отношение u/Е при электрофорезе называют электрофоретической подвижностью и эф. Для расчета потенциала, В, на коллоидных частицах, находящихся в разбавленных водных растворах при 20°С, используют соотношение:
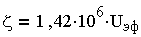 | 3.12 |
где UЭф выражена в м 2 /(c*В); опытные значения UЭф достигают 5*10 -8 м 2 /(c*В), а в соответствии с (3.12) -потенциал коллоидов природных вод составляет около 70 мВ.
Коллоидные системы в природных водах имеют обычно одинаковый отрицательный заряд и характеризуются агрегативной устойчивостью , т.е. стабильностью дисперсности, распределением по объему и взаимодействием между частицами. Потеря агрегативной устойчивости дисперсной системой, заключающаяся в слипании частиц, представляет собой, как отмечалось, коагуляцию. которая приводит в конечном счете к расслоению фаз.
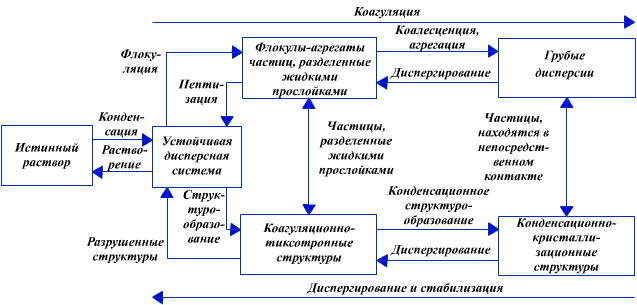
Схема переходов дисперсных систем в различные состояния представлена на рис. 3.3. Устойчивая дисперсная фаза, равномерно распределенная по всему объему, может образовываться в результате конденсации из истинного раствора. Потеря агрегативной устойчивости при воздействии на систему — первый этап коагуляции заключается в сближении коллоидных частиц и взаимной их фиксации на небольших расстояниях, разделенных прослойками среды, с образованием так называемых флокул, в которых частицы обладают относительной подвижностью при воздействии относительно небольших сил. Обратный процесс разрушения флокул называется пептизацией .
Рис 3.3. Схема процессов протекающих в дисперсных системах
Более глубокий процесс коагуляции приводит к разрушению прослоек жидкости и непосредственному контакту частиц с образованием жестких структур из твердых частиц (или слиянию жидких, например нефтепродуктов, называемому коалесценцией). Разрушения образовавшихся структур можно достичь только принудительным диспергированием. Таким образом, в ходе коагуляции осуществляется ряд процессов структурообразования, протекающих с уменьшением удельной поверхности системы. Каждая промежуточная структура имеет свои свойства.
При рассмотрении агрегативной устойчивости и скорости коагуляции коллоидных систем различают ряд факторов устойчивости. В реальных системах действуют смешанные факторы, проявляющиеся как совокупность термодинамических (снижающих межфазное натяжение) и кинетических факторов (проявление свойств межчастичных прослоек).
Несмотря на отсутствие количественной теории агрегативной устойчивости, в настоящее время разработана достаточно детально электростатическая теория устойчивости, ряд положений которой рассматривается ниже.
Между коллоидными частицами одного знака заряда (содержащиеся в природной воде органические примеси, в том числе железосодержащие, и коллоидная кремнекислота заряжены отрицательно) действуют молекулярные силы притяжения (силы Ван-дер-Ваальса) и электростатические силы отталкивания (кулоновское взаимодействие). Таким образом, стабильность (устойчивость) дисперсной фазы и ее коагуляция определяются соотношением между силами притяжения и отталкивания частиц.
В наиболее общем виде теория взаимодействия частиц была разработана советскими учеными Б.В.Дерягиным и Л.Д.Ландау в 1937-1941 гг. и несколько позже независимо от них голландскими учеными Фервеем и Овербеком. По первым буквам фамилий этих ученых теория взаимодействия и коагуляции дисперсных частиц получила сокращенное название ДЛФО. Простейший случай этой теории рассматривает взаимодействие без учета теплового движения двух крупных частиц, у которых толщина ДЭС значительно меньше размера частиц, что позволяет перейти к оценке взаимодействия двух плоских параллельных пластин.
Суммарная энергия взаимодействия пластин, приходящаяся на единицу площади, складывается из энергии электростатического отталкивания и молекулярного притяжения UМ:
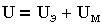 | 3.13 |
Количество энергий зависит от расстояния h между пластинами:
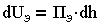 | 3.14 |
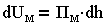 | 3.15 |
где Пэ, Пм — давления отталкивания и притяжения, являющиеся составляющими расклинивающего давления.
Понятие расклинивающего давления в теории агрегативной устойчивости было введено Б. В. Дерягиным в 1935 г. Оно возникает при сильном уменьшении толщины пленки при взаимодействии сближающихся поверхностных слоев и обусловливается сближением как фаз так и межфазных слоев. Расклинивающее давление можно рассматривать как избыточное давление, которое нужно приложить к пленке, чтобы сохранить ее равновесную толщину, поэтому отталкивание поверхностных слоев (Пэ) рассматривается как положительное, а притяжение (сжатие пленки Пм) — как отрицательное.
В теории ДЛФО принято, что давление отталкивания характеризуется только электростатическими силами, поэтому
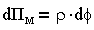 | 3.16 |
В соответствии с теорией Гуи — Чепмена изменение потенциала (рис. 3.1) соответствует уравнению:
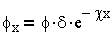 | 3.17 |
Интегрирование уравнения (3.16) в пределах от 2 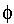
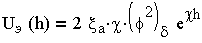 | 3.18 |
Из (3.18) следует, что UЭ(h) уменьшается с увеличением расстояния по экспоненциальному закону.
Энергия притяжения частиц в теории ДЛФО определялась суммированием взаимодействий между атомами и молекулами. В основу вывода этого уравнения положено уравнение адсорбционного притяжения (Uадс) одной молекулы к поверхности адсорбента (в данном случае частицы). Энергия молекулярного притяжения пластин в среде описывается уравнением: table>
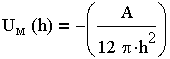 | 3.19 |
где A — константа Гамакера. Эта константа учитывает природу взаимодействующих тел, выражается в единицах энергии (порядка 10 -19 Дж) и слагается из отдельных констант, характеризующих свойства дисперсной фазы и среды.
Уравнение (3.19) показывает, что энергия притяжения пластин (частиц) обратна квадрату расстояния между ними, т. е. она уменьшается значительно медленнее с расстоянием, чем энергия притяжения между молекулами (атомами), которая обратно пропорциональна расстоянию в шестой степени. Отсюда следует, что коллоидные частицы взаимодействуют на более далеких расстояниях, чем молекулы.
Зная закономерности для энергии отталкивания и энергии притяжения частиц, простым сложением получаем общую удельную энергию взаимодействия между параллельными пластинами (частицами):
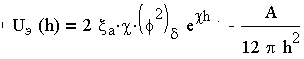 | 3.20 |
Энергия взаимодействия сферических частиц вычисляется по более сложным уравнениям, примером которых может служить уравнение (3.21). полученное для частиц с низким потенциалом (характерным для коллоидных систем природных вод) и радиусом частиц существенно превышающим толщину диффузного слоя :
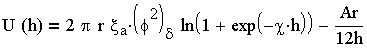 | 3.21 |
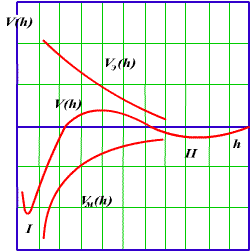
Уравнение (3.20), полученное в соответствии с теорией ДЛФО, характеризует поведение дисперсных систем, устойчивость которых или коагуляция определяется значением и знаком общей потенциальной энергии взаимодействия частиц. Характер изменения энергии отталкивания Uэ(h) и энергии притяжения Uм(h) показан на рис.3.4.
Рис 3.4. Потенциальные кривые взаимодействия коллоидных частиц
Результирующая кривая u(h) получена путем геометрического сложения соответствующих ординат. Напомним, что положительная энергия отталкивания уменьшается с увеличением расстояния по экспоненциальному закону, а отрицательная энергия притяжения Uм(h) обратно пропорциональна квадрату расстояния. В результате при h>0 иэ Uэ-const, Uм=-оо и при больших расстояниях, когда экспонента убывает значительно быстрее, чем степенная функция, между частицами преобладает энергия притяжения (I и II энергетические минимумы), а на средних расстояниях, соответствующих толщине ДЭС,-энергия отталкивания, представляющая собой потенциальный барьер, препятствующий слипанию частиц. Потенциальный барьер возрастает с увеличением [см. (3.21)], и, как показывает практика, при 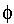
=70мВ. С учетом того, что
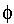
(т.е. больше 70 мВ), они характеризуются высоким потенциальным барьером и большой агрегативной устойчивостью.
В рассмотренном упрощенном варианте теории ДЛФО не учитывается размер частиц и их форма, однако с учетом уравнения взаимодействия сферических частиц (3.21) можно видеть, что высота электростатического барьера и, как следствие, устойчивость к коагуляции повышаются с ростом радиуса частиц (в первом приближении пропорционально радиусу). Одновременно с этим увеличение размера частиц приводит к увеличению второго энергетического минимума, что подтверждается наличием процессов дальней агрегации в грубодисперсных системах.
Хотя электростатическая теория устойчивости дисперсных систем рассматривает лишь один электростатический фактор устойчивости, этот фактор наиболее характерен для коллоидных систем в водных средах, создающих условия для их стабильности.
Теория ДЛФО позволяет утверждать, что все факторы, которые определяют высоту энергетического барьера, зависящую от электрического потенциала, и толщину ДЭС (поверхностная диссоциация, количество адсорбированных потенциалообразующих ионов и прочность их закрепления, а также взаимодействия противоионов с поверхностью, определяющие толщину ДЭС), играют основную роль в агрегативной устойчивости реальных коллоидных систем. Уменьшение же потенциала или сжатие диффузной части ДЭС приведет к протеканию соответственно нейтрализационной или концентрационной коагуляции.
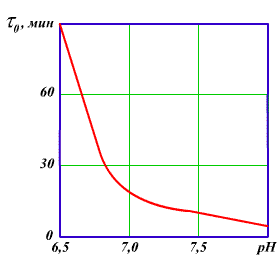
Это подтверждено многочисленными экспериментальными и промышленными данными. Однако в практике водоподготовки осуществление коагуляционных процессов с использованием электролитов для уменьшения дзета — потенциала приводит к необходимости снижения рН при коагуляции природных вод и повышению их солесодержания, что недопустимо по технико — экономическим соображениям с учетом последующей стадии полного или частичного удаления ионизированных примесей из обрабатываемой воды. При подготовке добавочной воды используют вариант коагуляции, связанный с взаимной коагуляцией разнородных дисперсных систем — гетерокоагуляцией. Гетерокоагуляция происходит тем эффективнее, чем полнее произойдет нейтрализация зарядов частиц в смешиваемых дисперсных системах с противоположными знаками заряда коллоидных частиц природных вод (обычно заряженных отрицательно) и искусственно созданной коллоидной системой с положительным зарядом. Предварительная очистка природных и сточных вод от коллоидных примесей методом коагуляции производится добавлением минеральных солей с гидроизолирующими катионами (коагулянтов), анодным растворением металлов или изменением рН среды в тех случаях, когда в сточных водах содержатся в достаточном количестве катионы, способные при гидролизе образовывать труднорастворимые соединения. В качестве коагулянтов применяются обычно сульфат алюминия [А12(S04)3* 18Н20] или сульфат железа (FeS04*7H20), причем последний реагент используют при совмещении процессов коагуляции и известкования (содоизвесткования). Это связано с тем, что окисление Fe 2+ кислородом, растворенным в обрабатываемой воде, происходит медленно и скорость окисления до-стигает практически приемлемого значения лишь при рН>8 (рис. 3.5).
Рис 3.5.Зависимость времени окисления двухвалентного железа кислородом от pH воды
Необходимость окисления и, следовательно, достижения полноты гидролиза вытекает из сопоставления произведений растворимости гидроксидов металлов, значения которых при температуре 18°С для Fе(ОН)3 равны 3.8-10 -38 , Fe(OH)2 4.8-10 -16 и для А1(ОН)з 1,9-10 -33 .
| Al2(SO4)3=2Al 3+ +3SO 2- 4 | 3.22 |
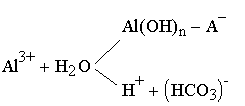 | 3.23 |
Схема включает наряду с диссоциацией и собственно гидролизом три сопутствующие реакции: 1) нейтрализацию ионов водорода, образовавшихся при гидролизе (Н + +НСО3 — ); 2) формирование гидроксидбикарбонатных соединений алюминия [А1(ОН)n + НСО3 — ] из-за конкуренции ионоНСО3 — и ОН — за координационные участки А1 3+ ; 3) возникновение основных солей алюминия с другими анионами воды [А1(ОН) — + А) — ], например оксисульфатов типа A10HS0)—, за счет поверхностных ионообменных реакций. Состояние рассматриваемой системы характеризуется определенным динамическим равновесием, связанным с условиями обработки воды.
При щелочности воды более 1.0-1.5 мг-экв/кг не возникает затруднения в отводе из сферы реакции образующихся катионов Н + , поэтому разность между щелочностями исходной и обработанной воды близка к расчетной. В этом случае щелочность уменьшается на значение, равное дозе коагулянта. В тех случаях, когда щелочность обрабатываемой воды недостаточна для связывания образующихся при гидролизе коагулянта ионов Н + (например, в паводковый период), необходимо воду подщелачивать для достижения полноты гидролиза всего введенного коагулянта.
После ввода коагулянта в обрабатываемой воде через несколько минут появляются хлопья белого или желтого цвета, однако до образования видимых хлопьев частицы А1(ОН)3 проходят коллоидную фазу дисперсности и характеризуются положительным знаком заряда. На этой скрытой стадии коагуляции происходит главным образом сложный комплекс процессов очистки воды от коллоидных примесей: взаимная коагуляция разноименно заряженных коллоидов при взаимодействии дестабилизированными участками поверхности (гетерокоагуляции), электролитная коагуляция под влиянием ионов SO4 2- и образующихся в первый момент ионов А 3+ , способствующих сжатию ДЭС коллоидных частиц. В дальнейшем микрохлопья сцепляются, захватывая грубодисперсные примеси и воду и образуя коагуляционную структуру в виде хлопьев (флокул) размером 0,5-3 мм с плотностью 1,001-1,1 т/м 3 (рис. 3.6).
Рис 3.6.Схема кофгуляционной структуры
Макрофаза затем выделяется из воды в аппаратах для коагуляции — осветлителях или при проведении прямоточной коагуляции — на поверхности фильтрующего материала механических фильтров.
Количественная теория кинетики коагуляции была создана М.Смолуховским, рассмотревшим скорость коагуляции монодисперсных золей со сферическими частицами, которые сталкиваются между собой под действием броуновского движения. Критическое расстояние взаимодействия частиц принято равным сумме радиусов частиц, что соответствует их непосредственному контакту. Согласно представлению М. Смолуховского взаимодействия происходят только между двумя частицами — одиночными, одиночными с двойными, двойными друг с другом и т. д., что позволяет представить процесс коагуляции аналогичным протеканию бимолекулярных химических реакций и использовать соответствующий математический аппарат.
Для скорости увеличения числа fix скоагулированных частиц, зависящей от начальной концентрации частиц По, интенсивности их броуновского движения, радиуса действия сил притяжения и эффективности соударений, Смолуховским получено следующее выражение, соответствующее реакции второго порядка:
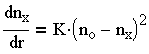 | 3.24 |
в котором К — константа скорости коагуляции, выраженная в общем виде пропорциональной распределению Больцмана:
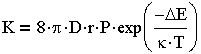 | 3.25 |
где D — коэффициент диффузии одиночных частиц; г-радиус частицы; Р-стерический фактор, учитывающий расположение частиц при столкновении, их форму, размеры; k — постоянная Больцмана; 
В теории коагуляции различают быструю и медленную коагуляцию. При быстрой коагуляции все столкновения частиц эффективны, т.е. приводят к слипанию частиц, что отвечает условию 
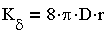 | 3.26 |
Для медленной коагуляции, при которой не все столкновения эффективны, 
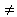
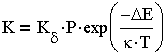 | 3.27 |
Отношение К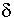

Возвратившись к (3.24) и обозначив nо — nх в единице объема за временный интервал r через nr, получим:
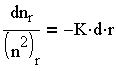 | 3.28 |
и после интегрирования выражения (3.28) имеем:
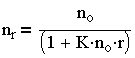 | 3.29 |
Из — за трудности теоретического определения константы скорости коагуляции Смолуховский ввел понятие периода половинной коагуляции (времени уменьшения концентрации частиц до половины от начальной). Из (3.29) следует:
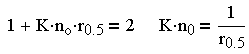 | 3.30 |
и
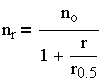 | 3.31 |
Выражение (3.31), несмотря на известные допущения в теории М. Смолуховского, нашло экспериментальное подтверждение и широко используется для обработки экспериментальных данных по кинетике коагуляции в монодисперсных системах.
В реальных полидисперсных системах коагуляция протекает быстрее: крупные частицы способствуют коагуляции более мелких. Экспериментально было установлено, что скорость объединения относительно мелких частиц (7-11 мкм) с более крупными (60 мкм) в турбулентном потоке была на несколько порядков выше, чем скорость коагуляции только мелких частиц. Этот факт объясняется различием в механизме встречи частиц — инерционным в случае полидисперсной системы и диффузионным в случае монодисперсной.
Практика эксплуатации водоочистных установок свидетельствует о том, что при любых исходных условиях полнота удаления коллоидных и грубодисперсных частиц в осветлителях при коагуляции зависит от оптимальной скорости, создаваемой при перемешивании воды в камере хлопьеобразования. Причем для каждой заданной скорости устанавливается равновесие между вероятностью образования хлопьев и их средним размером.
Вопросы и предложения направляйте в службу поддержки
http://www.trotted.narod.ru/collchem/lec-9.htm
http://twt.mpei.ac.ru/ochkov/VPU_BOOK/ch3.htm