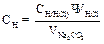Установка титра рабочего раствора соляной кислоты по раствору буры.
1. Бюретку ополаскивают, а затем заполняют раствором соляной кислоты до нулевой черты.
2. Пипетку (объем пипетки=10 мл) с раствором буры переносят в коническую колбу для титрования, добавляют 1-2 капли метилового оранжевого и титруют при перемешивании по каплям из бюретки соляной кислотой до изменения окраски индикатора из желтой в оранжево-розовую.
В точки эквивалентности рН раствора будет меньше 7, так как образуется слабая борная кислота, поэтому при титровании следует использовать индикатор, меняющий свою окраску при рН 7).
Чтобы правильно установить момент изменения окраски индикатора, рядом с титруемым раствором помещают контрольный раствор, называемый «свидетелем».
Для его приготовления берут в такую же колбу 10 мл воды и прибавляют 1 каплю метилоранжа и из бюретки одну каплю раствора соляной кислоты, чтобы окраска индикатора изменилась из желтого в оранжево-розовый цвет.
Титрование раствора буры продолжают до тех пор, пока от одной капли соляной кислоты титруемый раствор примет оранжево-розовый цвет, как у «свидетеля».
Результаты титрования заносят в журнал:
10 мл — оранжевый
3.Вычисляют молярную концентрацию эквивалента (нормальную концентрацию) соляной кислоты по формуле:
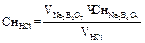
Титр соляной кислоты вычисляют по формуле:
Все вычисления должны быть сделаны с точностью до четырех значащих цифр.
Контрольная задача.
Определение содержания соды Na2CO3 в растворе.
Реактивы: стандартизированный раствор соляной кислоты, индикатор метиловый оранжевый, анализируемый раствор соды (Na2CO3).
Вследствие гидролиза раствора соды имеет щелочную реакцию и может быть оттитрован соляной кислотой.
Уравнение, лежащее в основе титриметрического определения:
Выбор индикатора
При титровании соды соляной кислотой в точке эквивалентности образуется соль и слабая угольная кислота, рН
Ход определения
1. Доводят объем полученной задачи (р-р Na2CO3) до 100 мл водой, перемешивают.
2. Отбирают аликвотную часть раствора пипеткой (10. 0 мл) и переносят в колбу для титрования. Добавляют одну каплю метилового оранжевого .
3. Заполняют бюретку стандартизованным раствором НС1.
4. Раствор соды в колбе титруют при перемешивании по каплям из бюретки раствором соляной кислоты до изменения окраски индикатора из желтой в оранжево-розовую. Титрование проводят в присутствии «свидетеля». Титрование повторяют 3 раза, результаты записывают в журнал.
V Na2CO3 , мл V HCl , мл индикатор
10 мл — оранжевый
5. вычисление граммового содержания соды в растворе:
Молярная концентрация эквивалента раствора соды :
Вычисление граммового содержания соды в растворе:
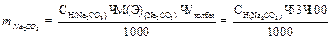
Расчет титра НС1 по Na2CO3 (сколько граммов Na2CO3 соответствует 1 мл раствора НС1 с данной нормальностью):
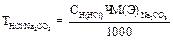
Вычисление граммового содержания соды в растворе 100 мл :
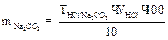
Вопросы к разделу
1. Что называется точкой эквивалентности?
2. В каких случаях точка эквивалентности лежит при рН>7, pH=7 и pH
10. Рассчитать начало и конец скачка при титровании 0,01 н раствора NH4OH 0,01 н раствором HCl и подобрать индикатор. Может ли в данном случае в качестве индикатора применяться фенолфталеин?
11. Можно ли приготовить раствор кислоты точно заданной концентрации по навеске кислоты?
12. Почему не следует брать много индикатора при титровании?
13. Почему необходимо предварительно опаласкивать пипетку и бюретку тем раствором, которым их будут заполнять?
14. Что такое метод замещения и метод обратного титрования?
15. Можно ли фосфорную кислоту титровать как трехосновную?
Приготовление стандартного раствора тетрабората натрия (буры). Записать уравнение гидролиза и взаимодействия буры с раствором соляной кислоты.
| 🎓 Заказ №: 22216 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Приготовление стандартного раствора тетрабората натрия (буры). Записать уравнение гидролиза и взаимодействия буры с раствором соляной кислоты. Задача: Для нейтрализации раствора, содержащего 0,2055 г Na2CO3, израсходовано 40.00 мл раствора H2SO4. Определить нормальность и титр раствора серной кислоты.
Решение: Тетраборат натрия должен быть свежеперекристаллизованным и отвечать формуле Na2B4O7∙10H2O. Рассчитывают массу навески тетрабората натрия. Навеску тетрабората натрия отвешивают на аналитических весах, используя часовое стекло. Навеску тетрабората натрия через воронку, обмывая стекло горячей дистиллированной водой, количественно переносят в мерную колбу и растворяют в горячей дистиллированной воде. После полного растворения навески мерную колбу охлаждают под краном и доводят объем раствора о метки дистиллированной водой. Стандартизируют приготовленный раствор по стандартному расвору хлороводородной (соляной) кислоты Тетраборат натрия гидролизуется по двум ступеням Na2B4O7 H2O NaHB4O7 NaOH NaHB4O7 H2O H2B4O7 NaOH Реакция нейтрализации тетрабората натрия соляной кислотой: Na B O 2HCl 5H O 4H BO 2NaCl 2 4 7 2 3 3 Согласно закону эквивалентов количества эквивалентов взаимодействующих веществ равны друг другу
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Тренажер задания 31 по химии меди
Тренажер задания 31 из ЕГЭ по химии меди, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии меди с текстовыми решениями и ответами.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
CuO + CO → Cu + CO2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
CuO + CO → Cu + CO2
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
http://lfirmal.com/%D0%9F%D1%80%D0%B8%D0%B3%D0%BE%D1%82%D0%BE%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5-%D1%81%D1%82%D0%B0%D0%BD%D0%B4%D0%B0%D1%80%D1%82%D0%BD%D0%BE%D0%B3%D0%BE-%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B0/
http://chemege.ru/zadaniye-31-medi/