Модифицирование хлопковой целлюлозы лимонной кислотой
Ивановский государственный химико-технологический университет
Ивановский государственный химико-технологический университет
NovaInfo31
Опубликовано 12 февраля 2015
Раздел: Технические науки
Просмотров за месяц: 6
CC BY-NC
Аннотация
Исследовано влияние концентрации лимонной кислоты, использованной для модифицирования, на увеличение сорбционной емкости хлопковой целлюлозы. Эффективность прививки карбоксильных групп подтверждено потенциометрическим титрованием и по сорбции метиленового голубого. Обработка хлопковой целлюлозы лимонной кислотой приводит к увеличению сорбционной способности сорбента по отношению к тяжелым металлам, что подтверждено методом атомно-абсорбционной спектроскопии.
Ключевые слова
Текст научной работы
Введение
С ростом внимания к «экологически чистой» политике природные биополимеры растительного происхождения активно исследуются для получения материалов, обладающих рядом ценных свойств, благодаря которым они могут быть использованы в химической, фармацевтической, пищевой и многих других отраслях промышленности. Особый интерес представляет собой возможность использования возобновляемого сырья в производстве материалов и продуктов, предназначенных для улучшения экологии окружающей среды и решения проблем, связанных с техногенным загрязнением водных сред ионами различных тяжелых металлов.
Сорбционный метод очистки водных растворов различной природы является одним из наиболее эффективных. Основным недостатком синтетических сорбентов является высокая стоимость, обусловленная многостадийностью процессов их получения. Кроме того, при их промышленном синтезе в качестве исходных соединений используют токсичные вещества (бензол, фенолы и др.), а источником ионообменных сорбентов является невозобновляемое органическое сырье. Альтернативу таким сорбентам представляют материалы на основе целлюлозы, которые, однако, обладают сравнительно невысокой сорбционной емкостью.
В связи с этим целью данной работы является разработка сорбента за счет модифицирования хлопковой целлюлозы, которая является недорогим возобновляемым полимером, обладающим уникальными свойствами, такими как биодеградируемость и нетоксичность.
Литературный обзор
В литературе имеется много публикаций [1 — 12], посвященных использованию в качестве сорбентов целлюлозосодержащего сырья, не подвергнутого предварительной обработке. Для очистки водных сред от ионов Pb(II), Cd(II), Hg(II), Cu(II), Ni(II), Cr(III) и Cr(VI) применяют разнообразные сельскохозяйственные побочные продукты. Данные материалы являются доступными и имеют низкую стоимость. Величины сорбции в зависимости от вида сырья могут составлять для ионов Cu(II) — от 0,3 до 14,3 мг/г, а для ионов Cd(II) и Cr(III) — от 0,4 до 10,8 мг/г и от 1,47 до 11,9 мг/г соответственно [1].
Таким образом, побочные продукты и отходы сельскохозяйственного производства в нативном состоянии являются перспективными сорбентами для загрязненных вод промышленных предприятий и пищевых сред от ионов тяжелых металлов. К их достоинствам можно отнести доступность, низкую стоимость, возобновляемость, безопасность — они являются экологически чистыми и биологически инертными по отношению к очищаемым средам. Но такие сорбенты обладают невысокими кинетическими характеристиками и сравнительно низкой сорбционной емкостью [4]. Поэтому актуальной является задача создания новых высокоэффективных сорбентов из полимеров на основе целлюлозы путем модификации с использованием доступных недорогих реагентов и простых технологических операций.
Основными методами активации целлюлозосодержащих сорбентов являются: механические, физические, химические и физико-химические. Перспективным направлением обработки сорбентов является применение методов нано- и биотехнологии. Один из перспективных направлений модификации целлюлозы — синтез привитых сополимеров.
Изучив литературные данные по сорбции ионов тяжелых металлов различными растительными материалами, можно сделать вывод о том, что целлюлозосодержащие побочные продукты сельскохозяйственной, текстильной и деревообрабатывающей промышленности способны адсорбировать ионы металлов не хуже, чем промышленные сорбенты (иониты, активированные угли, цеолиты и другие). Широкий спектр методов модифицирования растительного сырья позволяет получать эффективные экологически чистые и биологически инертные сорбенты [9].
Экспериментальная часть
В качестве сорбента была выбрана хлопковая целлюлоза (ГОСТ 595-79), предварительно обработанная 5 %-м раствором NaHCO3 при кипячении для очистки от примесей и высушенная до постоянного веса. Сухие образцы целлюлозы имели влажность 5 %.
Для обработки целлюлозосодержащего сорбента была использована лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая) НООС-СН2-С(ОН)СООН-СН2-СООН с рабочими концентрациями 0,5 и 1 моль/л.
Суть модифицирования заключается в создании необходимых условий для реакции между ангидридом модифицирующего агента (кислоты) и хлопковой целлюлозы. В целом, данный способ состоит из 3 основных этапов: подготовка реагентов, химическое модифицирование, очитка модифицированной целлюлозы от непрореагировавших реагентов.
Химическая модификация была проведена в соответствии с методикой, описанной в литературе 15 с изменением концентрации лимонной кислоты.
Обработанную NaHCO3 хлопковую целлюлозу заливают раствором лимонной кислоты заданной концентрации. После перемешивания в течение 30 мин при 20оС, раствор кислоты сливают, хлопковую целлюлозу помещают в фарфоровую чашку и подвергают сушке при 50оС в сушильном шкафу в течение 4 часов.
После сушки термохимическая реакция между кислотой и целлюлозой происходит за счет повышения температуры до такого значения, при котором карбоновая кислота переходит в ангидрид. Время обработки составляет 2 часа.
После охлаждения продукты реакции промывают дистиллированной водой до нейтральной реакции, чтобы удалить избыток кислоты.
Количество карбоксильных групп в сорбенте определяли классическим методом, основанным на взаимодействии кислотных групп с ацетатом кальция и титриметрическом определении выделившейся уксусной кислоты [18]. Ее содержание, отнесенное к единице массы, принимают равной величине карбоксильной кислотности.
Сначала целлюлозу переводили в Н- форму, для чего навеску сорбента массой 1 г заливали 100 мл 0,1 н раствора соляной кислоты и выдерживали при перемешивании 30 мин до достижения равновесия. Полученный образец отделяли от раствора фильтрованием, тщательно промывали до нейтрального рН и высушивали.
Затем навеску целлюлозы массой 0,1 г, взвешенную с точностью до 0,0001 г, помещали в коническую колбу емкостью 100 мл, заливали 50 мл 0,1 н раствора ацетата кальция и выдерживали при перемешивании в течение 30 мин.
При этом протекает следующая реакция (1):
2Cell-COOH + (CH3COO)2Ca ↔ Cell-(COO)2Ca + 2 CH3COOH. (1)
Содержание уксусной кислоты определяли методом потенциометрического титрования, для чего отбирали пробу раствора объемом 25 мл и титровали ее 0,02 н раствором NaOH. Количество карбоксильных групп рассчитывали по следующей формуле:
\left[-COOH \right]=\frac<(V_<1>-V_<2>)\cdot n>
где n — нормальность раствора NaOH; V1 — количество NaOH, пошедшее на титрование в основном опыте; V2 — количество NaOH, пошедшее на титрование в контрольном опыте; m — навеска целлюлозы с учетом влажности.
Оценку содержания карбоксильных групп в целлюлозных материалах проводили по сорбции метиленового голубого из его водных растворов [19]. Метод определения карбоксильных групп целлюлозы с метиленовым голубым (МГ) основан на связывании карбоксильными группами основных красителей. Количество связанного СООН- группами МГ определяли по снижению его концентрации в водном растворе. Основные характеристики: рабочий диапазон 190-1100 нм; фотометрическая точность ±0,002.
Предварительно было определено, что максимум оптической плотности используемых растворов красителя приходится на 665 нм, и все измерения проводили при этой длине волны. Для ряда рабочих растворов МГ с концентрациями в диапазоне 0,1-10 мг/л были сняты их спектры в видимой области, определены значения оптической плотности и построен градуировочный график, который использовался для определения концентраций раствора красителя по измеряемой величине оптической плотности исходных и равновесных растворов. Были получены изотермы сорбции МГ хлопковой целлюлозы, для чего в серию пробирок помещали навески (m) целлюлозосодержащего материала по 0,1 г, заливали их 10 мл (V) водного раствора МГ с начальными концентрациями (Со) 1,5∙10-4 — 1,5∙10-2 моль/л и выдерживали до достижения состояния равновесия при температуре 293°К. Затем раствор отделяли от сорбента фильтрованием и определяли в нем равновесную концентрацию МГ (Сe).
Сорбционную емкость (А) в условиях установившегося равновесия в системе рассчитывали по формуле (3):
Определяемое значение предельной, или максимальной сорбции А (в моль/кг), соответствует содержанию карбоксильных групп полисахаридного материала.
Изучение процесса сорбции ионов тяжелых металлов проводили из водных растворов сульфата металла при перемешивании.
Концентрацию ионов металла определяли согласно стандартной методике по ГОСТ 4388-72 «Вода питьевая. Методы определения массовой концентрации меди». Методика ГОСТ 4388-72 основана на взаимодействии ионов двухвалентной меди с диэтилдитиокарбоматом натрия в слабоаммиачном растворе с образованием диэтилдитиокарбомата меди, окрашенного в желто-коричневый цвет. В разбавленных растворах диэтилдитиокарбомат натрия образует коллоидные растворы, для большей устойчивости которых добавляют раствор крахмала. Для устранения мешающего влияния железа и жесткости воды добавляют раствор сегнетовой соли.
Массовую концентрацию меди (Х) в мг/дм3, вычисляют по формуле (4):
где С — концентрация меди, найденная по градуировочному графику, мг/дм3; V — объем пробы, взятый для определения, см3.
Суммарная погрешность определения меди не превышает ±25% при доверительной вероятности 0,95.
Сорбционную емкость (Аτ) сорбентов в каждый данный момент времени рассчитывали по формуле (5):
Степень извлечения определяли следующим образом (6):
В условиях установившегося равновесия в системе определяли равновесную концентрацию ионов металла в растворе (Се) и рассчитывали равновесную сорбционную емкость биосорбентов (А) по формуле (3).
Обсуждение результатов
При обработке хлопковой целлюлозы растворами лимонной кислоты, происходит прививка карбоксильных групп. При установлении механизма сорбции необходимо учитывать наличие карбоксильных групп в структуре целлюлозного сорбента. Полученные данные позволят оценить предельную ионообменную емкость хлопковой целлюлозы и соответственно эффективность обработки.
Карбоксильные группы могут присутствовать в целлюлозе преимущественно в качестве концевых групп, образующихся за счет окисления карбонильных групп на концах макромолекул (7).
При этом образуются карбоновые кислоты, в α — положении которых имеются электроноакцепторные заместители, способные за счет действия отрицательного индукционного эффекта понижать рКа по сравнению с уксусной кислотой на единицу и более [19].
Для целлюлозного сорбента наиболее оправдана структура α — гидроксикарбоновых кислот, т. е. когда в α — положении находится ОН — группа (8):
R–СН(ОН) –СООН ↔ R–СН(ОН) –СОО — + Н+ (8)
Для определения содержания привитых карбоксильных групп в препаратах окисленной целлюлозы предложено большое количество методов. Трудности количественного определения содержания карбоксильных групп объясняются разницей в степени диссоциации СООН- групп, находящихся у различных углеродных атомов элементарного звена, возможностью образования лактонов, а так же недостаточной точностью предлагаемых методов определения.
Потенциометрический метод является наиболее простым методом для определения содержания карбоксильных групп, но, как правило, дает завышенные результаты вследствие наличия в препаратах окисленной целлюлозы карбонильных групп, окисление которых в щелочной среде приводит к появлению СООН- групп.
Величина карбоксильной кислотности составила 0,46 мг–экв/г для сорбента, обработанного раствором лимонной кислоты с концентрацией 0,5 моль/л и 0,51 мг-экв/г для сорбента, обработанного раствором лимонной кислоты с концентрацией 1 моль/л.
Для определения параметров, характеризующих сорбционные свойства хлопковой целлюлозы, обработанной NaHCO3, была использована стандартная методика по ГОСТ 4388-72. Была получена изотерма сорбции ионов Cu(II). Результаты эксперимента представлены на рис. 2 кривая 3.
Рисунок 2. Изотермы сорбции ионов Сu (II) хлопковой целлюлозой: 1. обработанной раствором лимонной кислоты с концентрацией 1 моль/л; 2. обработанной раствором лимонной кислоты с концентрацией 0,5 моль/л; 3. целлюлоза, обработанная NaHCO3
В результате протекания реакции этерификации образуются сложные эфиры целлюлозы и карбоновой кислоты. Механизм данной реакции и условия ее протекания подробно описаны в работах [20 — 22].
Рассмотрим реакцию образования цитрата целлюлозы, оптимальная температура для которой составляет 120°С, поскольку при более высокой температуре протекают процессы декарбоксилирования кислоты. На первой стадии происходит образование ангидрида лимонной кислоты:
Затем ангидрид реагирует с гидроксильными группами целлюлозы с образованием сложного эфира:
Поскольку гидроксильные (–ОН) и алкоксильные (RO–) группы могут находиться в α — положении по отношению к карбоксильной группе, можно сделать предположение об их совместном участии в хемосорбции солей металлов с образованием сольватокомплексных структур хелатного типа. Образование сольватокомплекса данного типа в результате взаимодействия гидроксильных и карбоксильных групп молекул целлюлозы с катионом металла М2+ может быть представлено уравнением (11):
Для определения предельной сорбционной емкости хлопковой целлюлозы, обработанного растворами лимонной кислоты, были получены изотермы сорбции ионов Cu(II) из водного раствора сульфата меди при 293 К (рисунок 1, кривые 2 и 3).
Как видно из рисунка 1, обработка хлопковой целлюлозы лимонной кислотой приводит к увеличению сорбционной способности сорбента, причем больший эффект достигается при концентрации кислоты 1 моль/л.
Предельная сорбционная емкость хлопковой целлюлозы (А∞), обработанной NaHCO3, составляет 0,61 моль/кг; для целлюлозы, модифицированной лимонной кислотой, А∞ составляет 0,77 и 0,82 моль/кг соответственно.
Полученные экспериментальные данные можно описать уравнением изотермы адсорбции Ленгмюра:
где А∞– предельная или максимальная сорбционная емкость полимера по данному металлу, моль/кг; К — концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, л/моль; Се — равновесная концентрация сорбата, моль/л [18].
Линеаризация изотермы сорбции по уравнению (13) позволяет графически определить в уравнении Ленгмюра величины А∞ и К из опытных данных по распределению исследуемого сорбата в гетерофазной системе водный раствор — целлюлозный сорбент.
Результаты обработки изотерм сорбции тяжелого металла хлопковой целлюлозой, модифицированной растворами лимонной кислоты, по модели Ленгмюра, представлены на рис. 6 и в табл. 1.
Уравнение сорбции железа на целлюлозе имеет вид
Библиографическая ссылка на статью:
Никифорова Т.Е., Натареев С.В., Козлов В.А., Дубасова Ю.А. Сорбция ионов тяжелых металлов из водных сред, полисахаридными материалами // Современные научные исследования и инновации. 2017. № 4 [Электронный ресурс]. URL: https://web.snauka.ru/issues/2017/04/81549 (дата обращения: 30.01.2022).
Адсорбции является одним из эффективных методов предотвращения источников техногенных чрезвычайных ситуаций, возникших, например, вследствие аварийного выброса химически опасных веществ на производстве. Среди адсорбентов, применяемых для очистки воды, все большее внимание уделяется поглотителям на основе возобновляемого природного сырья и отходов агропромышленного производства, которые по сравнению с традиционными синтетическими адсорбентами имеют значительно меньшую стоимость. Проводимые в последние годы исследования свидетельствуют, что в побочных продуктах, образующихся в процессе переработки злаков, овощей, фруктов, ягод, орехов и др. в пищевой промышленности, а также в отходах деревообрабатывающей и текстильной промышленности содержатся различные полисахариды (целлюлоза, пектиновые вещества, инулин), способные эффективно связывать ионы тяжелых металлов [1–3]. Использование полисахаридных материалов, представляющих собой отходы агропромышленного комплекса, в качестве сорбентов для извлечения ионов тяжелых металлов из водных сред различной природы является важной задачей при разработке эффективных экологически чистых сорбционных технологий.
Целью работы явилось исследование равновесно-кинетических характеристик полисахаридных материалов, представляющих собой отходы агропромышленного комплекса, по отношению к ионам тяжелых металлов.
Для описания процесса адсорбции применяются различные кинетические модели, включающие модели псевдо-первого и псевдо-второго порядков, модель обратимой реакции первого порядка, модель внешнего массопереноса и модель Еловича [4].
В качестве объектов исследования в работе использованы хлопковая целлюлоза (ГОСТ 595-79), льняное волокно [5], древесные сосновые опилки
[6], стебли топинамбура [7], пшеничные отруби (ГОСТ 7169-88), соевый шрот (ГОСТ 12220-96), соевая мука дезодорированная полуобезжиренная тостированная пищевая (ТУ 92293-013-10126558-96). В качестве источников ионов металлов были выбраны CuSO4∙5 H2O, NiSO4∙7 H2O, ZnSO4∙7H2O, CuCl2∙2 H2O, NiCl2∙6 H2O и ZnCl2 . Для обработки полисахаридных материалов были использованы NaHCO3 и NaОH.
Изучение процесса сорбции ионов тяжелых металлов проводили в статических условиях из водных растворов сульфатов или хлоридов металлов при перемешивании и термостатировании при 293 К.
Кинетику сорбции исследовали методом ограниченного объема раствора [8]. Для получения кинетических кривых сорбции в серию пробирок помещали навески (m) полисахаридного материала по 0,1 г, заливали их 10 мл (V) водного раствора сульфатов или хлоридов металлов с начальной концентрацией (Со) 1,5×10 -4 моль/л и выдерживали от 1 мин до 24 ч при перемешивании и без него при температуре 293 К. Через определенные промежутки времени раствор отделяли от сорбента фильтрованием и определяли в нем текущую концентрацию ионов металлов (Сτ) методом атомно-абсорбционной спектроскопии на приборе «Сатурн». Сорбционную емкость (А) сорбентов в каждый данный момент времени рассчитывали по формуле:
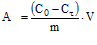
Хлопковую целлюлозу предварительно кипятили в 5 %-м растворе NaHCO3 в течение 30 мин, после чего отжимали, многократно промывали дистиллированной водой до нейтрального значения рН среды и высушивали в сушильном шкафу при температуре 110°С до постоянного веса. Воздушно сухие образцы имели влажность 6-8 %. Стебли топинамбура очищали от внешнего слоя (эпидермиса, пробки, коры, флоэмы), после чего белую губчатую сердцевину, представляющую собой аморфную целлюлозу, высушивали, измельчали и просеивали через сито с диаметром отверстий 300 мкм. Используемые образцы были воздушно сухими c влажностью 6-8 %. Сыпучие полисахаридные материалы, такие как сосновые опилки, пшеничные отруби, соевый шрот высушивали в сушильном шкафу до постоянной массы и измельчали. Измельченные материалы и соевую муку просеивали через сито с диаметром отверстий 300 мкм.
Для определения времени достижения сорбционного равновесия в системе водный раствор сульфата цинка – сорбент были получены кинетические кривые сорбции ионов Zn(II) пшеничными отрубями и соевой мукой. Как видно из рис. 1, равновесие в распределении ионов цинка между раствором и сорбентом без перемешивания устанавливается сравнительно медленно: через 2 ч после начала сорбции в случае пшеничных отрубей и через 8 ч – для соевой муки. Величины сорбционной емкости пшеничных отрубей и соевой муки по отношению к ионам цинка составляют в условиях равновесия соответственно 9,2∙10 -3 моль/кг и 8,4∙10 -3 моль/кг (степень извлечения 61 % и 55 %).
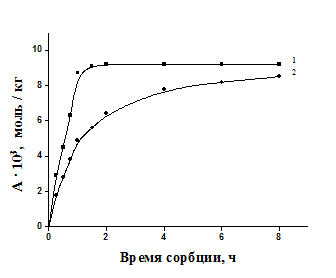
На рис. 2 представлены кинетические кривые сорбции ионов меди из водных растворов CuSO4 хлопковой целлюлозой, древесными опилками и льняным волокном. В сорбции катионов меди целлюлозосодержащими материалами наблюдаются существенные различия как в кинетике, так и в термодинамике процесса сорбции. Равновесие в распределении ионов меди между раствором и сорбентом без перемешивания устанавливается через 40 мин после начала сорбции для льняного волокна, через 30 мин для древесных опилок и через 1 ч – для хлопковой целлюлозы. Величины сорбционной емкости составляют, ммоль∙кг -1 : для льняного волокна – 10,1; для древесных опилок – 9,5; для хлопковой целлюлозы – 7,1.
Наблюдаемые различия равновесно-кинетических характеристик полисахаридных материалов связаны с различным соотношением кристаллических и аморфных участков в их структуре [9]. С увеличением доли аморфной части целлюлозных материалов скорость набухания и количество поглощенной воды возрастают; при этом увеличивается сорбционная способность и к другим гидрофильным соединениям. Это позволяет объяснить наблюдаемые различия в сорбции ионов тяжелых металлов целлюлозосодержащими материалами.
 |  |
| Рис. 2. Кинетика сорбции ионов меди коротким льняным волокном (1), древесными опилками (2), хлопковой целлюлозой (3) |
Исследуемые материалы по убыванию сорбционной способности по отношению к ионам меди располагаются в ряд: короткое льняное волокно > древесные опилки > хлопковая целлюлоза. Этот ряд согласуется с уменьшением доли аморфных участков целлюлозы в данных сорбентах. Таким образом, лучшими сорбционными характеристиками обладают целлюлозосодержащие материалы, способные хорошо набухать в водных растворах, что связано с большей долей аморфных областей в их структуре.
Для определения порядка реакции экспериментальные данные были обработаны с использованием кинетических моделей псевдо-первого и псевдо-второго порядков, которые наиболее часто применяются исследователями при анализе кинетических данных [10].
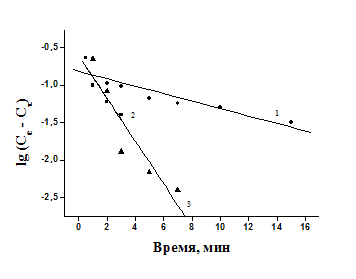
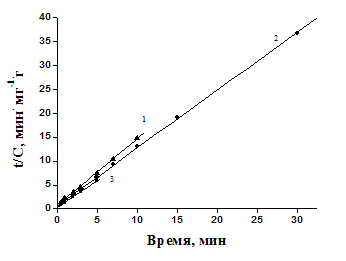
Обработка кинетических кривых сорбции ионов Cu(II) соевым шротом (1), стеблями топинамбура (2) и льняным волокном (3) в рамках моделей кинетики псевдо-первого и псевдо-второго порядка представлена на рис. 3 и 4.
Модель кинетики псевдо-первого порядка (рисунок 3) недостаточно хорошо описывает кинетику сорбции ионов Cu(II) целлюлозосодержащими материалами, о чем свидетельствуют сравнительно невысокие коэффициенты корреляции, полученные при обработке кинетических кривых в координатах lg(Ce – Cτ) – время: 0,95 для топинамбура, 0,93 для льна и 0,91 для соевого шрота.
 |  |






