Реферат: Идеальный газ 2
| Название: Идеальный газ 2 Раздел: Рефераты по физике Тип: реферат Добавлен 14:24:43 06 июля 2011 Похожие работы Просмотров: 3610 Комментариев: 23 Оценило: 17 человек Средний балл: 4.4 Оценка: 4 Скачать | ||
 |
температурах.
Закон Бойля — Мариотта следует из кинетической теории газов, когда принимается допущение, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное взаимодействие. При больших давлениях необходимо вводить поправки на силы притяжения между молекулами и на объем самих молекул. Как и уравнение Клайперона, закон Бойля — Мариотта описывает предельный случай поведения реального газа, более точно описываемый уравнением Ван-дер-Ваальса. Применение закона приближенно можно наблюдать в процессе сжатия воздуха компрессором или в результате расширения газа под поршнем насоса при откачке его из сосуда.
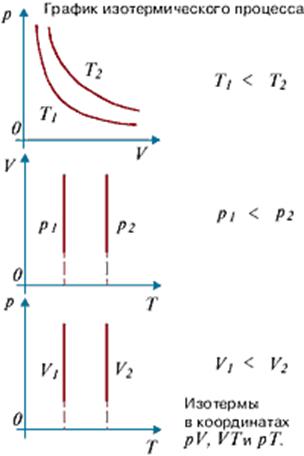
Термодинамический процесс, котроый происходит при постоянной температуре называется изотермическим. Изображение его на графике называется изотермой.(см. график изотермического процесса)
Закон Гей-Люссака. Изобара
Французский ученый Ж. Гей-Люссак в 1802 году нашел экспериментально зависимость объема газа от температуры при постоянном давлении. Данные лежат в основе газового закона Гей-Люссака.
Формулировка закона Гей-Люссака следующая: для данной массы газа отношение объема газа к его температуре постоянно, если давление газа не меняется. Эту зависимость математически записывают так:
Данный закон приближенно можно наблюдать, когда происходит расширение газа при его нагревании в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня. Другим проявлением закона Гей-Люссака в действии является аэростат. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к
 |
идеальному. Температура газа должна быть достаточно велика.
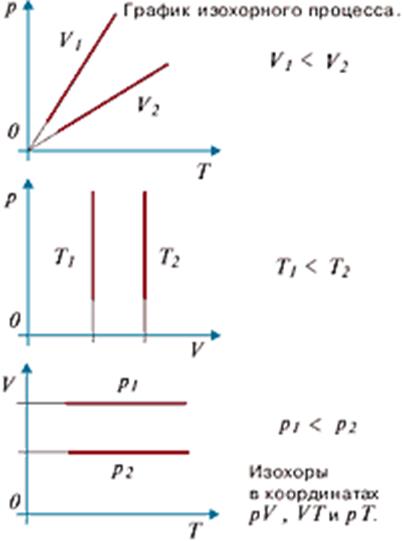
Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0 . Эту прямую называют изобарой . Разным давлениям соответствуют разные изобары. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным . От греческого слова «барос» — вес (тяжесть). (см. график изобарного процесса).
Закон Шарля. Изохора
Французский ученый Ж. Шарль в 1787 году нашел экспериментально зависимость давления газа от температуры при постоянном объеме. Данные лежат в основе газового закона Шарля.
Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так:
 |
P /Т= const , если V = const и m = const
Данный закон приближенно можно наблюдать, когда происходит увеличение давления газа в любой емкости или в электрической лампочке при нагревании. Изохорный процесс используется в газовых термометрах постоянного объема. Закон Шарля не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно высокой. Процесс должен проходить очень медленно
Графически эта зависимость в координатах P-T изображается в виде прямой, выходящей из точки Т=0 . Эту прямую называют изохорой . Разным объемам соответствуют разные изохоры. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным . От греческого слова «хорема»-вместимость. (см. графики изохорного процесса
Заключение
Газовые законы — законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
Список источников
1. Вукалович М.П., Новиков И.И. — Термодинамика. М: Машиностроение, 1972
2. Грабовский Р.И. Курс физики. М: Высшая школа, 1974
3. Громов С. В., Физика: Оптика. Тепловые явления. Строение и свойства вещества: Учебник для 10 класса., Москва, «Просвещение», 2003 г.
4. Коротков П.Ф. Молекулярная физика и термодинамика — 2e изд., MФТИ, 2004
5. Мякишев Г. Я., Буховцев Б. Б., Сотский Н. Н., Физика, учебник для 10 класса общеобразовательных учреждений, Москва, «Просвещение», 2008г.
6. Якунин В. И., Учебное пособие для изучающих физику в средней школе., Тамбов, ТИПКРО, Тамбовский областной физико-математический лицей, 1994
Уравнение состояния идеального газа. Универсальная газовая постоянная
Уравнение состояния идеального газа. Универсальная газовая постоянная — Лекция, раздел Физика, Техническая термодинамика На Основании Законов Бойля-Мариотта И Гей-Люсака В 1834Г Клапейроном Было Выв…
Все темы данного раздела:
Наиболее актуальные задачи, которые решают с использованием термодинамики: создание летательных аппаратов, в том числе космических многоразового действия; проектирование тепловых и
Термодинамической системой называют совокупность материальных тел, (а также полей) находящихся в механическом и тепловом взаимодействии, а также обменивающихся друг с другом вещест
Абсолютная температура (T) характеризует тепловое состояние тела, или, как иногда говорят, степень нагретости тела. С точки зрения молекулярно-кинетической теории температ
Абсолютное давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела, действующего по нормали
Как известно, каждый из основных параметров состояния системы p, v, T является функцией двух других ее параметров: ;
- Если все термодинамические параметры состояния постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным. Если межд
В результате взаимодействия термодинамической системы с окружающей средой (подвод к телу теплоты или работы) состояние рабочего тела, определяемое параметрами, изменяется С
Теплота и работа представляют две формы передачи энергии от одного тела (или системы) к другому. Процесс работы – макроскопический, который представляет собой упорядоченную
Под идеальным газом понимают совокупность материальных вполне упругих молекул, обладающих пренебрежимо малыми объёмами, находящихся в состоянии хаотического движения и лишённых сил
Закон Бойля — Мариотта.(изотермический процесс) В 1662 г. Р. Бойль , а в 1676 г. Э. Мариотт независимо друг от друга установили зависимость опытным путем объёма газа от ег
В ТТД чистым веществом наз. вещество, все молекулы которого одинаковы. Смесь, состоящая из нескольких чистых веществ наз. раствором. Чистыми веществами явл., напри
Внутренняя энергия обозначается буквой U, ее размерность Дж. Внутренняя энергия включает в себя: 1. Кинетическую энергию поступательного, вращательного и к
Уравнение состояния идеального газа
. молекулярная газовая постоянная, определяемая отношением газовой постоянной тела к числу молекул газа (1.25). Разновидности записи уравнения состояния идеального газа. Уравнение, выражающее связь между параметрами равновесного состояния термодинамической системы или локально равновесных её частей, F .
Термин энтальпия (от греч. euthalpo – нагреваю) введен в 1909 г. Камерлинг-Онессом. В ТТД важную роль играет величина суммы внутренней энергии U системы и произведения дав
Первое начало ТТД представляет собой частный случай всеобщего закона сохранения и превращения энергииприменительно к тепловым явлениям.
Термин энтропия (от греч. entropia – мера превращений ) введен в 1865 году Клаузиусом. Понятие об энтропии строится на основе следующих соображений. Уравнение 1-г
В соответствии с 1 – ым законом ТТД для закрытых систем имеем: С учетом соотношения (3.4.а), подставив его в выражение 1-го
ТД анализ любой системы состоит в следующем: 1. Выявить уравнение процесса. 2. Установить аналитическую взаимосвязь между параметрами состояния, (связь между парам
Политропными процессами наз. процессы, протекающие при постоянной теплоемкости и вызываемые подводом или отводом теплоты. Следовательно, в любом политропном процессе, распределение
Процесс, в котором не изменяется объем наз. изохорным. Линия, изображающая изохорный процесс, наз. изохорой. Этот процесс соответствует закону Шарля. Графическая интерпрет
При изобарном процессе выполняется условие p=const и dp=0. Этот процесс соответствует закону Гей-Люссака (рис.4.2).
При р=cоnst с=cp , откуда
Работа в изобарном процессе определяется интегрированием выражения при p=const: , (4.17) Следовательно, работа газа в изобарн
При изотермическом процессе выполняется условие: dT=0 или T=const. Таким образом следует, что это возможно, если . Н
При адиабатном процессе теплообмен рабочего тела с окружающей средой отсутствует, т.е. рабочее тело предполагается изолированным от окружающей среды идеальной тепловой изоляцией.
Для определения закона, по которому в p,v-; T,S-диаграммах располагаются политропы, выходящие из одной точки, рассмотрим графики частных процессов изменения состояния
Первая группа: . Построим в p,v и T,S – диаграммах политропные процессы с предельными значениями показателя R данной группы. То
Первым законом ТТД устанавливаются лишь количественные соотношения при взаимных превращениях теплоты и работы. В частности, при теплообмене можно было бы предположить, что теплота может пе
Исследование любого прямого цикла показывает, что для получения положительной работы необходимо к рабочему телу на некотором участке цикла подвести теплоту q1 от внешнего
В 1824 французский инженер С. Карно предложил цикл идеального теплового двигателя, состоящий из двух изотерм и двух адиабат и представляющий собой замкнутый процесс, который
Для обратимого цикла Карно имеем ;откуда
Термический КПД необратимого цикла меньше, чем термический КПД цикла Карно, т.е. ηtннеоб
Газовые законы
Автор работы: Пользователь скрыл имя, 18 Июня 2013 в 14:07, реферат
Описание
Газ всегда заполняет объём, ограниченный непроницаемыми для него стенками. Так, например, газовый баллон или камера автомобильной шины практически равномерно заполнены газом.
Итак , установим, от чего зависит давление газа? Во-первых, от степени сжатия газа, т.е. от того от того, сколько молекул газа находится в определённом объёме. Например, накачивая шину или сжимая её, мы заставляем газ сильнее давить на стенки камеры.
Работа состоит из 1 файл
Газовые законы.docx
Министерство Образования Российской Федерации
Краевое государственное бюджетное образовательное учреждение среднего профессионального образования (среднее специальное учебное заведение) «АЧИНСКИЙ ПРОФЕССИОНАЛЬНО- ПЕДАГОГИЧЕСКИЙ КОЛЛЕДЖ»
Реферат
по предмету «Основы гидравлики»
на тему: «Газовые законы»
Выполнил: Хайруллина А.А.
Проверил: Бурмистрова А.И.
Газ всегда заполняет объём, ограниченный непроницаемыми для него стенками. Так, например, газовый баллон или камера автомобильной шины практически равномерно заполнены газом.
Итак , установим, от чего зависит давление газа? Во-первых, от степени сжатия газа, т.е. от того от того, сколько молекул газа находится в определённом объёме. Например, накачивая шину или сжимая её, мы заставляем газ сильнее давить на стенки камеры.
Во-вторых, от того, какова температура газа.Обычно изменение давления вызывается обеими причинами сразу: и изменением объёма, и изменением температуры. Но можно осуществить явление так, что при изменении объёма температура будет меняться ничтожно мало или при изменении температуры объём практически останется неизменным. Этими случаями мы сперва и займёмся, сделав предварительно ещё следующее замечание.
Формула, выражающая закон Шарля.
Закон Шарля позволяет рассчитать давление газа при любой температуре, если известно его давление при 0°С. Пусть давление при 0°С данной массы газа в данном объеме есть p0, а давление того же газа при температуре t есть p. Приращение температуры есть t, следовательно, приращение давления равно ap0t и искомое давление равноP =p0+ap0t=p0 (1+at)= p0(1+t/273) Этой формулой можно пользоваться также и в том случае, если газ охлажден ниже 0°С; при этом t будет иметь отрицательные значения. При очень низких температурах, когда газ приближается к состоянию сжижения, а также в случае сильно сжатых газов закон Шарля неприложим и формула перестает быть годной.
Закон Шарля с точки зрения молекулярной теории
Что происходит в микромире молекул, когда температура газа меняется, например когда температура газа повышается и давление его увеличивается? С точки зрения молекулярной теории возможны две причины увеличения давления, данного газа: во-первых, могло увеличиться число ударов молекул на 1 см2 в течение 1 сек; во-вторых, могло увеличиться количество движения, передаваемое при ударе в стенку одной молекулой. И та и другая причина требует увеличения скорости молекул. Отсюда становится ясным, что повышение температуры газа (в макромире) есть увеличение средней скорости беспорядочного движения молекул (в микромире). Опыты по определению скоростей газовых молекул, о которых буду говорить немного далее, подтверждают этот вывод. Когда мы имеем дело не с газом, а с твердым иди жидким телом, в нашем распоряжении нет таких непосредственных методов определения скорости молекул тела. Однако и в этих случаях несомненно, что с повышением температуры скорость движения молекул возрастает.
Изменение температуры газа при изменении его объема. Адиабатические и изотермические процессы.
Мы установили, как зависит давление газа от температуры, если объем остается неизменным. Теперь посмотрим, как меняется давление некоторой массы газа в зависимости от занимаемого ею объема, если температура остается неизменной. Однако, прежде чем перейти к этому вопросу, надо выяснить, как поддерживать температуру газа неизменной. Для этого надо изучить, что происходит, с температурой газа, если объем его меняется настолько быстро, что теплообмен газа с окружающими телами практически отсутствует. Произведем такой опыт. В закрытую с одного конца толстостенную трубку из прозрачного материала поместим ватку, слегка смоченную эфиром, и этим создадим внутри трубки смесь паров эфира с воздухом, взрывающуюся при нагревании. Затем быстро вдвинем в трубку плотно входящий поршень. Мы увидим, что внутри трубки произойдет маленький взрыв. Это значит, что при сжатии смеси паров эфира с воздухом температура смеси резко повысилась. Это явление вполне понятно. Сжимая газ внешней силой, мы производим работу, в результате которой внутренняя энергия газа должна была увеличиться; это и произошло—газ нагрелся. Теперь предоставим газу расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщив бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого. отверстия наружу, и поместим в струе расширяющегося воздуха термометр или колбу с трубкой. Термометр покажет температуру, заметно более низкую, чем комнатная, а капля в трубке, присоединенной к колбе, побежит в сторону колбы, что также будет указывать на понижение температуры воздуха в струе. Значит, когда газ расширяется и при этом совершает работу, он охлаждается и внутренняя энергия его убывает. Ясно, что нагревание газа при сжатии и охлаждение при расширении являются выражением закона сохранения энергии. Если мы обратимся к микромиру, то явления нагревания газа при сжатии и охлаждения при расширении станут вполне ясными. Когда молекула ударяется о неподвижную стенку и отскакивает от нее, скорость, а следовательно, и кинетическая энергия молекулы, в среднем такова же, как и до удара о стенку. Но если молекула ударяется и отскакивает от надвигающегося на нее поршня, ее скорость и кинетическая энергия больше, чем до удара о поршень (подобно тому как скорость теннисного мяча увеличивается, если его ударить во встречном направлении ракеткой). Надвигающийся поршень передает отражающейся от него молекуле дополнительную энергию. Поэтому внутренняя энергий газа при сжатии возрастает. При отскакивании от удаляющегося поршня скорость молекулы уменьшается, ибо молекула совершает работу, толкая отходящий поршень. Поэтому расширение газа, связанное с отодвиганием поршня или слоев окружающего газа, сопровождается совершением работы и приводит к уменьшению внутренней энергии газа. Итак, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением. Это явление в некоторой мере имеет место всегда, но особенно резко заметаю тогда, когда обмен теплотой с окружающими телами сведен к минимуму, ибо такой обмен может в большей или меньшей степени компенсировать изменение температуры. Процессы, при которых передача теплоты настолько ничтожна, что ею можно пренебречь, называют адиабатическими. Возвратимся к вопросу, поставленному в начале главы. Как обеспечить постоянство температуры газа, несмотря на изменения его объема? Очевидно, для этого надо непрерывно передавать газу теплоту извне, если он расширяется, и непрерывно отбирать от него теплоту, передавая ее окружающим телам, если газ сжимается. В частности, температура газа остается достаточно постоянной, если расширение или сжатие газа производится очень медленно, а передача теплоты извне или вовне может происходить с достаточной быстротой. При медленном расширении теплота от окружающих тел передается газу и его температура снижается так мало, что этим снижением можно пренебречь. При медленном сжатии теплота, наоборот, передается от газа к окружающим телам, и вследствие этого температура его повышается лишь ничтожно мало. Процессы, при которых температура поддерживается неизменной, называют изотермическими.
Закон Бойля — Мариотта
Перейдем теперь к более подробному изучению вопроса, как меняется давление некоторой массы газа, если температура его остается неизменной и меняется только объем газа. Мы уже выяснили, что такой изотермический процесс осуществляется при условии постоянства температуры тел, окружающих газ, и настолько медленного изменения объема газа, что температура газа в любой момент процесса не отличается от температуры окружающих тел.
Мы ставим, таким образом, вопрос: как связаны между собой объем и давление при изотермическом изменении состояния газа? Ежедневный опыт учит нас, что при уменьшении объема некоторой массы газа давление его увеличивается. В качестве примера можно указать повышение упругости при накачивании футбольного мяча, велосипедной или автомобильной шины. Возникает вопрос: как именно увеличивается давление газа при уменьшении объема, если температура газа остается неизменной?Ответ на этот вопрос дали исследования, произведенные в XVII столетии английским физиком и химиком Робертом Бойлем (1627—1691) и французским физиком Эдемом Мариоттом (1620—1684).
Опыты, устанавливающие зависимость между объемом и давлением газа, можно воспроизвести: на вертикальной стойке, снабжённой делениями, находятся стеклянные трубки А и В, соединенные резиновой трубкой С. В трубки налита ртуть. Трубка В сверху открыта, на трубке А имеется кран. Закроем этот кран, заперев таким образом некоторую массу воздуха в трубке А. Пока мы не сдвигаем трубок, уровень ртути в обеих трубках одинаков. Это значит, что давление воздуха, запертого в трубке А, такое же, как и давление окружающего воздуха.
Будем теперь медленно поднимать трубку В. Мы увидим, что ртуть в обеих трубках будет подниматься, но не одинаково: в трубке В уровень ртути будет все время выше, чем в А. Если же опустить трубку В, то уровень ртути в обоих коленах понижается, но в трубке В понижение больше, чем в А. Объем воздуха, запертого в трубке А, можно отсчитать по делениям трубки А. Давление этого воздуха будет отличаться от атмосферного на величину давления столба ртути, высота которого равна разности уровней ртути в трубках А и В. При. поднятии трубки В давление столба ртути прибавляется к атмосферному давлению. Объем воздуха в А при этом уменьшается. При опускании трубки В уровень ртути в ней оказывается ниже, чем в А, и давление столба ртути вычитается из атмосферного давления; объем воздуха в А соответственно увеличивается. Сопоставляя полученные таким образом значения давления и объема воздуха, запертого в трубке А, убедимся, что при увеличении объема некоторой массы воздуха в определенное число раз давление его во столько же раз уменьшается, и наоборот. Температуру воздуха в трубке при наших опытах можно считать неизменной. Подобные же опыты можно» произвести и с другими газами. Результаты получаются такие же. Итак, давление некоторой массы газа при неизменной температуре обратно пропорционально объему газа (закон Бойля—Мариотта). Для разреженных газов закон Бойля — Мариотта выполняется с высокой степенью точности. Для газов же сильно сжатых или охлажденных обнаруживаются заметные отступления от этого закона.
Формула, выражающая закон Бойля — Мариотта.
Зависимость между плотностью газа и его давлением.
Вспомним, что плотностью вещества называется масса, заключенная в единице объема. Если мы как-нибудь изменим объем данной массы газа, то изменится и плотность газа. Если, например, мы уменьшим объем газа в пять раз, то плотность газа увеличится в пять раз. При этом увеличится и давление газа; если температура не изменилась, то, как показывает закон Бойля — Мариотта, давление увеличится тоже в пять раз. Из этого примера видно, что при изотермическом процессе давление газа изменяется прямо пропорционально его плотности. Обозначив плотности газа при давлениях P1 и P2 буквами d1 иd2, можем написать:
Этот важный результат можно считать другим и более существенным выражением закона Бойля — Мариотта. Дело в том, что вместо объема газа, который зависит от случайного обстоятельства — оттого, какая выбрана масса газа,— в формулу (3) входит плотность газа, которая, также как и давление, характеризует состояние газа и вовсе не зависит от случайного выбора его массы.
Молекулярное толкование закона Бойля — Мариотта.
В предыдущей главе мы выяснили на основании закона Бойля — Мариотта, что при неизменной температуре давление газа пропорционально его плотности. Если плотность газа меняется, то во столько же раз меняется и число молекул в 1 см3. Если газ не слишком сжат и движение газовых молекул можно считать совершенно независимым друг от друга, то число ударов за 1 сек на 1 см2 стенки сосуда пропорционально числу молекул в 1 см3. Следовательно, если средняя скорость молекул не меняется с течением времени (мы уже видели, что в макромире это означает постоянство температуры), то давление газа должно быть пропорционально числу молекул в 1 см3, т.е. плотности газа. Таким образом, закон Бойля — Мариотта является прекрасным подтверждением наших представлений о строении газа.
Однако, закон Бойля — Мариотта перестает оправдываться, если перейти к большим давлениям. И это обстоятельство может быть прояснено, как считал еще М. В. Ломоносов, на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объем газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях. более существенным является второе обстоятельство и произведение PV немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение PV увеличивается. Итак, и сам закон Бойля — Мариотта и отступления от него подтверждают молекулярную теорию.
Изменение объема газа при изменении температуры
Мы изучали, как зависит давление некоторой массы газа от температуры, если объём остается неизменным, и от объема, занимаемого газом, если температура остается неизменной. Теперь установим, как ведет себя газ, если меняются его температура и объем, а давление остается постоянным.
Рассмотрим такой опыт. Коснемся Ладонью сосуда, изображенного на рис., в котором горизонтальный столбик ртути запирает некоторую массу воздуха. Газ в сосуде нагреется, его давление повысится, и ртутный столбик начнет перемещаться вправо. Движение столбика прекратится, когда благодаря увеличению объема воздуха в сосуде давление его сделается равным наружному. Таким образом, в конечном результате этого опыта объем воздуха при нагревании увеличился, а давление осталось неизменным. Если бы мы знали, как изменилась в нашем опыте температура воздуха в сосуде, и точно измерили, как меняется объем Газа, мы могли бы изучить это явление с количественной стороны. Очевидно, что для этого надо заключить сосуд в оболочку, заботясь о том, чтобы все части прибора имели одну и ту же температуру, точно измерить объем запертой массы газа, затем изменить эту температуру и измерить приращение объема газа.
Количественное Исследование зависимости объема газа от температуры при неизменном давлении было произведено французским физиком и химиком Гей-Люссаком (1778—1850) в 1802 г. Опыты показали, что увеличение объема газа пропорционально приращению температуры. Поэтому тепловое расширение газа можно, так же, как и для других тел, охарактеризовать при помощи коэффициента объемного расширения b. Оказалось, что для газов этот закон соблюдается гораздо лучше, чем для твердых и жидких тел, так что коэффициент объемного расширения газов есть величина, практически постоянная даже при очень значительных повышениях Температуры, тогда как для жидких и твердых тел это; постоянство соблюдается лишь приблизительно.
Опыты Гей-Люссака и других обнаружили замечательный результат. Оказалось, что коэффициент объемного расширения у всех газов одинаков (точнее, почти одинаков) и равняется (1/273)град-1= =0,00366град-1. Таким образом, при нагревании при постоянном давлении на1° объем некоторой массы газа увеличивается на 1/273 того объема, который эта масса газа занимала при 0°С (закон Гей-Люссака). Как видно, коэффициент расширения газов совпадает с их термическим коэффициентом давления.
До сих пор мы говорили о давлении какого-нибудь одного газа — кислорода, водорода и т. п. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов. Самый важный пример этого — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
http://inzhpro.ru/referat/universalnaya-gazovaya-postoyannaya/
http://www.freepapers.ru/34/gazovye-zakony/297246.2173568.list1.html
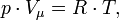
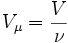 , где где ν — количество вещества, а
, где где ν — количество вещества, а 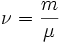 , где m — масса, μ — молярная масса, уравнение состояния можно записать:
, где m — масса, μ — молярная масса, уравнение состояния можно записать: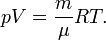
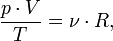
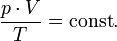
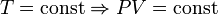 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.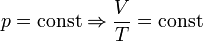 — закон Гей-Люссака.
— закон Гей-Люссака.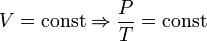 — закон Шарля
— закон Шарля