Уравнения состояния и термодинамические процессы
Как правило, при взаимодействии какого-либо рода в системе одновременно изменяются значения нескольких параметров состояния. Однако опыт показывает, что среди параметров состояния всегда имеется один (и только один) такой параметр, изменение которого в равновесных процессах вызывается взаимодействием только одного определенного рода.
Параметры состояния, обязательно изменяющиеся при наличии взаимодействия данного рода и не изменяющиеся под влиянием взаимодействий иных родов, называются координатами термодинамического состояния. Если происходит изменение некоторой координаты состояния, то можно утверждать, что происходит обмен энергией в соответствующей форме.
Так, при деформационном взаимодействии необходимым и достаточным условием передачи энергии в форме работы является перемещение поршня, на который действует сила давления газа. Перемещение поршня приводит к изменению объема рабочего тела в цилиндре.
Следовательно, координатой деформационного состояния однородного рабочего тела является его объем.
Координатой термического состояния рабочего тела является энтропия. Изменение энтропии свидетельствует о том, что изменение состояния термодинамической системы происходит в результате передачи энергии в форме теплоты.
Как известно, изменение равновесного состояния термодинамической системы возможно только в результате внешних воздействий, а воздействие каждого рода приводит к изменению значения одной из координат состояния. Значит, для определения состояния системы достаточно знать значения всех координат состояния, которые полностью и однозначно определяют данное равновесное состояние. Значение остальных параметров состояния определяются по значениям координат состояния, то есть каждый параметр равновесного состояния системы является однозначной функцией всех координат состояния.
Уравнения, представляющие зависимость параметров (функций) состояния равновесной системы от координат состояния, называются уравнениями состояния термодинамической системы.
Если обозначить произвольную функцию состояния системы через j, а координаты состояния – через х1, х2, …, хn (n – число координат состояния, то есть термодинамических степеней свободы), то уравнение состояния можно представить в виде:
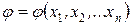
Например, состояние однородной термодеформационной системы описывается уравнениями, содержащими две независимые переменные: координату деформационного состояния – удельный объем u, координату термического состояния – удельную энтропию s. Остальные параметры (функции) состояния, например, температура и давление связаны со значениями координат соответствующими уравнениями состояния в виде:
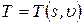
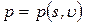
Температура и давление относятся к важной для термодинамического анализа группе величин, которая называется потенциалы термодинамических взаимодействий.
Потенциалом взаимодействия некоторого рода называется параметр состояния, различие значений которого между системой и окружающей средой на контрольной поверхности приводит к возникновению взаимодействия данного рода, то есть к передаче энергии в данной форме между системой и окружающей средой. Потенциалом для теплового взаимодействия является термодинамическая температура, а для деформационного механического взаимодействия – давление. Как правило, уравнения состояния содержат координаты и потенциалы термодинамической системы.
Представленные уравнения состояния для термодеформационной системы неудобны для практического применения, так как энтропия – неизмеряемая величина. Решая совместно эти уравнения, можно исключить энтропию, выразив ее через объем и температуру или через объем и давление. В результате получается термическое уравнение состояния, которое связывает давление, объем и температуру:
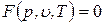
Уравнения состояния систем с двумя степенями свободы, являясь функциями с двумя независимыми переменными, позволяют построить некоторую поверхность, называемую термодинамической поверхностью или поверхностью состояния. Любое равновесное состояние системы изображается точкой, лежащей на этой поверхности. Если точка не лежит на поверхности состояния, то такое сочетание параметров состояния для данной системы невозможно.
Изменение состояния термодинамической системы в результате ее взаимодействия с окружающей средой называется термодинамическим процессом.
В результате осуществления термодинамического процесса происходит обмен энергией между системой и окружающей средой, который возможен лишь при наличии разности соответствующих потенциалов. А наличие разности потенциалов может привести к нарушению равновесия внутри термодинамической системы. Термодинамический процесс, протекающий с нарушением внутреннего равновесия в термодинамической системе, называется неравновесным.
Полное описание неравновесных процессов методами термодинамики невозможно вследствие неопределенности и чрезвычайно сложного характера изменений, происходящих при этом в системе. Поэтому для изучения принципиальных свойств систем при обмене энергией применяется идеализация реальных процессов и рассматриваются равновесные процессы.
Термодинамический процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называется равновесным.
При осуществлении равновесного процесса термодинамическая система проходит ряд бесконечно близких состояний, каждое из которых является равновесным. Каждое промежуточное состояние системы в процессе подчиняется уравнению состояния и изображается соответствующей точкой на термодинамической поверхности. Совокупность таких точек образует на поверхности состояний линию, которая называется линией термодинамического процесса.
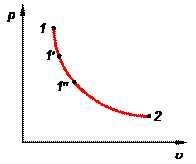 Рис. 1.2. Диаграмма состояния. Рис. 1.2. Диаграмма состояния. | В термодинамике широко используются графические методы анализа процессов. При этом удобнее использовать не пространственные трехмерные изображения линий процессов, а их двухмерные проекции на координатные плоскости. Координатные оси плоских диаграмм состояния соответствуют двум термодинамическим параметрам (рис. 1.2). Например, на р—u-диаграмме изображен какой-то равновесный процесс 1-2. Точки 1, 1¢, 1² и т.д. изображают равновесные состояния термодинамической системы. |
Тема: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»(2 часа)
1. Первый закон термодинамики как закон сохранения и превращения энергии.
2. Свойства работы как формы обмена энергией.
3. Свойства теплоты как формы обмена энергией.
4. Уравнение первого закона термодинамики для закрытых систем
5. Уравнение первого закона термодинамики для открытых систем
Основная литература
1. Амерханов Р.А., Драганов Б.Х. Теплотехника. — М.: Энергоатомиздат, 2006. – 432 с.
Дополнительная литература
1. Теплотехника. /А.П. Баскаков, Б.В. Берг и др. – М.: Энергатомиздат, 1991. – 224 с.
2. Техническая термодинамика. / Кириллин В.А., Сычев В.В., Шейндлин А.Е. – М.: Издательский дом МЭИ, 2008. – 496 с.
Дата добавления: 2015-11-26 ; просмотров: 1569 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение состояния и термодинамический процесс
Основные т/д параметры состояния Р, υ, Т однородного тела зависят друг от друга и взаимно связаня между собой определенным математическим уравнением, который называется уравнением состояния:f (Р, υ, Т) = 0 . (1.7)
Равновесным состоянием называется состояние тела, при котором во всех его точках объема Р, υ и Т и все другие физические свойства одинаковы.
Совокупность изменений состояния т/д системы при переходе из одного состояния в другое называется т/д процессом. Т/д процессы бывают равновесные и неравновесные. Если процес проходит через равновесные состояния, то он называется равновесным. В реальных случаях все процессы являются неравновесными.
Если при любом т/д процессе изменение параметра состояния не зависит от вида процесса, а определяется начальным и конечным состоянием, то параметры состояния называются функцией состояния. Такими параметрами являются внутренняя энергия, энтальпия, энтропия и т.д.
Интенсивные параметры – это параметры не зависящие от массы системы (давление, температура).
Аддитивные (экстенсивные) параметры – параметры, значения которых пропорциональны массе системы (Объем, энергия, энтропия и т.д.).
Тема 2. Первый закон термодинамики
Теплота и работа
Тела, участвующие при протекании т/д процесса обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами.
1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел либо лучистым переносом внутренней энергии излучающих тел путем э/м волн. При этом энергия передается от более нагретого к менее нагретому.
Количество энергии, переданной 1-м способом от одного тела к другому, называется количеством теплоты – Q [Дж], а способ – передача энергии в форме теплоты.
2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передачи энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой – L [Дж], а способ передача энергии в форме работы.
Количество энергии, полученное телом в форме работы называется работой совершенной над телом, а отданную энергию – затраченной телом работой.
Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера т/д процесса.
Внутренняя энергия
В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле или системе тел. Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии молекул.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул.
Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P,T), U = f (υ ,T) U= f (P,υ). Κаждому состоянию рабочего тела (системы) соответствует вполне определенное значение параметров состояния, то для каждого состояния газа будет характерна своя однозначная, вполне определенная величина внутренней энергии U. То есть U является функцией состояния газа. И разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависет от пути перехода от первого состояния во второе.
Первый закон термодинамики
Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Этот закон является законом сохранения и превращения энергии:
¦»Энергия не исчезает и не возникает вновь, она лишь переходит
¦из одного вида в другой в различных физических процессах».
Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии т/д системы:
¦»Теплота, подведенная к системе, расходутся на изменение энергии ¦системы и совершение работы».
Уравнение первого закона термодинамики имеет следующий вид: Q = (U2 – U1) + L , (2.1)где Q — количества теплоты подведенная (отведенная) к системе;
L — работа, совершенная системой (над системой);
(U2 – U1) — изменение внутренней энергии в данном процессе.
Q > 0 – теплота подводится к системе;
Q 0 –работа совершается системой;
L / = С / V = с·ρ , [Дж/м 3 ] , (2.6)где — ρ = m / V — плотность вещества.
Связь между этими теплоемкостями:с = с / · υ = сμ / μ ,
где — υ = V/m — удельный объем вещества, [м 3 /кг];
μ = m /ν – молярная (молекулярная) масса, [кг/моль].
Теплоемкость газов в большой степени зависит от тех условий, при которых происходит процесс их нагревания или охлаждения. Различают теплоемкости при постоянном давлении (изобарный) и при постоянном объеме (изохорный).
Таким образом различают следующие удельные теплоемкости:
ср , сv – массовые изобарные и изохорные теплоемкости;
сpμ , сvμ – молярные изобарные и изохорные теплоемкости;
с / p , с / v – объемные изобарные и изохорные теплоемкости.
Между изобарными и изохорными теплоемкостями существует следующая зависимость:ср — сv = R — уравнение Майера; (2.7)
сpμ — сvμ = Rμ . (2.8)Теплоемкость зависит от температуры, которые даются в справочных литературах в виде таблицы как средние теплоемкости в интервале температур от 0 до tх. Для определения средней теплоемкости в интервале температур от t1 до t2 можно использовать следующую формулу:
ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала.
Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все.
Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Уравнение состояния и термодинамический процесс
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Основные понятия и определения
Введение
Теплотехника — наука, которая изучает:
— методы получения, преобразования, передачи и использования теплоты;
— принципы действия и конструктивные особенности тепловых машин, аппаратов и устройств.
Различают энергетическое и технологическое использование теплоты.
При энергетическом использовании теплота преобразуется в механическую работу, с помощью которой в электрических машинах — генераторах — создается электрическая энергия. Теплоту при этом получают на котельных установках или непосредственно в двигателях внутреннего сгорания.
При технологическом использовании с помощью теплоты изменяют свойства тел (расплавление, затвердевание, изменение структуры и свойств).
Теоретическая основа теплотехники — термодинамика (ТД) — рассматривает закономерности взаимного превращения теплоты и работы. ТД устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Термодинамика опирается на два основных закона термодинамики.
Техническая ТД, применяя основные законы к процессам превращения теплоты в механическую работу и обратно, дает возможность разрабатывать теорию тепловых двигателей и исследовать протекающие в них процессы.
Один из теоретических разделов теплотехники — технические основы теории теплообмена. В этом разделе исследуются законы превращения и свойства тепловой энергии и процессы распространения теплоты.
Теплопередача — передача теплоты от горячего теплоносителя к холодному через стенку, разделяющую эти теплоносители.
Термодинамическая система
Объект исследования ТД — термодинамическая система, которой могут быть группа тел, тело или часть тела. Находящееся вне системы называется её окружающей средой.
ТД система — это совокупность макроскопических тел, способных обмениваться энергией и веществом друг с другом и окружающей средой.
Например, ТД система — это газ, находящийся в цилиндре с поршнем, а окружающая среда — цилиндр, поршень, воздух, стены помещения.
Закрытая система — ТД система, которая может обмениваться с окружающей средой энергией, но не веществом, в отличие от открытой системы, которая обменивается с другими телами и энергией и веществом.
Изолированная система — система, не взаимодействующая с окружающей средой (не обменивающаяся с окружающей средой ничем).
Адиабатная (теплоизолированная) система — система с адиабатной оболочкой, исключающей теплообмен с окружающей средой.
Однородная система — система, имеющая во всех своих частях одинаковый состав и физические свойства.
Гомогенная система — однородная по составу и физическому строению система, внутри которой нет поверхностей раздела (лед, вода, газы).
Гетерогенная система — система, состоящая из нескольких гомогенных частей (фаз) с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела (лед и вода, вода и пар).
В тепловых машинах (двигателях) механическая работа совершается с помощью рабочих тел — газа, пара.
Параметры состояния
Величины, характеризующие физическое состояние тела, называются ТД параметрами состояния.
1.Удельный объем — отношение объема V вещества к его массе m:
2.Температура — мера средней кинетической энергии поступательного движения молекул тела, определяющая степень его нагретости. Чем больше средняя скорость движения молекул, тем выше температура тела (температура пропорциональна скорости движения молекул).
ТД параметром состояния системы служит термодинамическая температура Т, т.е. абсолютная температура. Она всегда положительна, При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура — начало отсчета абсолютной температуры.
Давление с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ:
где F- сила ударов; S – площадь стенки.
Внесистемные единицы давления:
1 кгс/см 2 = 98066,5 Па = 10 м вод. ст.
1 ат (техническая атмосфера) = 1 кгс/см 2 = 98,1 кПа.
1 атм (физическая атмосфера) = 101,325 кПа = 760 мм рт. ст.
1 ат = 0,968 атм.
1 мм рт.ст. = 133,32 Па.
1 бар = 0,1 МПа = 100 кПа = 10 5 Па.
Избыточное давление (pи) — разность между давлением жидкости или газа и давлением окружающей среды (атмосферным давлением).
3. Абсолютное давление (p) — давление, отсчитываемое от абсолютного нуля давления (абсолютного вакуума) — ТД параметр состояния.
при давлении в сосуде больше атмосферного
при давлении в сосуде меньше атмосферного
где pа — атмосферное давление; pв — давление вакуума.
При отсутствии внешних силовых полей (гравитационного, электромагнитного и др.) термодинамическое состояние однофазного тела однозначно определяется тремя параметрами: удельным объемом v, температурой Т, давлением p.
Плотность вещества — отношение массы к объему вещества:
Уравнение состояния и термодинамический процесс
Основные ТД параметры состояния однородного тела (p, v, Т) связаны между собой уравнением состояния
Равновесным состоянием называют состояние тела, при котором во всех точках его объема p, v, Т и все другие физические свойства одинаковы.
Совокупность изменений состояния ТД системы при переходе из одного состояния в другое называется ТД процессом. Если процесс проходит через равновесные состояния, то он называется равновесным. В реальных случаях все процессы неравновесны.
Если при любом ТД процессе изменение параметра состояния не зависит от вида процесса, а определяется начальным и конечным состоянием, то параметр состояния считается функцией состояния. Такими параметрами оказываются внутренняяэнергия, энтальпия, энтропия и др.
Интенсивные параметрыне зависят от массы системы (давление, температура).
Аддитивные (экстенсивные) параметры — такие, значения которых пропорциональны массе системы (объем, энергия, энтропия и др.).
http://zdamsam.ru/a63775.html
http://lektsii.org/11-49764.html




