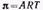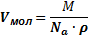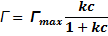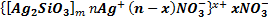Экзаменационный билет № 27
Поверхностно-активные вещества (ПАВ), молекулы которых имеют дифильное строение и включают большой углеводородный радикал, отличаются высокой поверхностной активностью по отношению к воде, что отражает сильную зависимость поверхностного натяжения водного раствора ПАВ от их концентрации. Большие значения поверхностной активности предполагают пренебрежимо малые концентрации ПАВ в объеме раствора по сравнению с концентрацией их в поверхностном слое, т. е. с величиной их адсорбции на границе раствор — воздух. Подобная зависимость может обнаруживаться и в растворах других веществ на границе с жидкостью или твердым телом, например при специфическом взаимодействии с поверхностью.
Высокая поверхностная активность коллоидных ПАВ зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу CH2 приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюклю — Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ.
Для органических сред правило Дюкло — Траубе обращается: поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ.
Вывод уравнения Шишковского:
После разделения переменных имеем:
После интегрирования получим уравнение Щищкрвского, характеризующее поверхностное натяжение растворов ПАВ в зависимости от концентрации:
Подобную зависимость σ от с для ПАВ Б. А. Шишковский получил опытным путем.
При адсорбции или растекании вещества на поверхности образуется поверхностная (адсорбционная) пленка этого вещества. Полученные ранее уравнения изотерм поверхностного натяжения для ПАВ позволяют перейти к уравнениям состояния поверхностных пленок. При очень малых концентрациях ПАВ распределение вещества между раствором и поверхностным слоем описывается законом Генри, а зависимость поверхностного натяжения от концентрации следует указанному выше соотношению. Если в этом соотношении обозначить 
Так как величина А обозначает число молей адсорбированного вещества, приходящееся на единицу поверхности, а обратная ей величина Sм=l/A выражает поверхность, на которой распределен 1 моль адсорбированного вещества, то полученному соотношению можно придать вид:
Это уравнение аналогично, уравнению состояния идеального газа. Различие состоит в том, что вместо объема 1 моль газа здесь выступает поверхность, занимаемая 1 моль ПАВ, а вместо давления газа — разность поверхностных натяжений, которая получила название давления двухмерного газа, или двухмерного давления. В соответствии с этим полученное соотношение называют уравнением состояния идеального двухмерного газа.
В зависимости от условий, природы ПАВ и подложки образуются поверхностные пленки, которые по свойствам подобны веществам в трех агрегатных состояниях — газообразном, жидком и твердом. Состояние пленки зависит также и от концентрации растекающегося (адсорбирующегося) вещества на поверхности. Если концентрация мала и взаимодействие молекул в поверхностном слое слабое (большой коэффициент растекания), то молекулы ПАВ движутся по поверхности независимо друг от друга. Такое состояние напоминает поведение газа, поэтому пленку называют газообразной.
Пленки, образованные при сплошном заполнении поверхностного слоя, ‘называют конденсированными. Они могут быть жидкими и твердыми. Твердые пленки обладают структурой, подобной структуре твердого тела. Такая пленка если и течет, то очень медленно.

По зависимости поверхностного давления пленки от площади поверхности, приходящейся на 1 молекулу (1 моль) вещества пленки, можно судить о состоянии пленки.
Резкое увеличение поверхностного давления при сжатии пленки отвечает образованию сплошного мономолекул яркого слоя, в котором молекулы плотно прижаты друг к другу. Если площадь sм 0 , на которой размещен таким образом 1 моль вещества, разделить на число Авогадро, то получим площадь, непосредственно занимаемую одной молекулой:
- Факторы агрегативной устойчивости лиофобных дисперсных систем. Электролитная коагуляция (концентрационная и нейтрализационная коагуляция). Правило Шульце-Гарди и закон Дерягина. Способы стабилизации лиофобных дисперсных систем.
Различают следующие термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем:
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3. Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6. Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции.
Коагуляция может происходить как без внешнего воздействия на систему, так и при повышении температуры, межаническом, электрическом или другом воздействии, а в случае золей – при ведении коагулянтов, например электролитов.
Принято считать, что типичные лиофобные системы агрегатнвно устойчивы благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в систему сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита сб, после увеличения которой скорость коагуляции остается постоянной (когда фактор устойчивости W=1, или потенциальный барьер ΔE = 0).

В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного слоя сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита.
Закон Дерягина:
При высоких потенциалах порог быстрой коагуляции по теории ДЛФО не зависит от потенциала и обратно пропорционален заряду противоиона в шестой степени, что хорошо обосновывает известное эмпирическое правило Шульце — Гарди. По правилу Шульце — Гарди значения порогов коагуляции для электролитов с зарядами противоионов 1, 2, 3 находятся в соотношении 
Чтобы обеспечить агрегативную устойчивость дисперсных систем, частицы которых имеют лиофобную поверхность, применяют стабилизаторы, способствующие увеличению межфазного взаимодействия. В качестве таких стабилизаторов широко применяют ПАВ и ВМС (имеющие неполярные и полярные части молекул), лиофилизируюшие поверхность частиц дисперсной фазы.
Стабилизацию лиофобных дисперсных систем с помощью лнофильных коллоидов (в первую очередь, ВМС) называют защитным действием стабилизаторов — коллоидной защитой.
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Уравнения состояния поверхностных плеиок
При адсорбции или растекании вещества на поверхности образуется поверхностная (адсорбционная) пленка этого вещества. Полученные в предыдущем разделе уравнения изотерм поверхностного натяжения для ПАВ позволяют перейти к уравнениям состояния поверхностных пленок. При очень малых концентрациях ПАВ распределение вещества между раствором
J 88
и поверхностным слоем описывается законом Генри (III.119), а зависимость поверхностного натяжения от концентрации следует соотношению (III.121). Если в этом соотношении обозначить
И учесть уравнение (II 1.120), то получим:
Так как величина А обозначает число молей адсорбированного вещества, приходящееся на единицу поверхности, а обратная ей величина sM=jA выражает поверхность, на которой распределен 1 моль адсорбированного вещества, то соотношению (III.132) можно придать вид
Уравнение (III.133) аналогично уравнению состояния идеального газа. Различие состоит в том, что вместо объема 1 моль газа здесь выступает поверхность, занимаемая 1 моль ПАВ, а вместо давления газа — разность поверхностных натяжений (III. 133), которая получила название давления двухмерного газа, или двухмерного давления. В соответствии с этим соотношение (III.133) называют уравнением состояния Идеального двухмерного газа.
Физический смысл давления двухмерного газа становится понятным при проведении аналогии с газом, находящимся в трехмерном пространстве. Известно, что под действием теплового движения молекулы газа ударяются о стенки сосуда, чем и объясняется давление газа в сосуде. Подобным же образом молекулы адсорбированного вещества при тепловом движении совершают хаотические перемещения по поверхности, ударяясь о стенки сосуда, ограничивающие поверхность. Двухмерное давление определяется силой, приходящейся на единицу длины периметра, ограничивающего поверхность, на которой адсорбировано вещество. Отсюда следует, что единицы двухмерного давления совпадают с единицами поверхностного натяжения.
Поверхностное натяжение отражает способность вещества уменьшать свою поверхностную энергию и проявляется в тангенциальном сжатии поверхностного слоя жидкости. Адсорбционная пленка ПАВ проявляет стремление к тангенциальному растяжению поверхностного слоя подлежащей жидкости. Понятие двухмерного давления в принципе можно применять и к поверхпостно-инактивным веществам, для которых оно будет иметь отрицательный знак и подчиняться другим закономерностям.
Состояние идеального двухмерного газа адсорбционная пленка имеет при соблюдении закона распределения Генри.
При более высокой концентрации ПАВ в растворе для описания распределения вещества между объемом и межфазным слоем необходимо пользоваться или уравнением Ленгмюра, илк уравнением (III.127) соответственно для неионогенных н ионогенных ПАВ, а изменение поверхностного натяжения следует уравнениям Шишковского (III.125), и (III.129). Интересно, что оба последних уравнения при выражении состава только поверхностного слоя переходят в одно и то же уравнение — уравнение Ван-Лаара, которое фактически является уравнением состояния поверхностных пленок для данного интервала концентраций ПАВ:
О=0о+Лао/?Г1п (І — 0) (III.134)
Так, например из (III.127) имеем
Для этого же интервала концентраций ПАВ можно получить уравнение состояния в другой форме, аналогичной уравнению (III.134). Например, запишем уравнение Шишковского в следующем виде:
После разложения в ряд логарифмического выражения получим:
Или, как следует из уравнения Ленгмюра в линейной форме
Так как I/i4 = sM, а — площадь непосредственно зани
Маемая 1 моль вещества, то уравнение (III.137) можно записать так:
Уравнение (III.138) также является уравнением состояния двухмерного газа. В нем, как и при выводе уравнения Ленгмюра, учитываются конечные размеры молекул адсорбированного вещества и предполагается отсутствие их взаимодействия на поверхности. Уравнение (III. 138) аналогично уравнению Ван-дер-Ваальса с одной постоянной b для трехмерного газа с параметрами р, V и Г:
По аналогии с уравнением состояния Ван-дер-Ваальса с двумя константами а и B
А. Н. Фрумкин предложил уравнение состояния двухмерного газа, учитывающее взаимодействие молекул на поверхности:
(л + a/s2,) (s.„ — р)=ЯГ (.111.139)
Где a — постоянная, учитывающая взаимодействие молекул ПАВ на поверхности.
Уравнение (III.139) можно преобразовать в уравнение изотермы адсорбции с двумя константами, которые характеризуют взаимодействия адсорбат-адсорбент и адсорбат-адсорбат. Оно позволяет описывать реальную адсорбцию многих веществ. Взаимодействие молекул ПАВ на поверхности уменьшает поверхностное давление, что равнозначно уменьшению способности ПАВ понижать поверхностное натяжение раствора.
Уравнение двухмерного состояния вещества в адсорбционном слое. Основные типы поверхностных пленок
Для выражения свойств двухмерного состояния вещества в адсорбционном слое применяют уравнение вида 

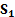


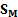
В адсорбционном слое действуют силы как межмолекулярного отталкивания, так и межмолекулярного притяжения. Состояние пленки определяется, с одной стороны, природой веществ, а с другой стороны, концентрацией пленкообразующего вещества. Наиболее полное представление о состоянии поверхностных пленок охватывает классификация А. Адамсона. Согласно этой классификации поверхностные пленки делятся на 4 типа:
1. Газообразные пленки (G-пленки)
В таких пленках молекулы располагаются на большом расстоянии друг от друга и, соответственно, слабо взаимодействуют. Они движутся практически независимо, напоминая по свойствам молекулы газа. На изотерме двухмерного давления газообразное состояние отвечает линейному участку, параллельному оси абсцисс. Образование пленок этого типа характерно для веществ, у которых углеводородная часть содержит 12–22 атомов углерода. Они существуют при низких значениях двухмерного давления или достаточно высоких температурах. Такие пленки аналогичны поверхностным пленкам, которые образуют растворимые ПАВ при очень низкой их концентрации.
2. Жидкорастянутые пленки (LE-пленки или L2-пленки)


3. Жидкие пленки (LC-пленки или L1-пленки)
Они характеризуются малой сжимаемостью, наличием конденсированного состояния – участков «частокола» Ленгмюра и образуются из LE-пленок при высоких значениях двухмерного давления. Их толщина равна длине углеводородной цепи молекулы ПАВ. На изотерме двухмерного давления таких пленок наблюдается резкий подъем.
Между жидким и жидкорастянутным состояниями может существовать переходная область сравнительно высокой сжимаемости, которая отвечает так называемым промежуточным пленкам, природа которых не вполне ясна.
4. Твердые пленки (S-пленки)
Их сжимаемость еще ниже, чем у LC-пленок и почти вся поверхность заполнена молекулами ПАВ в виде частокола Ленгмюра. Наиболее важные различия твердых пленок от жидких обнаруживается при сопоставлении их реологических свойств. В жидких пленках наблюдается их течение уже при малых напряжениях сдвига, а скорость сдвига линейно связана с напряжением. В противоположность, для твердых пленок характерна упругая деформация, они не текут, а при некотором значении напряжения разрушаются.
3. Как можно определить важнейшие характеристики молекул ПАВ: площадь поперечного сечения и длину?
Для определения площади сечения и длины молекул ПАВ используется величина предельной адсорбции Гmax.
Согласно принципу независимости поверхностного натяжения Ленгмюра, предельная адсорбция Гmax одинакова для всех представителей гомологического ряда ПАВ и не зависит от длины углеводородной цепи, а определяется площадью поперечного сечения молекул. В случае предельно заполненного поверхностного слоя дифильные молекулы располагаются на поверхности согласно их гидрофильным и гидрофобным составляющим в виде частокола Ленгмюра. Поскольку в данном случае величина Гmax характеризует количество моль ПАВ, полностью занимающее единицу поверхности, то величина, обратная предельной адсорбции будет равна площади поперечного сечения 1 моль молекул:
Чтобы найти длину молекулы необходимо кроме площади 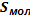
Тогда длина молекулы ПАВ δ определяется как
где М – молярная масса ПАВ; 
Для нахождения параметра предельной адсорбции Гmax можно воспользоваться уравнением Ленгмюра, описывающего зависимость адсорбции вещества от его концентрации в объёмной фазе раствора:
где Г и 
После приведения данного уравнения к линейному виду
и построения графика в координатах (c/Г) = f(c)
находят соответствующие величины Гmax и k, которые используют в расчётах параметров молекул S и 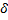
2. Если концентрация растворимого ПАВ небольшая, то используют уравнение состояния поверхностного слоя в разбавленном растворе:
где 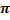
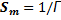
С учётом поправки на собственный объём молекулы :



4.Поверхностное натяжение сухих вин составляет 46-52 мДж/м 2 , что ниже поверхностного натяжения воды (72.75 мДж/м 2 при 293 К). Объясните причину понижения величины σ. Как Вы думаете, какие значения должно принимать поверхностное натяжение для более крепких напитков, например, водки? Дайте обоснованный ответ.
Этиловый спирт, содержащийся в вине имеет поверхностное натяжение 22 мДж/м2, а вода обладает большим значением удельного поверхностного натяжения равным 72,7 мДж/м2. Поэтому при добавлении спирта к воде происходит распределение молекул спирта исключительно в поверхностном слое воды, что вызывает резкое понижение поверхностного натяжения полученного спиртового раствора. Кроме этого в вине в процессе брожения образуются различные органические вещества, которые также снижают величину поверхностного натяжения (эфиры, альдегиды и различные органические кислоты).
Для того, чтобы рассматривать изменение поверхностного натяжения в зависимости от содержания спирта в растворах, можно воспользоваться методом наибольших давлений. По формуле Лапласа давление, обусловленное силами поверхностного натяжения, равно


Используя жидкости с известным коэффициентом поверхностного натяжения и измеряя разность высот жидкости 
Если через жидкость пропускать пузырёк воздуха, то в системах с большим содержанием спирта и соответственно меньшей плотностью избыточное давление 
У раствора спирта с разбавлением водой коэффициент поверхностного натяжения увеличивается.
5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А — Na 2SiO3, В — AgNO3, С — Ag2SiO3
Обменная реакция, протекающая между данными веществами может быть записана в виде:
В случае избытка силиката натрия, используемого в качестве пептизатора, получим следующую структуру мицеллы:
В случае избытка нитрата серебра:
6. Расположите в порядке увеличения прочности связи с мицеллой ионы Na + , Li + , Cs + в случае анионных ПАВ и ионы Cl — , NO3 — , Br — в случае катионных ПАВ.
Для анионных ПАВ при фиксированном анионе величина критической концентрации мицеллообразования снижается в ряду Li+ > Na+ > Cs+, значит прочность связи катиона с мицеллой уменьшается в обратной последовательности: Cs+ > Na+ > Li+
Для катионных ПАВ при фиксированном катионе величина критической концентрации мицеллообразования снижается в ряду Cl- > Br- > NO3— в порядке уменьшения гидратированности, значит прочность связи аниона с мицеллой уменьшается в обратной последовательности: NO3— > Br- > Cl-.
http://kraska.biz/poverxnostnye-yavleniya-i-dispersnye-sistemy/uravneniya-sostoyaniya-poverxnostnyx-pleiok/
http://lektsii.org/4-10305.html