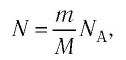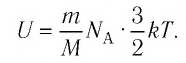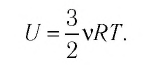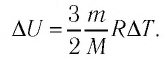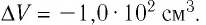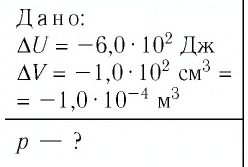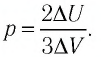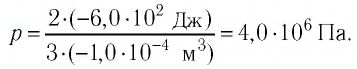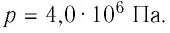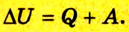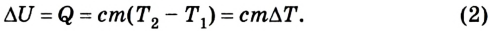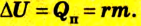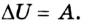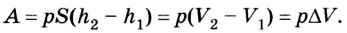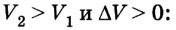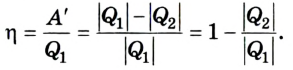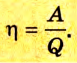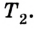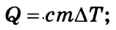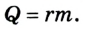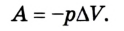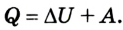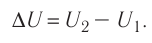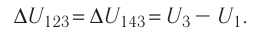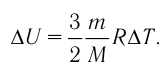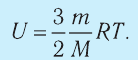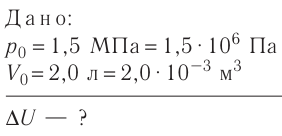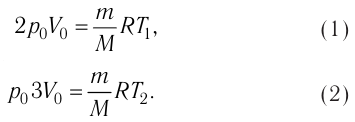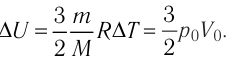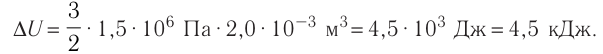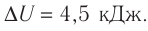Техническая термодинамика. Основные понятия и определения
Техническая термодинамика. Основные понятия и определения.
Предмет и методы технической термодинамики. Понятия термодинамической системы и рабочего тела. Основные параметры состояния, уравнение состояния идеального газа. Теплоемкость.
Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло — и парогенераторов, тепловых машин, аппаратов и устройств.
Техническая термодинамика является одним из разделов общей термодинамики, в который, кроме технической, входят физическая и химическая термодинамика.
Физическая термодинамика – изучение процессов превращения энергии в твердых, жидких и газообразных телах, а также устанавливает общие математические зависимости между термодинамическими параметрами.
Химическая термодинамика – изучает взаимосвязь между химическими и тепловыми процессами прежде всего применительно к состоянию химического равновесия различных компонентов в реагирующих средах. Техническая термодинамика – рассматривает закономерности взаимного превращения тепловой им механической энергии, устанавливает взаимосвязи между тепловыми, механическими и химическими процессами, которые происходят в тепловых и холодильных установках, и изучает процессы, происходящие в газах и парах, которые являются основными рабочими телами в этих установках.
Одной из основных задач технической термодинамики является изыскание наиболее оптимальных способов и условий превращения тепловой энергии в механическую, и наоборот.
В технической термодинамике могут использоваться два метода изучения процессов взаимного превращения теплоты и механической работы.
1. Феноменологический – рассматривает все процессы с макроскопических позиций, не вникая в закономерности поведения носителей энергии рабочего тела.
2. Статистический метод – изучаются закономерности молекулярных и внутри молекулярных процессов.
В технической термодинамике основным методом является феноменологический или макрофизический метод.
Предметом анализа в технической термодинамике прежде всего является рабочее тело, в качестве которого чаще всего используется газы и пары. Это объясняется тем, что газы и пары обладают значительно большим коэффициентом теплового расширения, чем жидкости и твердые тела.
В термодинамике используются два понятия о газе.
Газы, в которых можно пренебречь размерами молекул и силами взаимодействия между ними, называются идеальными газами (сами молекулы принимаются за материальные точки); и наоборот, газы, в которых нельзя пренебречь размерами молекул и силами взаимодействия между ними, называются реальными газами.
Многие газы, которые используются в тепловых двигателях и холодильных машинах в качестве рабочих тел, можно считать идеальными газами, например, продукты сгорания углеводородных топлив (смеси газов), которые являются рабочим телом во всех тепловых двигателях.
Основным реальным газом, который широко используется в тепловых двигателях, является водяной пар.
При анализе термодинамических процессов используется понятие термодинамической системы. Термодинамическая система – совокупность тел, которые находятся во взаимодействии как между собой, так и с окружающей средой (цилиндр с размещенным в нем поршнем). Функционирование термодинамической системы осуществляется за счет изменения параметров рабочего тела. В технической термодинамике эти параметры называются термодинамическими параметрами системы. Так как основными рабочими телами являются газы и пары, то основными термодинамическими параметрами являются давление р, температура Т, удельный объем n (r).
1. Температура – характеризует степень нагретости рабочего тела.
Под температурой газа понимают меру средней кинетической энергии движения молекул газа.
В настоящее время применяют две температурные шкалы: термодинамическую и международную практическую.
Термодинамическая температурная шкала имеет одну воспроизводимую опытным путем постоянную точку – тройную точку воды, которая имеет значение 273,16 К или 0,01 °С (Тройной точкой называется такое состояние вещества, при котором твердая, жидкая и газообразная фаза находятся в равновесии); второй постоянной точкой служит абсолютный нуль температур.
Термодинамическую температурную шкалу называют также абсолютной шкалой.
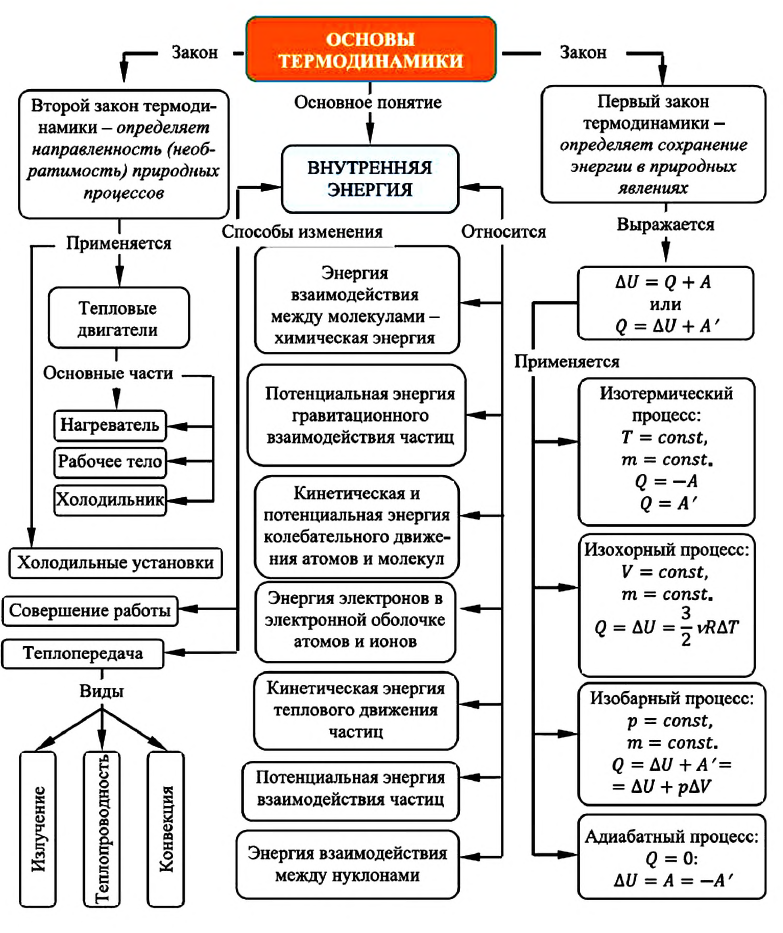
Т- t = 273,16-0,01=273,15, откуда Т = t +273,15, [К].
Параметром состояния тела является абсолютная температура.
2. Удельный объем v – представляет собой объем единицы массы тела:
Величина, обратная удельному объему представляет собой массу единицы объема и носит название плотности: r=1/u [кг/м3].
3. Давление р – в Международной системе единиц (СИ) давление измеряется единицей Н/м2, которая называется Паскаль (Па) – давление, вызываемое силой 1 ньютон, равномерно распределенной по нормальной к ней поверхности площадью 1 м2.
Состояние однородного рабочего тела однозначно определено, если заданы любые два из указанных выше трех основных параметров. Любой третий параметр является однозначной функцией двух заданных параметров. Т. о. любые из этих трех параметров рабочего тела однозначно связаны между собой термическим уравнением состояния рабочего тела. Оно характеризует термодинамическое состояние вещества, находящегося в равновесии, т. е. когда во всей его массе устанавливается постоянство термодинамических параметров состояния. Равновесное состояние рабочего тела или т/д системы можно изобразить графически в координатах любых двух параметров состояния. Естественно, что в равновесном состоянии не происходит никаких превращений энергии. Когда в рабочем теле или в системе изменяется хотя бы один из основных параметров состояния, то говорят, что тело совершает термодинамический процесс. Т. о. термодинамическим процессом называется изменение состояния термодинамической системы во времени.
Термодинамический процесс, при котором рабочее тело или система проходит непрерывный ряд равновесных состояний, называется равновесным термодинамическим процессом.
Термодинамические процессы могут быть обратимые и необратимые. Обратимым термодинамическим процессом называют процесс, допускающий возвращение рабочего тела в первоначальное состояние без того, чтобы в окружающей среде произошли какие-либо изменения. Невыполнение этого условия делает процесс необратимым.
Также существуют и другие параметры состояния рабочего тела: энтропия s, внутренняя энергия u, энтальпия I (Н).
Так как в тепловых двигателях многие рабочие тела можно считать идеальными газами, то для анализа термодинамических процессов широко используется основные законы идеальных газов.
Основные термодинамические процессы: изохорный, изотермический, изобарный, адиабатный, политропный.
Так, если температура газа не изменяется (Т=const), то давление газа и его удельный объем связаны следующей зависимостью (закон Бойля-Мариотта):

Если давление газа остается постоянным (р=const), то соотношение между удельным объемом газа и его абсолютной температурой подчиняется закону Гей-Люссака:

Для газов, взятых при одинаковых температурах и давлениях, имеет место следующая зависимость, полученная на основе закона Авогадро:
где m — молекулярная масса газа.
Так как 
Величина mv представляет собой объем килограмм-молекулы или киломоля (кмоль) газа.
Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к так называемым нормальным условиям, при которых рабочее вещество находится под давлением рн=101325 Па и Тн = 273,15 К (760 мм рт. ст. 
Объем 1 кмоля всех идеальных газов равен 22,4136 м3/кмоль при нормальных условиях.
Плотность газа при нормальных условиях определяется из равенства:
Пользуясь этой формулой, можно найти удельный объем любого газа при нормальных условиях:
Характеристическое уравнение идеального газа или уравнение состояния связывает между собой основные параметры состояния — давление, объем и температуру — и может быть представлено следующими уравнениями:
где р — давление газа, Па;
V— объем газа, м3;
М — масса газа, кг;
v — удельный объем газа, м3/кг;
Vm — объем 1 кмоля газа, м3/кмоль;
R — газовая постоянная для 1 кг газа, Дж/(кг×К);
mR — универсальная газовая постоянная 1 кмоля газа, Дж/(кмоль×К).
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое — к М кг, второе — к 1 кг, третье — к 1 кмолю газа.
Численное значение универсальной газовой постоянной легко получить из последнего уравнения при подстановке значений входящих в него величин при нормальных условиях:

Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения:
где m — масса 1 кмоля газа в кг (численно равная молекулярной массе газа).
Пользуясь характеристическим уравнением для двух различных состояний какого-либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:


Последнее уравнение часто применяют для «приведения объема к нормальным условиям», т. е. для определения объема, занимаемого газом, при р= 101 325 Па и Т= 273,15 К (р = 760 мм рт. ст. и t=0° С), если объем его при каких-либо значениях р и t известен:

В правой части уравнения все величины взяты при нормальных условиях, в левой — при произвольных значениях давления и температуры.
Уравнение можно переписать следующим образом:


Данное уравнение позволяет найти плотность газа при любых условиях, если значение его для определенных условий известно.
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость mc — кДж/(кмоль×К), массовую теплоемкость с- кДж/(кг×К) и объемную теплоемкость с’ — кДж/(м3×К).
В зависимости от давления и температуры в 1 м3 газа могут содержаться различные количества газа. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 его при нормальных условиях (рн= Па (760 мм. рт. ст.) и Тн = 273 К (tн = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
а объемная теплоемкость
Объемная и массовая теплоемкости связаны между собой зависимостью:
где rн — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то
представляет собой среднюю теплоемкость в пределах t1 — t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса.
Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
б) массовую — при постоянном объеме (cv и cvm) и постоянном давлении (ср и срт);
в) объемную — при постоянном объеме (c¢v и c¢vm ) и постоянном давлении (с’р и с’рт).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл.1).
Приближенные значения мольных теплоемкостей
при постоянном объеме и постоянном давлении (с=const)
Уравнения состояния и термодинамические процессы
Как правило, при взаимодействии какого-либо рода в системе одновременно изменяются значения нескольких параметров состояния. Однако опыт показывает, что среди параметров состояния всегда имеется один (и только один) такой параметр, изменение которого в равновесных процессах вызывается взаимодействием только одного определенного рода.
Параметры состояния, обязательно изменяющиеся при наличии взаимодействия данного рода и не изменяющиеся под влиянием взаимодействий иных родов, называются координатами термодинамического состояния. Если происходит изменение некоторой координаты состояния, то можно утверждать, что происходит обмен энергией в соответствующей форме.
Так, при деформационном взаимодействии необходимым и достаточным условием передачи энергии в форме работы является перемещение поршня, на который действует сила давления газа. Перемещение поршня приводит к изменению объема рабочего тела в цилиндре.
Следовательно, координатой деформационного состояния однородного рабочего тела является его объем.
Координатой термического состояния рабочего тела является энтропия. Изменение энтропии свидетельствует о том, что изменение состояния термодинамической системы происходит в результате передачи энергии в форме теплоты.
Как известно, изменение равновесного состояния термодинамической системы возможно только в результате внешних воздействий, а воздействие каждого рода приводит к изменению значения одной из координат состояния. Значит, для определения состояния системы достаточно знать значения всех координат состояния, которые полностью и однозначно определяют данное равновесное состояние. Значение остальных параметров состояния определяются по значениям координат состояния, то есть каждый параметр равновесного состояния системы является однозначной функцией всех координат состояния.
Уравнения, представляющие зависимость параметров (функций) состояния равновесной системы от координат состояния, называются уравнениями состояния термодинамической системы.
Если обозначить произвольную функцию состояния системы через j, а координаты состояния – через х1, х2, …, хn (n – число координат состояния, то есть термодинамических степеней свободы), то уравнение состояния можно представить в виде:
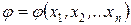
Например, состояние однородной термодеформационной системы описывается уравнениями, содержащими две независимые переменные: координату деформационного состояния – удельный объем u, координату термического состояния – удельную энтропию s. Остальные параметры (функции) состояния, например, температура и давление связаны со значениями координат соответствующими уравнениями состояния в виде:
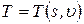
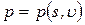
Температура и давление относятся к важной для термодинамического анализа группе величин, которая называется потенциалы термодинамических взаимодействий.
Потенциалом взаимодействия некоторого рода называется параметр состояния, различие значений которого между системой и окружающей средой на контрольной поверхности приводит к возникновению взаимодействия данного рода, то есть к передаче энергии в данной форме между системой и окружающей средой. Потенциалом для теплового взаимодействия является термодинамическая температура, а для деформационного механического взаимодействия – давление. Как правило, уравнения состояния содержат координаты и потенциалы термодинамической системы.
Представленные уравнения состояния для термодеформационной системы неудобны для практического применения, так как энтропия – неизмеряемая величина. Решая совместно эти уравнения, можно исключить энтропию, выразив ее через объем и температуру или через объем и давление. В результате получается термическое уравнение состояния, которое связывает давление, объем и температуру:
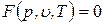
Уравнения состояния систем с двумя степенями свободы, являясь функциями с двумя независимыми переменными, позволяют построить некоторую поверхность, называемую термодинамической поверхностью или поверхностью состояния. Любое равновесное состояние системы изображается точкой, лежащей на этой поверхности. Если точка не лежит на поверхности состояния, то такое сочетание параметров состояния для данной системы невозможно.
Изменение состояния термодинамической системы в результате ее взаимодействия с окружающей средой называется термодинамическим процессом.
В результате осуществления термодинамического процесса происходит обмен энергией между системой и окружающей средой, который возможен лишь при наличии разности соответствующих потенциалов. А наличие разности потенциалов может привести к нарушению равновесия внутри термодинамической системы. Термодинамический процесс, протекающий с нарушением внутреннего равновесия в термодинамической системе, называется неравновесным.
Полное описание неравновесных процессов методами термодинамики невозможно вследствие неопределенности и чрезвычайно сложного характера изменений, происходящих при этом в системе. Поэтому для изучения принципиальных свойств систем при обмене энергией применяется идеализация реальных процессов и рассматриваются равновесные процессы.
Термодинамический процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называется равновесным.
При осуществлении равновесного процесса термодинамическая система проходит ряд бесконечно близких состояний, каждое из которых является равновесным. Каждое промежуточное состояние системы в процессе подчиняется уравнению состояния и изображается соответствующей точкой на термодинамической поверхности. Совокупность таких точек образует на поверхности состояний линию, которая называется линией термодинамического процесса.
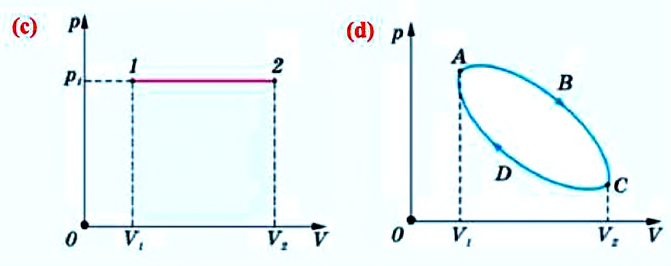
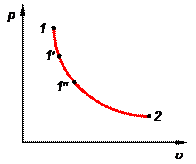 Рис. 1.2. Диаграмма состояния. Рис. 1.2. Диаграмма состояния. | В термодинамике широко используются графические методы анализа процессов. При этом удобнее использовать не пространственные трехмерные изображения линий процессов, а их двухмерные проекции на координатные плоскости. Координатные оси плоских диаграмм состояния соответствуют двум термодинамическим параметрам (рис. 1.2). Например, на р—u-диаграмме изображен какой-то равновесный процесс 1-2. Точки 1, 1¢, 1² и т.д. изображают равновесные состояния термодинамической системы. |
Тема: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»(2 часа)
1. Первый закон термодинамики как закон сохранения и превращения энергии.
2. Свойства работы как формы обмена энергией.
3. Свойства теплоты как формы обмена энергией.
4. Уравнение первого закона термодинамики для закрытых систем
5. Уравнение первого закона термодинамики для открытых систем
Основная литература
1. Амерханов Р.А., Драганов Б.Х. Теплотехника. — М.: Энергоатомиздат, 2006. – 432 с.
Дополнительная литература
1. Теплотехника. /А.П. Баскаков, Б.В. Берг и др. – М.: Энергатомиздат, 1991. – 224 с.
2. Техническая термодинамика. / Кириллин В.А., Сычев В.В., Шейндлин А.Е. – М.: Издательский дом МЭИ, 2008. – 496 с.
Дата добавления: 2015-11-26 ; просмотров: 1571 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Термодинамика — основные понятия, формулы и определения с примерами
Содержание:
Термодинамические системы и макропараметры состояния вещества:
Термодинамический подход основывается на понятии термодинамической системы, которая представляет собой любое макроскопическое тело или совокупность таких тел. Состояние термодинамической системы определяется ее внутренними параметрами, например состоянием движения микрочастиц, из которых состоит тело. Тепловое состояние тела, которое характеризуется температурой, тесно связано со скоростью движения атомов и молекул — чем больше скорость их движения, тем выше температура тела.
Температура тела зависит от скорости движения атомов и молекул, из которых оно состоит, — чем больше скорость, тем выше температура.
Внутреннее состояние тела очень сложно определить через параметры движения микрочастиц, потому что их очень много. Поэтому, чтоб упростить описание состояния термодинамической системы, его связывают с физическими величинами, которые характеризуют тело в целом, независимо от его молекулярного строения. К таким величинам принадлежат, в частности, масса, объем, плотность, давление, температура и т. п.
Их называют макропараметрами системы. Фактически они являются усредненными значениями данных физических величин на протяжении длительного времени.
Температура — один из основных макропараметров термодинамической системы, характеризующий состояние ее теплового или термодинамического равновесия. Сущность данного понятия объясняется течением тепловых явлений и процессов.
Например, из собственного опыта нам известно, что более нагретые тела отдают теплоту менее нагретым, вследствие чего со временем их температуры станут одинаковыми. Если, к примеру, кусочек льда бросить в стакан с теплой водой (рис. 5.1), то лед будет таять, а вода в стакане охлаждаться, отдавая определенное количество теплоты тающему льду. Кроме того, стакан с водой и лед пребывают в состоянии теплообмена с окружающей средой. Поэтому со временем температуры всех этих тел станут одинаковыми.
Тела с более высокой температурой отдают тепловую энергию телам с более низкой температурой; теплообмен происходит до тех пор, пока их температуры не станут одинаковыми.
Следовательно, со временем вследствие теплообмена в термодинамических системах наступает состояние термодинамического равновесия, когда температуры всех тел становятся одинаковыми и теплообмен между ними прекращается. Значение температуры характеризует вполне определенное состояние теплового равновесия термодинамической системы, в котором она пребывает в данный момент. Он может быть изменен в результате термодинамического процесса.
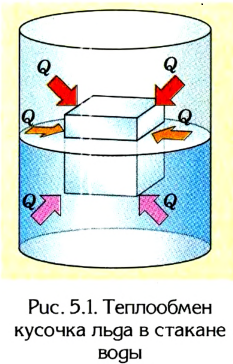
Если, например, на поршень в цилиндре с газом положить груз (рис. 5.2), то объем газа будет изменяться до тех пор, пока давление не сравняется с внешним давлением. Т. е. термодинамическая система «цилиндр — газ» перейдет в иное состояние, характеризующееся новыми значениями макропараметров — давлением 
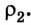
Термодинамика рассматривает в основном состояния термодинамического равновесия и процессы, которые происходят достаточно медленно, и поэтому каждое новое их состояние можно считать равновесным. В состоянии термодинамического равновесия между макропараметрами системы существуют определенные функциональные зависимости, отображаемые уравнениями состояния термодинамической системы.
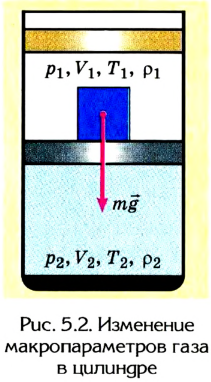
Карта основ термодинамики:
Термодинамическая система
Раздел физики, изучающий тепловые явления в макроскопических системах, называется термодинамикой. В основе термодинамики лежат термодинамические законы, опирающиеся на большое количество экспериментальных фактов. Эти законы отвечают на вопрос «как?», например, как изменяется состояние тела (твердого тела, жидкости или газа) при нагревании (или охлаждении), в каком направлении и как передается тепло, как изменяется температура газа при его расширении и другие. Объектами исследования термодинамики являются термодинамические системы.
Любое макроскопическое тело или система макроскопических тел называется термодинамической системой. Состояние термодинамической системы характеризуется макроскопическими или термодинамическими параметрами (масса, плотность, объем, давление, температура).
Внутренняя энергия
Величины, определяющие состояние термодинамической системы в данный момент времени, то есть соответствующие этому состоянию макроскопические параметры, называются функциями состояния. Основной среди этих величин является внутренняя энергия.
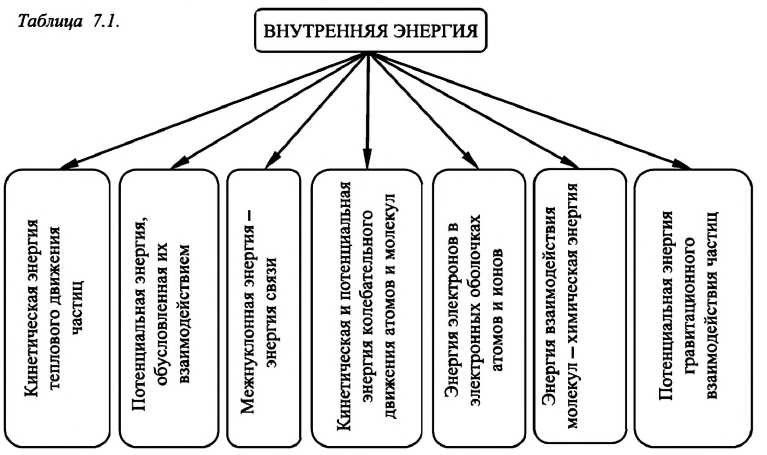
Внутренняя энергия — это сумма кинетических энергий различных видов, движения частиц системы и потенциальных энергий взаимодействия этих частиц (см.: таблица 7.1).
Внутренняя энергия термодинамической системы является функцией температуры и объема, определяющих состояние системы:
Внутренняя энергия одноатомного идеального газа
Газ, молекулы которого состоят из одного атома, называют одноатомным газом. Внутренняя энергия одноатомного газа равна сумме кинетических энергий поступательного движения частиц и потенциальных энергий их взаимодействия:
Однако внутренняя энергия идеального газа данной массы равна сумме средних кинетических энергий хаотического движения частиц:
Средняя кинетическая энергия одной частицы одноатомного идеального газа определяется выражением 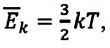
Это выражение является формулой закона Джоуля:
Внутренняя энергия идеального газа зависит от ее массы, рода (молярной массы) и температуры. Даже если давление и объем газа изменятся, при постоянной температуре его внутренняя энергия не изменится.
Сопоставив формулу (7.1) с выражением Менделеева-Клапейрона, получим:
Способы изменения внутренней энергии
Для изменения внутренней энергии термодинамической системы необходимо изменить или среднюю кинетическую энергию теплового движения молекул системы, или потенциальную энергию их взаимодействия, или же изменить обе энергии одновременно. Из многочисленных опытов было определено, что существует два способа изменения внутренней энергии: теплопередача и совершение работы.
Изменение внутренней энергии системы происходит двумя способами: передачей количества теплоты 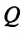
Если внутренняя энергия изменяется только в результате теплообмена, то изменение внутренней энергии равно полученному (или отданному) системой количеству теплоты. Например, при нагревании и охлаждении тела изменение его внутренней энергии определяется так:
Изменение внутренней энергии в процессе плавления твердого тела или кристаллизации жидкости происходит за счет изменения потенциальной энергии взаимодействия молекул тела. Изменение внутренней энергии при этих процессах численно равно теплоте плавления (кристаллизации):
Где 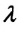
Изменение внутренней энергии тела в процессе парообразования и конденсации также равно затраченному во время этого процесса количеству теплоты:
Где 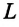
Изменение внутренней энергии одноатомного идеального газа определяется изменением его температуры:
Где 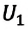
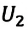
Внимание. Изменение внутренней энергии термодинамической системы зависит не от вида процесса, а от его начального и конечного состояния.
Работа в термодинамике
Если изменение внутренней энергии происходит только в результате совершения механической работы, то это изменение равно или работе внешних сил над системой 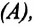
Работа в термодинамике — это одна из мер изменения внутренней энергии термодинамической системы.
Работа газа
Предположим, что в толстостенном цилиндре находится газ, сжимаемый поршнем. При сжатии поршень передает часть своей кинетической энергии молекулам газа, в результате чего увеличивается внутренняя энергия газа и повышается его температура — внешние силы совершают работу над газом. При расширении, наоборот, молекулы газа, передавая часть своей кинетической энергии поршню, уменьшают свою скорость и газ охлаждается — он совершает работу над внешними силами (b).
Таким образом, работа, совершенная газом над внешними силами, в результате расширении газа данной массы при постоянном давлении равна:
Работа же, совершенная внешними силами над газом равна :
Где 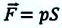
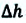
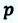
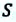

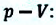
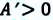
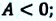
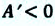
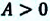
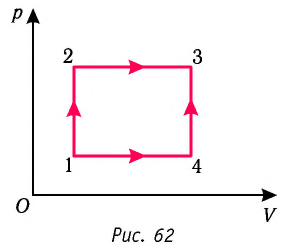
Если в процессе совершения работы газ через некоторое время возвращается в первоначальное состояние, то такой процесс называется замкнутым или циклическим процессом.
Если стрелки, показывающие направление циклического процесса, совпадают с направлением вращения часовых стрелок, то работа газа положительна, а работа внешних сил отрицательна (d). Если же стрелки, определяющие направление процесса, направлены против вращения часовых стрелок, то работа газа отрицательна, а работа внешних сил положительна.
Что такое термодинамическая система
Полную энергию физической системы можно представить как алгебраическую сумму её механической энергии и внутренних энергий тел, образующих систему. Убыль механической энергии системы в ряде случаев происходит при самопроизвольном переходе её части во внутреннюю энергию тел системы. Так, например, режущие инструменты заметно нагреваются при заточке. При скольжении конькобежца под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность теплового движения их молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы, такие, как давление, объём, температура (макропараметры), а не физические характеристики молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру.
Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной.
Что такое внутренняя энергия
Рассматривая полную энергию макроскопического тела, необходимо учитывать не только его механическую энергию (кинетическую и потенциальную), но также и энергию, заключённую внутри самого тела, — внутреннюю энергию.
Внутренняя энергия макроскопического тела — алгебраическая сумма кинетической энергии теплового движения всех частиц, образующих тело, и потенциальной энергии их взаимодействия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему, и является одной из основных физических величин, используемых в термодинамике.
В термодинамике представляет интерес не само значение внутренней энергии системы, а её изменение. Поэтому обычно принимают во внимание только те составляющие внутренней энергии, которые изменяются в рассматриваемых процессах.
Рассмотрим переход некоторой массы идеального газа из состояния 1, в котором его внутренняя энергия 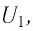
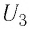
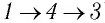
Внутренняя энергия зависит от конкретного состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только от значений параметров этих состояний и не зависит от процесса перехода.
- *
— приращение физической величины, т. е. разность между её конечным и начальным значениями;
— убыль величины, т. е. разность между её начальным и конечным значениями.
Внутренняя энергия идеального одноатомного газа
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, образованного атомами. Например, одноатомными газами являются инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех атомов (или молекул) (потенциальная энергия взаимодействия между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 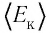
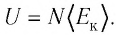
где 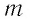
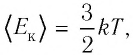
С учётом того, что произведение постоянной Больцмана и постоянной Авогадро 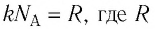
Из формулы (11.1) следует, что внутренняя энергия данной массы идеального одноатомного газа пропорциональна его абсолютной температуре. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы одноатомного идеального газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
Изменить внутреннюю энергию термодинамической системы можно двумя способами: используя теплообмен и совершая работу. Процесс теплообмена и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
Пример решения задачи №1
При изобарном охлаждении внутренняя энергия идеального одноатомного газа изменилась на 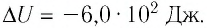
Решение. Приращение внутренней энергии некоторого количества идеального одноатомного газа
Используя уравнение Клапейрона—Менделеева, можно осуществить замену:

Решая совместно уравнения (1) и (2), получим:
Ответ:
Внутренняя энергия тела
Любое макроскопическое тело обладает энергией, что обусловлено его микросостоянием. Эта энергия называется внутренней (обозначается U). Она равна энергии всех микрочастиц вещества, из которых состоит данное тело. Например, внутренняя энергия идеального газа состоит из кинетической энергии всех его молекул, без учета их потенциальной энергии, поскольку взаимодействием молекул в модели идеального газа пренебрегают.
Модель идеального газа предусматривает, что молекулы пребывают на расстоянии нескольких диаметров друг от друга. Поэтому энергия их взаимодействия намного меньше энергии их движения, следовательно, ею можно пренебречь.
В реальных газах, а также в жидкостях и твердых телах внутреннюю энергию необходимо учитывать, потому что она соизмерима с кинетической энергией и существенно влияет на их свойства. В таком случае их внутренняя энергия состоит из кинетической энергии теплового движения микрочастиц и потенциальной энергии их взаимодействия.
Для того чтобы изменить внутреннюю энергию тела, следует фактически изменить или кинетическую энергию теплового движения микрочастиц, или потенциальную энергию их взаимодействия, или и ту и другую вместе. Многовековой опыт человечества убеждает нас в том, что это можно сделать двумя способами — либо в процессе теплообмена, либо в ходе выполнения работы. В первом случае это произойдет вследствие передачи определенного количества теплоты Q; во втором — в результате выполнения работы А.
Изменение внутренней энергии тела может произойти за счет теплообмена или в результате выполнения работы:
Следовательно, передача количества теплоты и выполнение работы являются факторами, благодаря которым можно изменить внутреннюю энергию тела:
В случае, когда происходит лишь теплообмен, полученное или отданное телом количество теплоты полностью идет на изменение его внутренней энергии, в частности кинетической энергии его атомов и молекул: 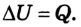
В процессе плавления или кристаллизации твердых тел внутренняя энергия изменяется за счет потенциальной энергии взаимодействия микрочастиц, потому что происходит структурная перестройка вещества. В данном случае изменение внутренней энергии равно теплоте плавления (кристаллизации) тела:
где 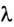
Если изменение внутренней энергии тела происходит вследствие теплообмена, то 
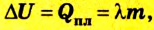
Испарение жидкости или конденсация пара также ведет к изменению внутренней энергии, которая равна в таком случае теплоте парообразования: 
где r — удельная теплота парообразования (конденсации) жидкости.
Изменение внутренней энергии тела вследствие выполнения механической работы (без теплообмена) равно значению работы:
Следовательно, с точки зрения молекулярной физики внутренняя энергия тела является суммой кинетической энергии теплового движения атомов, молекул и других частиц, из которых оно состоит, и потенциальной энергии их взаимодействия. Это энергия термодинамической системы, которая зависит от ее внутреннего состояния. Поэтому вычисляют изменение внутренней энергии 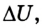
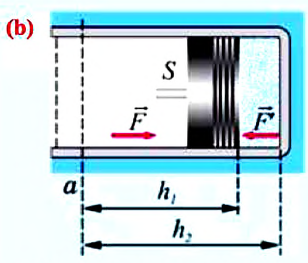
Работа газа
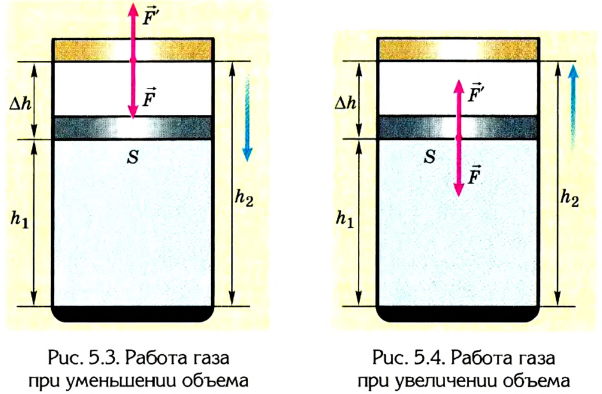
Вычисление выполненной работы в термодинамике связывают с макропараметрами системы. Рассмотрим газ, находящийся в цилиндре под поршнем площадью S (рис. 5.3).
Пусть на газ действует поршень, вызывая его сжатие. Под действием силы F поршень опускается на высоту 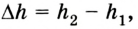
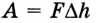
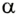
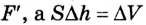
Поскольку 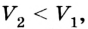
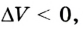
Если под действием силы давления F’ газ расширяется (рис. 5.4), т. е. он сам выполняет работу 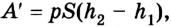
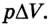
Во время незначительных изменений объема и при постоянном давлении формулы (1) и (2) справедливы не только для газов, но и иных термодинамических систем. Поскольку изменение объема при постоянном давлении сопровождается изменением температуры тела, то можно сделать вывод, что выполнение работы в термодинамике вызывает изменение состояния тела, ведь при этом изменяются его температура Т и объем V.
Первый закон термодинамики
Тот факт, что внутреннюю энергию тела можно изменить двумя способами — в результате выполнения работы или за счет теплопередачи, вынуждал ученых искать соотношение между соответствующими величинами. Вначале в 1842 г. немецкий естествоиспытатель Р. Майер теоретически установил, а затем в 1843 г. английский ученый Дж. Джоуль экспериментально измерил эквивалентность значений количества теплоты и работы. В соответствии с полученными результатами ученые сделали обобщения, которые касались сохранения энергии в природе: энергия в природе не возникает из ничего и не пропадает бесследно; она лишь переходит из одного вида в другой.
Позже этот фундаментальный закон природы приобрел логическую форму первого закона термодинамики: переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, равной сумме работы внешних сил и количества теплоты, переданной системе:
В каком бы состоянии не было тело, оно обладает определенной внутренней энергией. Однако нельзя утверждать, что оно содержит определенное количество теплоты либо запас выполненной работы. Независимо от того, каким из этих способов произведено изменение состояния тела, его состояние однозначно определяется внутренней энергией. Например, газ может быть нагрет за счет передачи ему некоторого количества теплоты либо в результате выполнения внешними силами над ним работы (сжатие газа). Однако невозможно однозначно указать, благодаря какому из этих процессов — выполнению работы или теплопередаче — произошло нагревание газа.
Если система сама выполняет работу (А = -А’), то первый закон термодинамики приобретает другой вид:
т. е. передача термодинамической системе определенного количества теплоты вызывает изменение ее внутренней энергии или выполнение работы, либо то и другое одновременно.
Еще в 1775 г. Французская академия наук приняла решение не рассматривать проекты вечных двигателей.
Последняя формулировка первого закона термодинамики важна с точки зрения отрицания возможности создания вечного двигателя: нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне. Ведь, если количество теплоты Q = 0, то А’ = 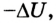
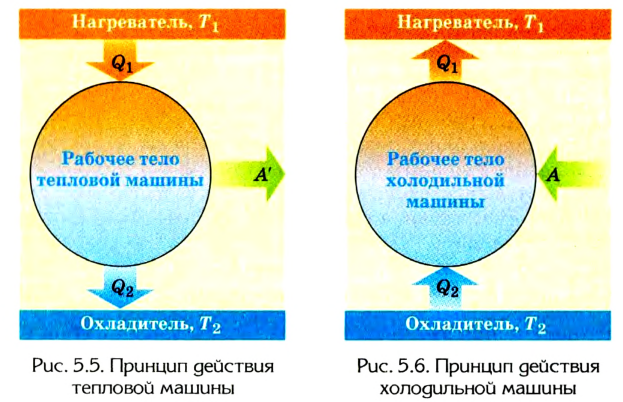
Тепловые двигатели
Человечество научилось использовать тепловую энергию, создав тепловые машины и двигатели. В основу их действия положена идея, что выполнение механической работы может осуществляться за счет теплоты, получаемой от какого-либо нагревателя и частично отдаваемой холодильнику.
Принцип действия тепловой машины можно представить схематически (рис. 5.5). Нагреватель передает рабочему телу определенное количество теплоты 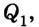
может быть газ или пар, выполняющие работу вследствие своего расширения при нагревании. В паровых турбинах это происходит благодаря паровым котлам, в двигателях внутреннего сгорания — в результате сгорания топливной смеси, в реактивных двигателях — за счет большой теплоотдачи топлива во время быстрого его сгорания.
Выполняя работу, рабочее тело отдает определенную часть количества теплоты 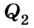
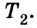
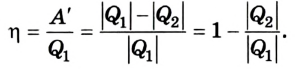
Согласно закону сохранения энергии значение выполненной работы 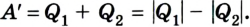
Следовательно, коэффициент полезного действия тепловой машины всегда меньше 1 (часто его представляют в процентах). К примеру, у двигателей внутреннего сгорания он равен приблизительно 44 %, у паровых турбин — до 40 %.
Коэффициент полезного действия равен отношению величины выполненной работы к затраченной при этом энергии:
Холодильник также является тепловой машиной. Принцип его действия основан на обратимости цикла тепловой машины. Холодильная машина работает как тепловой насос: она отбирает тепловую энергию у менее нагретого тела и передает ее более нагретому (рис. 5.6). Это не противоречит законам термодинамики, поскольку охлаждение происходит за счет выполнения работы.
Для того чтобы привести в действие холодильную машину, необходимо над рабочим телом выполнить работу. В таком случае нагревателю будет передаваться количество теплоты, превышающее по значению то, которое отбирается у охладителя: 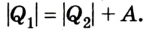
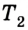
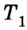
Эффективность работы холодильной машины характеризуется отношением количества теплоты 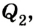
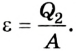
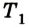
Основные определения и формулы
В основу термодинамического подхода положено описание термодинамической системы при помощи легко измеримых макропараметров — температуры (Т), давления (р), объема (V), массы (m) и др.
Внутренняя энергия тела равна энергии всех микрочастиц вещества, из которых оно состоит. Ее можно изменить за счет теплообмена или в результате выполнения работы. Количество теплоты, переданное телу (либо отобранное у него), определяется в зависимости от теплового процесса, который при этом осуществляется:
при нагревании (охлаждении )
при плавлении (кристаллизации )
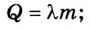
при парообразовании (конденсации)
Работа газа при постоянном давлении (р = const) равна: 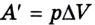
Первый закон термодинамики устанавливает, что количество теплоты, переданное термодинамической системе, вызывает изменение ее внутренней энергии или выполнение работы, либо и той другое одновременно:
Он отражает сущность фундаментального закона сохранения энергии, которым отрицается возможность создания вечного двигателя: нельзя создать машину, которая неограниченно выполняла бы работу, не получая энергию извне.
Законы термодинамики получили широкое практическое применение, в частности, в технике, при конструировании тепловых машин. Все тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, паровые и газовые турбины, холодильные машины и пр.) построены по принципу выполнения механической работы за счет внутренней энергии. Их КПД всегда меньше 1 и равен:
Основы термодинамики
В 9 классе вы узнали, что полная энергия физической системы представляет собой сумму её механической энергии и внутренних энергий тел, образующих систему. Причём изменение механической энергии в ряде случаев происходит в результате перехода её части во внутреннюю энергию тел системы. Режущие инструменты заметно нагреваются при заточке их на точильном камне. При скольжении конькобежца по льду под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность хаотического движения молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
Выводы термодинамики основаны на фундаментальных законах, называемых началами термодинамики. Эти законы установлены в результате обобщения многочисленных экспериментальных фактов. Опираясь на них, термодинамика позволяет делать определённые выводы о свойствах исследуемых систем, которые подтверждаются экспериментально. Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором параметров, определяющих её состояние. В отличие от молекулярно-кинетической теории в термодинамике не рассматривают микроскопическое строение тел и для их описания используют не физические характеристики молекул (микропараметры), а параметры системы (макропараметры), такие как давление, объём, температура.
Замкнутая, или же изолированная, термодинамическая система стремится к равновесию, когда все её макропараметры не изменяются с течением времени. Иначе говоря, для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, в которое она переходит самопроизвольно.
Это утверждение называют нулевым началом термодинамики.
Говоря о полной энергии макроскопического тела, необходимо всегда учитывать не только его механическую энергию (кинетическую и потенциальную), но также кинетическую энергию теплового движения его частиц и потенциальную энергию их взаимодействия. В термодинамике под внутренней энергией тела понимают полную энергию, относящуюся к самим частицам, образующим тело. Это кинетическая энергия теплового движения молекул, кинетическая энергия движения атомов внутри молекул, потенциальная энергия взаимодействия между молекулами, энергия электронных оболочек атомов и внутриядерная энергия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему.
В термодинамике главную роль играет не сама внутренняя энергия, а её изменение, которое происходит при переходе системы из одного состояния в другое. Под приращением (изменением) внутренней энергии понимают разность внутренних энергий в конечном и начальном состояниях:
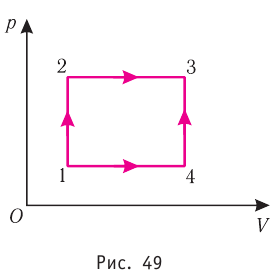
Например, переход некоторой массы идеального газа из состояния / в состояние 3 (рис. 49) можно осуществить или в ходе процесса 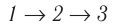
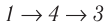
Внутренняя энергия является функцией состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
Внутренняя энергия идеального одноатомного газа:
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, состоящего из отдельных атомов. Например, к одноатомным газам относят инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех молекул или атомов (взаимодействие между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 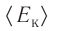
т. е. 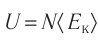
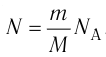
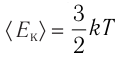
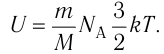
С учётом того, что 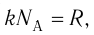
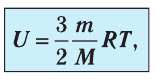
или
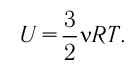
Как видно из формулы (9.1), внутренняя энергия данной массы идеального одноатомного газа пропорциональна абсолютной температуре газа. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы идеального одноатомного газа происходит только при изменении его температуры: 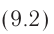
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
При изучении физики в 8 классе вы узнали, что изменить состояние термодинамической системы можно двумя способами: используя теплопередачу и совершая работу. Процесс теплопередачи и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
- Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором макронараметров, определяющих её состояние.
- Состояние изолированной термодинамической системы, когда все её макропараметры не изменяются с течением времени, называют равновесным.
- Под внутренней энергией термодинамической системы понимают сумму кинетической энергии всех частиц системы и потенциальной энергии их взаимодействия.
- Изменение внутренней энергии тела при переходе из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
- Внутренняя энергия данной массы идеального одноатомного газа зависит только от температуры:
Пример решения задачи №2
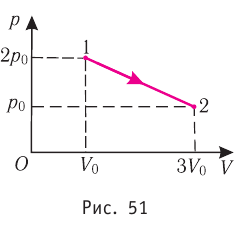
На рисунке 51 в координатах (р, V) изображён процесс перехода идеального одноатомного газа определённой массы из состояния 1 в состояние 2. Определите приращение внутренней энергии газа, если давление газа в конечном состоянии 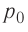
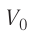
Приращение внутренней энергии идеального одноатомного газа 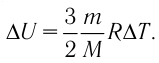
изменение температуры 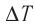
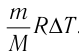
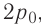
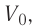
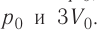
Вычтем из уравнения (2) уравнение (1): 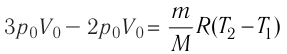
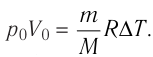
Ответ:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Освоение космоса — история, этапы и достижения с фотографиями
- Закон сохранения механической энергии в физике
- Релятивистская механика в физике
- Теория относительности Эйнштейна
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://helpiks.org/6-233.html
http://www.evkova.org/termodinamika















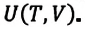
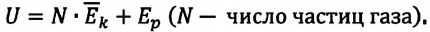
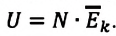
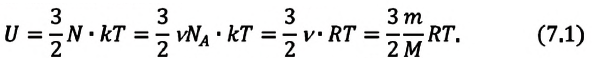


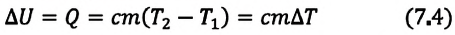


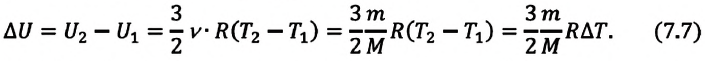

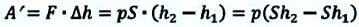

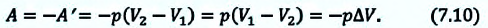
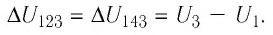
 — приращение физической величины, т. е. разность между её конечным и начальным значениями;
— приращение физической величины, т. е. разность между её конечным и начальным значениями;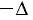 — убыль величины, т. е. разность между её начальным и конечным значениями.
— убыль величины, т. е. разность между её начальным и конечным значениями.