Лабораторная работа 2.4 УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА Цель работы Краткая теория
- Александр Малышко 5 лет назад Просмотров:
1 Лабораторная работа 2.4 УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА Цель работы Целью лабораторной работы является экспериментальное подтверждение закономерностей поведения реального газа Краткая теория Физическим газом называется вещество, находящееся в газообразном состоянии. «Идеальный газ» — модель, хорошо описывающая физический газ, находящийся в сильно разреженном состоянии (при не слишком больших давлениях и достаточно высоких температурах). Молекулы идеального газа являются материальными точками и на расстоянии не взаимодействуют друг с другом. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона) имеет вид V = nrt, (2.4.1) где р давление газа; V объем газа; n количество молей; R универсальная газовая постоянная, равная 8,31 Дж/(моль К); Т абсолютная температура газа. Более точная модель физического (реального) газа была предложена Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы по сравнению с моделью «идеальный газ». Иногда эту модель называют «реальный газ». Между молекулами реального газа действуют силы притяжения и отталкивания.
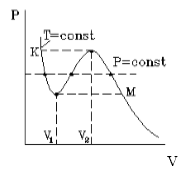
2 Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) имеет следующий вид: æ 2 aö ç n + V -nb = nrt V ( ), (2.4.2) 2 è ø где а и b константы Ван-дер-Ваальса. Добавка к внешнему давлению притяжением молекул друг к другу. (а) обусловлена взаимным Поправка к объему (b) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в газе. Изотермой называется зависимость давления от объема газа при постоянной температуре. /// н.п // н.п / н.п V ж K ( T / 3 На рис приведены изотермы некоторого физического (реального) газа, а на рис изотермы Ван-дер-Ваальса. При некоторой температуре Т, которая называется итической, на изотерме наблюдается только одна точка перегиба К, а экстремумы отсутствуют. Точка К называется итической точкой, а соответствующие ей объем V, давление р и температура Т называются итическими. Касательная к изотерме в точке К параллельна оси абсцисс. Уравнения для итических параметров a 8a V = 3b, =, T 2 =. (2.4.3) 27b 27Rb Тогда некоторой параметр А для одного моля реального газа V 3 A = = = 0,375, (2.4.4) RT 8 а для числа молей газа ν А / = А ν = 0,375 ν. (2.4.5) При температуре выше итической вещество может находиться только в газообразном состоянии. При температуре ниже итической вещество может находиться как в газообразном, так и в жидком состояниях. Жидкое состояние описывается левыми (по отношению к точке перегиба) частями графиков на рис , а, 2.4.3, б и характерно тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически не сжимается). Изотермы Ван-дер-Ваальса примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества. Рис , б разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют две фазы, S-образный участок ( ) изотермы Ван-дер-Ваальса заменяется горизонтальным участком (1 4) реальной изотермы.
4 Состояния, соответствующие участку 2 3, не могут быть dv реализованы, так как сжимаемость вещества b = здесь отрицательна. d Участок 3 4 соответствует переохлажденному пару. Это состояние реализуется при практическом отсутствии центров конденсации и внешних воздействий. Участок 1 2 соответствует перегретой жидкости. Это состояние реализуется при отсутствии примесей, способных быть центрами кипения Порядок выполнения работы Запустите программу «Отытая физика 1.1». Выберите «Термодинамика и молекулярная физика», «Изотермы реального газа». Нажмите вверху внутреннего окна кнопку с изображением страницы. Прочитайте аткие теоретические сведения. Заойте внутреннее окно, нажав кнопку с естом справа вверху этого окна. Внимательно рассмотрите рисунок 2.4.3, найдите все регулируемые величины и запишите их в соответствующую таблицу в отчете (см. с. 6). Рис Изотермы реального газа
5 Нажмите мышью кнопку «Старт». Наблюдайте перемещение поршня на левой картинке модели и перемещение маленького квадратика по асной ивой теоретической адиабаты. Попробуйте останавливать процесс нажатием кнопки «Стоп» на эане. Последующий запуск процесса осуществляется нажатием кнопки «Старт». 1. Определение итических параметров Щелкните левой кнопкой мыши, когда ее маркер на кнопке «Выбор». Подведите маркер мыши к кнопке у верхней границы столбика на регуляторе температуры и нажмите левую кнопку мыши. Удерживая кнопку в нажатом состоянии, перемещайте границу столбика до тех пор, пока на правом эане не появится итическая изотерма с точкой перегиба и без экстремумов. Запишите в свой отчет под табл значения итических параметров Т, V,. 2. Исследование изотерм газа Ван-дер-Ваальса 1. Нажмите кнопку «Выбор» и установите температуру Т 1 из таблицы начальных значений для вашей бригады. 2. Запустите процесс, нажав кнопку «Старт», и останавливайте, нажимая кнопку «Стоп», когда маленький квадратик на теоретической изотерме (асная ивая) будет находиться в точках, соответствующих объемам 0,1; 0,12; 0,14; 0,16; 0,18 и 0,2 дм 3 (6 значений), записывая при остановке значения в табл в первую пустую строку. Если у вас не получается останавливать процесс точно в указанных точках, то можно провести измерения в пошаговом режиме. Для этого щелкните мышью кнопку в верхнем ряду кнопок. Нажмите кнопку «Старт».
6 Нажимайте мышью несколько раз кнопку «u» вверху окна, пока не достигните нужного значения объема. Запишите необходимые величины. Для продолжения эксперимента опять нажимайте кнопку «u», пока не достигните следующего значения объема, и т. д. Для завершения эксперимента нажмите кнопку «uu». 3. Устанавливая по очереди следующие значения температуры (Т 2 Т 4 ) из табл , повторите измерения, записывая результаты также в табл Значения температуры Таблица Бригада Т Т Т Т Результаты измерений Таблица V, дм 3 0,1 0,12 0,14 0,16 0,18 0,2, кпа Т 1 = К Т 2 = К Т 3 = К Т 4 = К 1/V, м Обработка результатов измерений 1. Рассчитайте в системе СИ величину, обратную объему, и запишите результаты в табл По измеренным значениям итических параметров вычислите константу А для одного моля газа. А = RT V. (2.4.6)
7 3. По данным табл постройте на одном рисунке графики экспериментальных зависимостей давления р от обратного объема 1/V для всех изотермических процессов (указав на них температуры). 4. Для каждого графика на линейной части зависимости определите (см. с. 7) число молей вещества, используя формулу 1 D( ) n =. (2.4.7) RT D(1 V ) 5. Вычислите среднее значение n и экспериментальное значение константы А / по формуле (2.4.5). 6. Используя значение параметра А, рассчитанное в п. 1 через итические параметры, вычислите теоретическое значение константы А /. 7. Рассчитайте относительную и среднюю абсолютную погрешности определения А / (см. с. 8). 8. Запишите ответ для А / и вывод. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое физический газ? 2. Что такое идеальный газ? При каких условиях физический газ можно описывать моделью идеального газа? 3. Запишите уравнение состояния идеального газа. 4. Запишите уравнение состояния реального газа. 5. Что определяют константы Ван-дер-Ваальса? 6. Что такое изотерма? 7. В чем особенности итической изотермы? 8. Какова особенность поведения газа при температуре выше итической? Ниже итической? 9. На каких участках изотермы Ван-дер-Ваальса примерно совпадают с изотермами реального газа?
Уравнение Ван-дер-Ваальса
Вы будете перенаправлены на Автор24
Что такое реальный газ
Реальным газом называют газ, между молекулами которого существуют заметные силы взаимодействия. В неидеальных, газах под высоким давлением, газах с большой плотностью взаимодействие молекул велико и его необходимо учитывать. Силы притяжения играют наиболее существенную роль на больших расстояниях между молекулами. Расстояние уменьшается, силы притяжения растут, но до определенного предела, затем они начинают уменьшаться и переходят в силы отталкивания. Притяжение и отталкивание молекул можно разделить и рассматривать и учитывать отдельно друг от друга.
Уравнение Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса, описывающее состояние 1 моля реального газа, имеет вид:
где d- диаметр молекулы,
величина a вычисляется по формуле:
где $W_p\left(r\right)$- потенциальная энергия притяжения двух молекул. Необходимо заметить, что газовая постоянная имеет индивидуальное значение для каждого вещества. Она отличается от молярной газовой постоянной, причем она меньше, что говорит об объединении молекул вещества в комплексы около критического состояния. Вдали от критических состояний можно использовать универсальную газовую постоянную.
С увеличением объема роль поправок в уравнении (1) становится менее существенной. И в пределе уравнение (1) переходит в уравнение состояния идеального газа для 1 моля (4):
Уравнение (4) — уравнение Менделеева — Клайперона, где m- масса газа, $R=8,31\ \frac<Дж><моль\cdot К>$- универсальная газовая постоянная.
Это согласуется с тем фактом, что при уменьшении плотности реальные газы по своим свойствам приближаются к идеальным.
Уравнение (1) может быть записано в вириальной форме:
Для анализа изотерм уравнение (1) удобнее представить в виде:
Рассматриваемое уравнение может описывать и свойства жидкости, например плохую ее сжимаемость.
На рис.1 изображена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T, построенная из соответствующего уравнения.
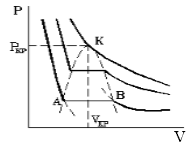
Такая зависимость на практике невозможна. Опыт показывает, что график должен иметь вид рис.2 то есть существуют области, в которых при изменении объема давление неизменно. В некоторых отрезках график изотермы параллелен оси V (рис 2). Это область фазового перехода. Жидкость и газ существую одновременно.
По мере увеличения температуры участок, отражающий состояние нахождения газа одновременно в двух фазах на графиках p(V), сужается и превращается в точку (рис. 2). Это особая точка К, в которой пропадает различие между жидкостью и паром. Это так называемая критическая точка.
Готовые работы на аналогичную тему
Итак, уравнение Ван-дер-Ваальса описывает поведение газов близких к реальным. Их можно применить к газообразной и жидкой фазам вещества. Эти уравнения отражают существование фазового перехода газ — жидкость. Показывают наличие критической точки перехода. Однако абсолютно точных количественных результатов расчеты, в которых используются вышеназванные уравнения, не дают.
Задание: Газ в количестве 1 моль находится в сосуде объемом V л при температуре $T_1$ давление газа $p_1$, а при $T_2$ давление газа $p_2$. Найти постоянные Ван-дер-Ваальса.
Запишем уравнение Ван-дер-Ваальса для одного моля реального газа для состояний 1 и 2:
Раскроем скобки в (1.1):
Вычтем $\left(1.4\right).\ из\ \left(1.3\right):$
Выразим a из (1.1):
Задание: Для реального газа, используя уравнение Ван-дер-Ваальса, получите уравнение адиабаты в параметрах V и T.
\[\delta Q=dU+\partial A=0\ \left(\ 2.1\right)\]
Так как процесс адиабатный, то он идет теплообмена. Перепишем уравнение (2.1) для ван-дер-ваальсовского газа, зная, что:
Из уравнения Ван-дер-Ваальса:
Подставим (2.5) в (2.4), разделим переменные:
Ответ: Уравнение адиабаты для заданного случая имеет вид: $<\left(V-b\right)>^<\frac<2>\nu >T=const.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 15 01 2022
http://spravochnick.ru/fizika/molekulyarnaya_fizika/uravnenie_van-der-vaalsa/