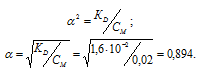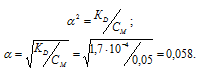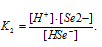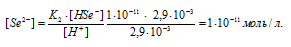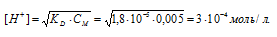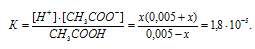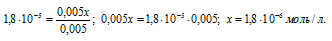Написать ступенчатые диссоциации сернистой кислоты ; гидроксида кальция.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Сернистая кислота
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Сернистая кислота
Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Гафарова А.З
Цель урока:
Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот.
Рассмотреть свойства соединения серы – сернистого газа и сернистой кислоты его солей.
Рассмотреть влияние сернистого газа на окружающую среду и здоровье человека.
уметь составлять уравнения реакций в молекулярном виде и с точки зрения окислительно — восстановительных процессов.
Нравственное и эстетическое воспитание учащихся к окружающей среде.
Получение оксидов
1. Горение веществ (Окисление кислородом)
а) простых веществ
Mg +O2=2MgO S+O2=SO2
б) сложных веществ
2H2S+3O2=2H2O+2SO2
2.Разложение сложных веществ
а) солей
СaCO3=CaO+CO2
б) оснований
Cu (OH)2=CuO+H2O
в) кислородсодержащих кислот
H2SO3=H2O+SO2
1)Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV)
2H2S-2 + 3O2 → 2H2O + 2S+4O2↑
оксид серы (IV)
2) При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SО2 и частично оксид серы (VI) SO3:
S + O2 = SO2
оксид серы (IV)
Нахождение в природе
Химические свойства кислот
1. Изменяют окраску индикатора.
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
3. С основными (амфотерными) оксидами
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот — если образуется соль, выпадающая в осадок или выделяется газ: ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Уравнение диссоциации сернистой кислоты.
H2SО3 → H+ + HSО3 —
HSО3 — ↔ H+ + SО3 2-
Это кислота средний силы, существует только в водных растворах.
Она дает 2 типа солей:
HSО3 — SО3 2-
гидросульфиты сульфиты
Качественная реакция на сульфиты.
Взаимодействие соли с сильной кислотой, при этом выделяется газ с резким запахом
Na2SO3+H2SO4=Na2SO4+S02+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2+2H2O
2HSO3-+2H+=2SO2+2H2O
Физиологическое действие на организм.
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отек легких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу береза и дуб, наименее — роза, сосна и ель.
Воздействие
на атмосферу.
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
§12
стр34 №5
составить уравнения реакций в ионном и сокращенном ионном виде.
Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
http://infourok.ru/sernistaya-kislota-4775464.html
http://buzani.ru/zadachi/khimiya-glinka/1175-stepen-dissotsiatsii-sernistoj-kisloty-zadachi-511-513