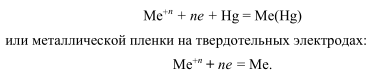Модуль 3. Лекция 8
Модуль 3. Лекция 8.
1. Полярографический анализ (полярография). Общие понятия, принцип метода.
Полярографический анализ (полярография) основан на использовании следующих зависимостей между электрическими параметрами электрохимической (в данном случае — полярографической) ячейки, к которой прилагается внешний потенциал, и свойствами содержащегося в ней анализируемого раствора.
а) В качественном полярографическом анализе используют связь между величиной приложенного на микроэлектроде внешнего электрического потенциала, при котором наблюдается восстановление (или окисление) анализируемого вещества на микроэлектроде в данных условиях, и природой восстанавливающегося (или окисляющегося) вещества.
б) В количественном полярографическом анализе используют связь между величиной диффузионного электрического тока, устанавливающегося в полярографической ячейке после достижения определенного значения приложенного на микроэлектроде электрического потенциала, и концентрацией определяемого (восстанавливающегося или окисляющегося) вещества в анализируемом растворе.
Электрические параметры — величину приложенного электрического потенциала и величину диффузионного тока — определяют при анализе получаемых поляризационных, или вольт-амперных, кривых, отражающих графически зависимость электрического тока в полярографической ячейке от величины приложенного потенциала микроэлектрода. Поэтому полярографию иногда называют прямой вольтамперометрией.
Рис. 1. Схема полярографической ячейки с ртутным капающим электродом и с ртутным анодом (а) или с насыщенным каломельным электродом (б):
1 — ртутный капающий электрод, 2 — ртутный анод, 3 — анализируемый раствор, 4 — резервуар с жидкой ртутью, 5 — проводники к внешнему источнику постоянного тока, 6 — насыщенный каломельный электрод, 7— пробка из пористого стекла
Классический полярографический метод анализа с применением ртутного капающего (капельного) электрода был разработан и предложен в 1922 г. чешским ученым Ярославом Гейровским (1890—1967), хотя сам ртутный капающий электрод применялся чешским физиком Б. Кучерой еще в 1903 г. В 1925 г. Я. Гейровский и М. Шиката сконструировали первый полярограф, позволивший автоматически регистрировать поляризационные кривые. В дальнейшем были разработаны различные модификации полярографического метода.
Рассмотрим кратко сущность классической полярографии, основанной на использовании ртутного капающего микроэлектрода.
На рис. 1, а показана схема полярографической ячейки с ртутным капающим микроэлектродом — катодом. В сосуде, в который вносится анализируемый раствор с определяемым веществом, имеются два электрода — микрокатод и макроанод, подключенные к внешнему источнику постоянного электрического тока. На микрокатод прилагается постепенно возрастающий по абсолютной величине отрицательный электрический потенциал.
Рис. 2. Полярограмма водного щелочного 0,0005 моль/л раствора нитрата свинца при 25 °С ( i — ток, Е — потенциал):
1 — остаточный ток, 2 — предельный ток. Значения потенциала даны относительно насыщенного каломельного электрода, iD — диффузионный ток, Е1/2 — потенциал полуволны
Поверхность ртутного капающего микроэлектрода, т. е. ртутной капли, очень мала, тогда как поверхность анода — большая.
В качестве макроэлектрода — анода на практике наиболее часто применяют не ртутный, а насыщенный каломельный электрод (рис.1, б), по отношению к которому обычно и измеряют потенциал капающего ртутного микрокатода.
Анализируемый раствор содержит кроме определяемого вещества также индифферентный — фоновый — электролит (фон), ионы которого не разряжаются на электродах в условиях проведения полярографического анализа, а служат в качестве токопроводящих частиц для поддержания определенной величины электрического тока в ячейке, когда определяемое вещество еще не восстанавливается на микрокатоде.
Пусть определяемое вещество — это катионы Мn+, присутствующие в анализируемом растворе.
2.2. Полярографические кривые, потенциал полуволны, связь величины диффузионного тока с концентрацией.
На рис. 2. показано изменение электрического тока i, проходящего через полярографическую ячейку, как функции возрастающего потенциала Е, приложенного на ртутном капающем микрокатоде, — так называемая поляризационная, или вольт-амперная, кривая. При постепенном повышении приложенного потенциала вначале электрический ток, обусловленный присутствием ионов фонового электролита, растворенного кислорода и восстанавливающихся возможных примесей, возрастает очень медленно — остается почти постоянным. Это — так называемый остаточный ток. При некотором значении потенциала, называемого потенциалом выделения, ток в ячейке резко возрастает (фарадеевский ток) и при сравнительно небольшом дальнейшем повышении потенциала достигает максимального, возможного в данных условиях значения, после чего снова изменяется мало. Это — так называемый предельный ток. Разность между предельным и остаточным током составляет диффузионный ток iD.
Ртутная капля по мере ее формирования на конце капилляра (вытекания из капилляра) остается заряженной отрицательно до тех пор, пока она не оторвется от капилляра и окруженной раствором. В поверхностном приэлектродном слое раствора около ртутной капли находятся катионы Мn+ определяемого вещества, которые разряжаются на ртутной капле по схеме
амальгама металла М
при достижении величины потенциала выделения, характерного и специфичного только для данных катионов. После достижения потенциала выделения эти катионы очень быстро разряжаются на ртутной капле, поэтому электрический ток в полярографической ячейке резко возрастает. Концентрация катионов Мn+ в поверхностном приэлектродном слое раствора около ртутной капли столь же резко понижается (поскольку катионы восстанавливаются до металла) и становится меньше их концентрации в объеме анализируемого раствора.
Транспорт катионов Мn+ в поверхностный приэлектродный слой раствора, окружающий ртутную каплю, поддерживается за счет диффузии катионов Мn+ из объема раствора и зависит от скорости их диффузии. При дальнейшем повышении приложенного потенциала ртутных капель достигается максимально возможная скорость диффузии, которая остается практически постоянной, так что при данной концентрации катионов в растворе ток в полярографической ячейке также достигает максимального, практически постоянного значения. Устанавливается стационарный предельный ток.
Если концентрацию катионов Мn+ в растворе увеличить, то увеличится и число стационарно восстанавливающихся катионов, т. е. возрастает предельный и диффузионный ток. Таким образом, величина предельного и диффузионного тока в полярографической ячейке зависит от концентрации определяемого вещества (восстанавливающегося на ртутном капающем электроде) в анализируемом растворе, тогда как значение потенциала выделения зависит от природы разряжающихся частиц и не зависит от их концентрации.
Количество катионов, восстанавливающихся на ртутном капающем электроде, незначительно и практически не сказывается на изменении концентрации этих катионов в объеме раствора.
Вещество, разряжающееся на микрокатоде, называют деполяризатором, полярографически активным, электроактивным. Эти названия условны, поскольку вещество может быть полярографически неактивно при одном потенциале и полярографически активно при более высоком потенциале.
Вместо потенциала выделения на практике определяют потенциал полуволны Е1/2, соответствующий половине величины диффузионного тока (рис. 2.).
Полученную полярографическую кривую называют, как отмечалось выше, полярограммой, или полярографической волной. При использовании капающего ртутного электрода на полярограмме наблюдаются осцилляции тока (его периодическое небольшое увеличение и уменьшение). Каждая такая осцилляция соответствует возникновению, росту и отрыву ртутной капли от капилляра микрокатода.
В некоторых современных полярографах электрический ток измеряется только в конце каплеобразования, что позволяет устранить осцилляции на полярограмме.
На ртутном капающем микрокатоде происходит постоянное возобновление ртутных капель, на поверхности которых осуществляется разряд катионов. Поверхность такого электрода все время обновляется за счет новых ртутных капель, что исключает изменение его свойств вследствие проткающих на нем электрохимических процессов и составляет одно из главных достоинств использования ртутного капающего электрода.
Таким образом, при проведении качественного и количественного полярографического анализа используют два параметра, получаемые при рассмотрении полярограмм: потенциал полуволны Е1/2 и величину диффузионного тока iD (высоту h полярографической волны).
Как указывалось выше, потенциал полуволны Е1/2 характеризует природу восстанавливающегося катиона и не зависит от его концентрации. Для разных катионов, полярографируемых в одних и тех же условиях, он неодинаков, что и позволяет открывать различные катионы в растворе. Потенциал полуволны Е1/2 зависит, кроме природы самого восстанавливающегося вещества, от природы растворителя, фонового электролита, состава и pH анализируемого раствора, присутствия веществ-комплексообразователей, температуры. Величина потенциала полуволны открываемого или определяемого катиона должна быть меньше величины потенциала разряда ионов фонового электролита.
Рис. 3. Полярограмма раствора, содержащего катионы кадмия и свинца; i — ток, Е — приложенный потенциал относительно насыщенного каломельного электрода
В табл. 1. приведены в качестве примера значения потенциала полуволны для некоторых катионов с указанием состава фона. Из данных табл. 1. следует, что состав фона и pH раствора существенно влияют на величину потенциала полуволны.
Если в анализируемом растворе присутствуют несколько восстанавливающихся веществ, причем разность между значениями их потенциалов полуволны составляет не менее 0,2 В, то на полярограмме наблюдаются несколько волн (рис. 3.), каждая из которых отвечает тому или иному восстанавливающемуся веществу.
Таблица 1. Значения потенциала полуволны Е1/2 некоторых катионов металлов (относительно потенциала насыщенного каломельного электрода).
Кулонометрия. Вольтамперометрия. Полярография
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кулонометрия
Электролиз — химическая реакция окисления или восстановления на электроде под действием электрического тока. Для измерения количества, прошедшего через ячейку заряда, применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Если будем проводить расчеты по массе выделившегося вещества, то это будет метод электрогравиметрии.
Кулонометрический метод анализа базируется на законах электролиза Фарадея:
1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных на электроде при прохождении 96500 Кл электричества, равны их электрохимическим эквивалентам:
Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E 0 Pb = –0,126 В, Е 0 Сd = –0,402 В). Если потенциал катода сделать равным –0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе.
Кулонометрия — высокочувствительный и точный метод анализа, позволяющий определить до 10 –9 г вещества. Однако необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. 7.5.
Вольтамперометрия
Это электрохимический метод анализа, основанный на использовании вольтамперных зависимостей I = f(E), которые получают в процессе электролиза на поляризуемом электроде. Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения.
Если к системе электродов, погруженных в раствор, приложить напряжение, то по цепи будет проходить электрический ток. На электродах будут протекать электрохимические реакции окисления на аноде и восстановления на катоде. Ион может вступать в электрохимическую реакцию, только если достигается соответствующий окислительно-восстановительный потенциал. Нередко электрохимическая реакция все равно не протекает.
Причина этого в сложном механизме электрохимического процесса, который включает:
1) перенос вещества к поверхности электрода;
2) передачу электрона (данная стадия может быть обратимой и необратимой)
— реакция Fe3+ + е – = Fe2+ обратима;
— реакция MnO4 – + 8H+ + 5 е – = Mn2+ + 4H2O необратима);
3) отвод продуктов реакции
— перенос вещества от поверхности обратно в раствор;
— растворение вещества в материале электрода (в случае ртутного электрода);
— электрокристаллизация на поверхности электрода;
— выделение газа.
Скорость электрохимического процесса определяется самой медленной его стадией. Если скорость какой-либо из стадий равна нулю, процесс вообще не протекает. Графит, платина, свинец, цинк и ртуть обладают наибольшей поляризацией, а хлоридсеребряный, каломельный и медный электроды не поляризуются. Поляризация определяется рядом параметров, ее невозможно рассчитать, необходимо установить опытным путем.
Поляризация существенно влияет на ток, протекающий через электрохимическую ячейку. Рассмотрим две электродные системы, помещенные в раствор инертного фонового электролита. Система из медного рабочего электрода и неполяризованного электрода сравнения зависит от напряжения и описывается законом Ома. Такая электродная система не представляет интереса для электрохимического анализа.
Во второй электродной системе в качестве рабочего используется поляризуемый ртутный электрод. В области потенциалов от +0,2 до –2,0 В ток через электроды практически не протекает. За пределами этого диапазона ток резко увеличивается. (Катодный ток в области отрицательных потенциалов обусловлен восстановлением ионов водорода. В положительной области потенциалов анодный ток вызван растворением ртути в результате электрохимической реакции.)
В вольтамперометрии используются ячейки, состоящие из поляризуемого рабочего и неполяризуемого электрода сравнения. Требования к рабочему электроду:
- ● площадь рабочего электрода должна быть небольшой;
- ● электрод должен быть поляризован как можно в более широкой области потенциалов;
- ● желательно, чтобы поверхность электрода постоянно обновлялась.
Если первое требование легко выполняется за счет конструкции электрода, то второе целиком зависит от материала. Электроды из благородных металлов (платины, золота) и графита поляризованы в области потенциалов от +1,3 до –1,0 В. Катодный ток связан с восстановлением ионов водорода, а анодный — с выделением кислорода. Эти электроды имеют преимущество в анодной области потенциалов. В катодной области их использование ограничено.
Анализ проводится следующим образом. На электролитическую ячейку подают плавно возрастающее напряжение от внешнего источника и регистрируют протекающий в ней ток. Если в растворе отсутствуют электрохимически активные ионы, то получается зависимость I = f(Е).
Если в растворе присутствует электрохимически активные ионы, то наблюдается волна. Если потенциал рабочего электрода меньше потенциала выделения электрохимически активного компонента, то электрохимическая реакция на нем не протекает. Незначительный ток, протекающий через ячейку, связан с образованием на поверхности электрода двойного электрического слоя (ДЭС), который можно уподобить конденсатору. Чем больше ток ДЭС, тем ниже чувствительность метода.
Когда потенциал электрода достигает величины, равной потенциалу выделения электрохимически активного компонента, происходит деполяризация рабочего электрода. Ионы начинают разряжаться на рабочем электроде с образованием амальгам на ртутном электроде:
Через электрод протекает ток электролиза (фарадеев ток), который пропорционален напряжению. Концентрация ионов в приэлектродном слое уменьшается. Происходит перенос вещества из объема раствора к поверхности электрода. При этом ток достаточно мал (порядка 10 –5 А) и не влияет на концентрацию ионов в глубине раствора. Перенос вещества протекает исключительно за счет диффузии. На электроде разряжаются все поступающие из глубины раствора ионы. Протекающий через электрод ток зависит только от скорости диффузии, которая зависит не от напряжения электрода, а от концентрации раствора, коэффициента диффузии, формы и размера электрода.
Полярография.
В 1922 г. чешским ученым Я. Гейровским был разработан полярографический метод анализа. Он использовал ртутный капающий электрод. Вольтамперометрия, использующая ртутный капающий электрод, стала называться полярографией. За открытие и развитие полярографического метода анализа в 1959 г. Я. Гейровскому была присуждена Нобелевская премия. Зависимость между приложенным напряжением и силой тока в любой точке волны описывается уравнением Гейровского — Ильковича:
Потенциал полуволны не зависит от величины диффузионного тока и является качественной характеристикой иона. Если в растворе присутствует несколько ионов, потенциалы полуволн которых различаются более чем на 100 мВ, то на полярограмме наблюдается несколько волн. Величина потенциала полуволны обычно отличается от нормального окислительно-восстановительного потенциала вследствие:
● кинетической поляризации электрода;
● влияния адсорбционных явлений;
● влияния реакций комплексообразования и осаждения.
Величины полуволн различных ионов в различных фоновых растворах при использовании различных электродов приведены в справочной литературе. Таким образом можно провести качественный анализ состава раствора по величине Е 12 . Количественной характеристикой полярограммы является величина предельного диффузионного тока, которая зависит не только от концентрации иона, но и от конструкции рабочего электрода. Для ртутного капающего электрода величина диффузионного тока связана с концентрацией уравнением Ильковича:
Большинство параметров уравнения зависят от свойств рабочего электрода и в процессе работы не изменяются. Поэтому их объединяют в константу k. В этом случае уравнение преобразуется к виду I = kс. Среди величин, включаемых в k, труднее всего экспериментально определить коэффициент диффузии. Поэтому коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов.
На твердотельных электродах наблюдаются максимумы, возникающие из-за высокой скорости наложения потенциала. Они подавляются подбором оптимальных условий записи полярограмм. Максимумы, связанные с осаждением вещества на электроде, не устраняются. Твердые электроды после записи каждой волны необходимо чистить.
Полярография применима не только для определения катионов, но и для органических веществ, способных восстанавливаться, например альдегидов, кетонов, перекисей, молекул с группами C=N–, –NO 2 , –NHOH, –S–S–. Это высокочувствительный и быстрый метод определения неорганических и органических веществ, один из универсальных методов определения следовых количеств веществ, позволяющий одновременно определять несколько компонентов в смеси. На рис. 7.5 приведен внешний вид одного из наиболее часто используемых полярографов.
Рис. 7.5. Полярограф АВС 1.1
По разнообразию решаемых задач вольтамперометрические методы являются наиболее универсальными среди методов электрохимического анализа. Они позволяют одновременно получать качественную и количественную информацию о находящихся в растворе электроактивных веществах, т. е. способных вступать в химические реакции под действием электрического тока.
Подбором соответствующих условий (растворителя, материала электродов, реагентов) самые различные вещества могут быть переведены в электроактивное состояние. Поэтому на сегодняшний день разработаны способы вольтамперометрического определения большинства элементов и весьма широкого круга неорганических и органических соединений в диапазоне концентраций от 10 –3 до 10 –11 мольл.
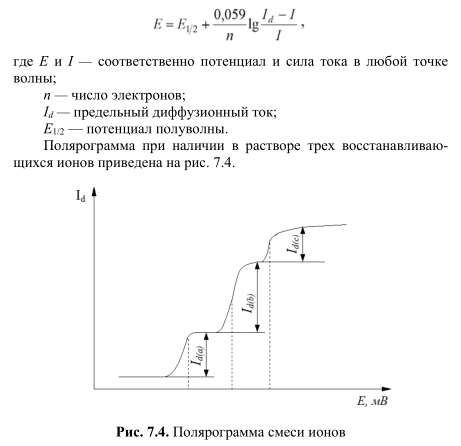
Инверсионная вольтамперометрия позволяет существенно увеличить чувствительность метода. Метод инверсионной полярографии заключается в выделении определяемого элемента из очень разбавленного раствора на ртутной капле, тонкой пленке ртути на графитовом электроде или просто на графитовом электроде электролизом с последующим анодным растворением полученного продукта. Процесс накопления определяемого компонента проходит при потенциале φ (рис. 7.6), соответствующем предельному току I /L.
Рис. 7.6. Принцип электрохомического инверсионного определения 1 — стадия накопления; 2 — стадия растворения
Зависимость силы тока I от потенциала φ при анодном растворении имеет максимум пика Ip , высота которого пропорциональна концентрации определяемого иона, а потенциал максимума φр определяется природой иона. Чем больше продолжительность накопительного электролиза, тем большее количество ионов металла переходит из раствора на электрод и тем больше возрастает чувствительность метода.
В настоящее время инверсионная вольтамперометрия является одним из важнейших методов определения следовых содержаний органических и неорганических соединений в растворах, а также анализа твердых материалов. Ее достоинства по сравнению с другими методами:
- ● возможность определения значительного числа (более 40) химических элементов и многих органических веществ;
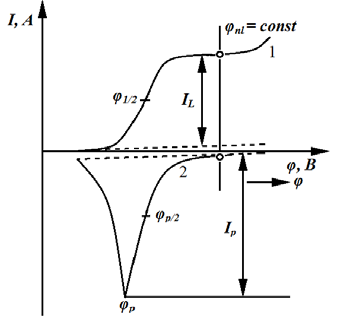
- ● возможность одновременного определения нескольких ионов металлов (рис. 7.7);
- ● низкие пределы обнаружения, достигающие для некоторых элементов (например, Cd, Bi, Tl, Pb, Sb) и органических веществ (10 –9 –10 –10 мольл);
- ● достаточно высокая селективность и хорошие метрологические характеристики;
- ● легкость компьютеризации и автоматизации аналитических определений;
- ● сравнительно невысокая стоимость приборов для инверсионной вольтамперометрии и относительная простота работы на них.
Амперометрическое титрование (потециостатическое поляризационное титрование) — это разновидность вольтамперометрического метода (наряду с полярографией). Метод основан на измерении величины тока между электродами электрохимической ячейки, к которым приложено некоторое постоянное напряжение, как функции прибавленного титранта. Определяемое вещество должно быть электрохимически активным.
При прибавлении титранта в анализируемый раствор концентрация этого вещества уменьшается или увеличивается, соответственно падает или возрастает диффузионный ток. Точку эквивалентности фиксируют по резкому изменению падения или роста диффузионного тока, что отвечает окончанию реакции титруемого вещества с титрантом. Вид кривой титрования зависит от того, какое вещество вступает в электрохимическую реакцию (рис. 7.8).
Рис. 7.7. Одновременное определение нескольких ионов металлов методом инверсионной вольтамперометрии
Рис. 7.8. Кривые амперометрического титрования а — активно титруемое вещество; б — активен титрант; в — активны титруемое вещество и титрант; г — активен продукт реакции
При амперометрическом титровании используются реакции осаждения, комплексообразования и окислительно-восстановительные. Если ни титрант, ни продукт реакции, ни определяемое вещество не являются электрохимически активными, то используют амперометрический индикатор. Это вещества, которые восстанавливаются или окисляются на электроде и взаимодействуют с титрантом после того, как определяемое вещество количественно вступит в реакцию. Поэтому диффузионный ток при титровании определяемого вещества постоянен, а после точки эквавалентности уменьшается.
- — высокой чувствительностью (до 10 –6 моль/л);
- — большой точностью (до ±0,1 %);
- — селективностью;
- — возможностью проводить титрование мутных и окрашенных растворов.
ПОЛЯРОГРАФИЯ: ТЕОРИЯ, ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
Описание: В настоящее время, когда фармацевтическая промышленность, химическая промышленность и химия как наука в нашей стране развиваются небывало быстрыми темпами, особое значение приобретает усовершенствование старых и разработка новых, более совершенных методов анализа, отличающихся высокой чувствительностью, точностью и быстротой получения результатов.
Дата добавления: 2015-10-24
Размер файла: 111.43 KB
Работу скачали: 51 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
Федеральное государственное автономное образовательное учреждение высшего профессионального образования
«БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ (НИУ «БелГУ»)
Кафедра фармацевтической химии и фармакогнозии
по фармацевтической химии
ПОЛЯРОГРАФИЯ: ТЕОРИЯ, ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
студентка 4 курса
Удовидченко Виктория Геннадьевна
1. ПОЛЯРОГРАФИЯ: ТЕОРИЯ АНАЛИЗА
1.1. Методы фармацевтического анализа и их классификация
1.2. Полярографический метод анализа
2. ПРИМЕНИНИЕ ПОЛЯРОГРАФИИ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
2.1. Условия проведения полярографического анализа
2.2. Применение метода полярографического анализа
Фармацевтический анализ это наука о химической характеристике и измерении биологически активных веществ на всех этапах производства: от контроля сырья до оценки качества полученного лекарственного вещества, изучения его стабильности, установления сроков годности и стандартизации готовой лекарственной формы. Фармацевтический анализ имеет свои специфические особенности, отличающие его от других видов анализа. Эти особенности заключаются в том, что анализу подвергают вещества различной химической природы: неорганические, элементорганические, радиоактивные, органические соединения от простых алифатических до сложных природных биологически активных веществ. Чрезвычайно широк диапазон концентраций анализируемых веществ. Объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов.
В настоящее время, когда фармацевтическая промышленность, химическая промышленность и химия как наука в нашей стране развиваются небывало быстрыми темпами, особое значение приобретает усовершенствование старых и разработка новых, более совершенных методов анализа, отличающихся высокой чувствительностью, точностью и быстротой получения результатов.
Методики, используемые в фармацевтическом анализе, должны быть чувствительными, специфическими, избирательными, быстрыми и пригодными для экспресс-анализа в условиях аптеки.
Одним из электрохимических методов анализа, широко применяемых в научно-исследовательских работах по химии и фармации, а также для контроля производства, является полярографический метод.
Полярография — физико-химический метод анализа, основанный на получении вольтамперных кривых. Получение вольтамперных кривых производят при помощи полярографов, простых, с визуальным отсчетом величины тока и напряжения и более сложных, с автоматической регистрацией поляризационных кривых. Полярографический метод анализа обладает большой чувствительностью и дает возможность определять вещества при очень незначительной (до 0,0001%) концентрации их в растворе. Для выполнения анализа достаточно 3-5 мл раствора; количество раствора можно уменьшить до 0,1-0,5 мл. Проведение анализа на авторегистрирующих полярографах занимает около 10 мин.
В курсовой работе будут изложены общие сведения о полярографии, история, основные принципы; общие сведенья о качественных и количественных определениях в полярографии.
Целью данной курсовой работы является: Полярография: теория, применение в фармацевтическом анализе.
Задачей данной курсовой работы является:
1) Изучение литературы, научных статей и медицинских журналов по теории полярографии.
2) Изучение литературы, по применению полярографии в фармацевтическом анализе.
1. ПОЛЯРОГРАФИЯ: ТЕОРИЯ АНАЛИЗА
1.1. Методы фармацевтического анализа и их классификация
В фармацевтическом анализе используются разнообразные методы исследования: физические, физико-химические, химические, биологические. Применение физических и физико-химических методов требует соответствующих приборов и инструментов, поэтому данные методы называют также приборными, или инструментальными.
Использование физических методов основано на измерении физических констант, например, прозрачности или степени мутности, цветности, влажности, температуры плавления, затвердевания и кипения.
С помощью физико-химических методов измеряют физические константы анализируемой системы, которые изменяются в результате химических реакций. К этой группе методов относятся оптические, электрохимические, хроматографические.
Химические методы анализа основаны на выполнении химических реакций.
Биологический контроль лекарственных веществ осуществляют на животных, отдельных изолированных органах, группах клеток, на определенных штаммах микроорганизмов. Устанавливают силу фармакологического эффекта или токсичность.
Методики, используемые в фармацевтическом анализе, должны быть чувствительными, специфическими, избирательными, быстрыми и пригодными для экспресс-анализа в условиях аптеки.
1.2. Полярографический метод анализа
Полярографический метод анализа впервые был предложен чешским ученым Я.Гейровским в 1922 году, когда он изучал влияние напряжения, приложенного к ртутной капле, погруженной в водный раствор, на величину поверхностного натяжения, (так называемый «электрокапиллярный эффект»). Он заметил, что величина тока через каплю зависит от состава раствора. Доработав эту идею, он создал метод, который основан на измерении зависимости тока от напряжения на ртутно-капельном электроде. Получающиеся зависимости, так называемые вольтамперные кривые или вольтамперограммы, зависят от состава раствора и позволяют проводить одновременно качественный и количественный анализ содержащихся в растворе микропримесей. В 1959 году за метод полярографии Я.Гейровскому была присуждена Нобелевская премия по химии.
Полярографический метод дает возможность определять примеси металлов, содержащиеся в технических образцах в количестве порядка 0,001%, с точностью в среднем до 1%.
Отличительными особенностями полярографического метода анализа являются:
1. Быстрота аналитического определения, не превышающая нескольких минут.
2. Большая чувствительность, позволяющая вести аналитические определения очень малых количеств исследуемого вещества.
3. Независимость результатов определений от индивидуальных особенностей экспериментатора, так как о них судят по объективным показаниям чувствительного гальванометра.
4. Возможность одновременно вести определение нескольких элементов, не прибегая к предварительному их разделению.
По разновидностям аналитического сигнала, электрохимические методы анализа, подразделяют на:
1) кондуктометрию — измерение электропроводности исследуемого раствора;
2) потенциометрию — измерение бестокового равновесного потенциала индикаторного электрода, для которого исследуемое вещество является потенциоопределяющим;
3) кулонометрию — измерение количества электричества, необходимого для полного превращения (окисления или восстановления) исследуемого вещества;
3) вольтамперометрию — измерение стационарных или нестационарных поляризационных характеристик электродов в реакциях с участием исследуемого вещества;
5) электрогравиметрию — измерение массы вещества, выделенного из раствора при электролизе.
Электрохимические методы анализа можно подразделить по признаку применения электролиза. На принципах электролиза базируются кулонометрия, вольтамперометрия и электрогравиметрия; электролиз не используют в кондуктометрии и потенциометрии.
Вольтамперометрию, связанную с использованием ртутного капающего электрода (РКЭ) называют полярографией.
Вольтамперометрия основана на изучении поляризационных или вольтамперных кривых (кривых зависимости силы тока I от напряжения Е), которые получают в процессе электролиза раствора анализируемого вещества при постепенном повышении напряжения с одновременной фиксацией при этом силы тока. Электролиз проводят с использованием легкополяризуемого электрода с небольшой поверхностью, на котором происходит электровосстановление или электроокисление вещества.
Характерной особенностью полярографического метода является применение электродов с разной площадью поверхности. Поверхность одного из электродов, называемого микроэлектродом, должна быть во много раз меньше поверхности другого электрода. В качестве микроэлектрода чаще всего применяют РКЭ, представляющий собой капилляр, из которого равномерно с определенной скоростью вытекают капли металлической ртути. Скорость прокапывания определяется высотой подвески емкости с ртутью, соединенной шлангом с капилляром. Второй электрод, поверхность которого во много раз больше поверхности микроэлектрода, служит электродом сравнения. В качестве него используют ртуть, налитую на дно электролитической ячейки, или насыщенный каломельный электрод. На эти электроды от внешнего источника напряжения подают плавно изменяющееся напряжение. Плотность тока (А/см2) на электроде сравнения, имеющего большую поверхность, ничтожно мала, поэтому потенциал его практически не изменяется, т.е. этот электрод не поляризуется. Плотность тока на РКЭ вследствие его малой поверхности высока. РКЭ изменяет свой равновесный потенциал, т.е. поляризуется. Реализацию метода осуществляют на приборах, называемых полярографами. Принципиальная схема полярографа приведена на (рис. 1). Ток от аккумулятора поступает на реостат, при помощи которого через очень чувствительный гальванометр подается плавно повышающееся напряжение на электролитическую ячейку, содержащую ртутный (или каломельный) электрод, РКЭ и анализируемый раствор.
Рис. 1. Схема полярографической установки
1 — электролизёр; 2 — сосуд с ртутью; 3 — гальванометр; 4 — передвижной контакт; 5 — реохорд; 6 — аккумулятор.
Фиксируя силу тока, проходящего через ячейку, в зависимости от поданного напряжения, получают вольтамперные кривые, называемые в полярографии полярограммами (рис. 2). Форма полярограмм напоминает волну. Первый участок волны (АБ) соответствует начальному моменту процесса, когда протекает только остаточный (конденсаторный или емкостной) ток, связанный с расходом некоторого количества электричества на заряжение двойного электрического слоя на поверхности капли ртути и восстановлением следовых количеств электроактивных примесей.
Рис. 2. Типичный вид полярограмм определяемого элемента при концентрациях
Если в растворе присутствуют ионы, способные восстанавливаться на РКЭ (катоде), то при достижении определенного значения внешнего напряжения, обеспечивающего потенциал, равный потенциалу восстановления данных ионов, на полярограмме наблюдается резкое увеличение тока. Потенциал, соответствующий точке Б на полягрограмме, называют потенциалом выделения. Восстановление иона металла на РКЭ сопровождается растворением восстановившегося металла в ртути, образованием амальгаммы:
Mez+ + ze — + Hg Me(Hg).
С этого момента рост потенциала электрода как бы отстает от роста
налагаемого внешнего напряжения — электрод деполяризуется. Вещество, участвующее в электрохимической реакции и вызывающее деполяризацию электрода, называется деполяризатором. Ток, обусловленный электрохимической реакцией на электроде, называют фарадеевским, подчеркивая его связь с процессом электролиза. Подвод ионов деполяризатора к электроду осуществляется путем диффузии в приэлектродный слой раствора, концентрация в котором СЭ меньше концентрации в глубине С. Скорость диффузии, и тем самым сила тока, определяется разностью (градиентом) концентраций С — СЭ, поэтому ток называют диффузионным током.
Дальнейшее увеличение напряжения вызывает уменьшение СЭ и усиление диффузии, следовательно, также и увеличение тока (участок БВ). Так продолжается до тех пор, пока СЭ не становится практически равной нулю. Это означает, что все ионы деполяризатора, которые подходят к электроду, сразу разряжаются. Дальнейшее увеличение напряжения не вызывает роста тока — достигается предельный диффузионный ток. Он зависит от концентрации деполяризатора в растворе
На коэффициент пропорциональности К оказывают влияние многие факторы. Д. Ильковичем было получено уравнение, в котором отражено влияние некоторых из них:
где z — число электронов, участвующих в электродной реакции;
D — коэффициент диффузии ионов деполяризатра;
m — масса ртути (мг), вытекающей из капилляра за одну секунду;
t — промежуток времени между двумя каплями, с.
Для обратимого восстановления деполяризатора Гейровским-Ильковичем было выведено уравнение полярографической волны
Когда сила тока равна половине предельного диффузионного тока
(I = 1/2 IД), получают Е = Е1/2. Следовательно, половине высоты волны всегда соответствует одно и то же напряжение, независимо от концентрации деполяризатора. Оно называется потенциалом полуволны.
Качественный анализ проводят по потенциалам полуволн деполяризаторов. При этом необходимо иметь в виду, что на значение этой величины оказывают влияние фоновый электролит, рН раствора, присутствие комплексообразующих агентов. Определив в процессе полярографирования потенциалы полуволн ионов, находящихся в растворе, и сравнив их величины с табличными данными, можно установить, какие именно ионы находятся в растворе. Уравнение обратимой полярографической волны дает удобный графический способ нахождения важной качественной характеристики полярограммы — потенциала полуволны Е1/2. Построенная в координатах “ lgХ — [I/(Iд — I)] — Е” полярограмма будет выглядеть в виде прямой, точка пересечения которой с осью абсцисс — соответствует потенциалу, когда ток равен ½Iд (рис. 3).
Рис. 3. Графический способ определения потенциала полуволны Е 1/2 по уравнению полярографической волны.
По этому же графику можно определить число электронов z , участвующих в электрохимической реакции. Сделать это можно, найдя котангенс (мВ) и сравнив его с теоретическим значением. Из уравнения полярографической волны следует, что теоретические величины равны соответственно: 59,16 мВ для n = 1; 29,58 мВ для n = 2; 19,7 мВ для n = 3.
Если же число электронов, участвующих в электрохимической реакции известно, то по этому критерию можно установить, обратимо ли протекает данная реакция на электроде. При совпадении экспериментальной величины наклона с теоретической можно полагать, что электрохимическая реакция протекает обратимо.
Для количественных определений уравнение Ильковича, как правило, не используют, поскольку определение численных значений всех его параметров — слишком трудоемкая работа. На практике чаще всего для целей количественного анализа пользуются высотой полярографической волны h, выраженной в мм. В количественном полярографическом анализе могут быть использованы все приемы определения концентрации: сравнение с эталоном, метод стандартных серий, метод добавок.
Рис. 4. Полярограмма раствора, содержащего цинк, никель и кадмий.
Если в растворе присутствуют несколько деполяризаторов с достаточно большой разностью потенциалов полуволн (не менее 0,2. 0,3 В), например, кадмий, никель, цинк, полярографическая волна каждого элемента возникнет последовательно друг за другом и высота волны каждого элемента не зависит от присутствия других элементов (рис. 4). Концентрация определяемого деполяризатора может быть в пределах 10-2. 10 — 6 моль/л. Различные виды полярографии позволяют работать еще при более низких концентрациях деполяризаторов. При правильном выборе среды (фоновый электролит, рН, комплексообразующие агенты) с РКЭ можно определять ионы почти всех металлов, даже щелочно-земельных и щелочных. В вольтамперометрии с успехом применяют также твердые микроэлектроды, изготовленные из благородных металлов (Pt, Au и т.д.) или графита. Основным достоинством твердых электродов является возможность работы в более положительной области потенциалов (до 1,3 В), чем с РКЭ (от 0,3. -2,0 В) и их нетоксичность. Однако стационарные твердые электроды не нашли широкого применения из-за медленности установления предельного тока, невысокой чувствительности и других недостатков. Большее применение имеют вращающиеся и вибрирующие платиновые микроэлектроды, у которых предельный ток устанавливается быстро за счет непрерывного перемешивания раствора. Благодаря этому ионы к поверхности электрода доставляются не только за счет диффузии, но и перемешивания. Это в 10. 20 раз увеличивает предельный ток по сравнению с диффузионным. Практическому применению твердых электродов в качестве катодов мешает восстановление водорода, которое на твердых электродах происходит при значительно меньших потенциалах, чем на РКЭ. Например, из кислых растворов на платине водород выделяется при — 0,1 В, а на РКЭ при — 2,0 В.
Капающий ртутный анод пригоден для определения некоторых анионов, например,
2 Hg + 2 Br — Hg 2 Br 2 + 2 e —
Hg + 4 CN — [ Hg ( CN ) 4] 2 — + 2 e —
Органические вещества восстанавливаются и окисляются на РКЭ, как правило, необратимо, часто ступенчато. Несмотря на это, разработаны методы определения многих органических веществ — галогенопроизводных альдегидов, кетонов, тиолов, нитрилов, хинонов, нитро- и азосоединений.
Основное условие правильного проведения полярографического анализа — подавление миграционного и конвективного токов. Эти токи возникают вследствие того, что кроме диффузии доставка деполяризатора к РКЭ может осуществляться миграцией, обусловленной действием электрического поля, и конвекцией при механическом перемешивании раствора или вследствие различий в плотности внутри раствора, вызванных перепадами концентрации или температуры. Поэтому в общем случае предельный ток складывается из диффузионного, миграционного и конвекционного токов. Но миграционный и конвекционный токи, в отличие от диффузионного, не связаны с концентрацией деполяризатора. Миграция и конвекция мешают диффузии ионов к РКЭ, следовательно, мешают полярографированию. Поэтому чтобы получить простую функциональную зависимость тока от концентрации, миграционную и конвекционную составляющую тока устраняют, для этого в раствор добавляют приблизительно стократный избыток посторонних индиферентных (т.е. электрохимически неактивных) ионов сильного электролита, называемого фоном. В присутствии избытка ионов фона электрод будет экранизирован этими ионами, и доля миграционного тока будет ничтожно мала. Если в процессе регистрации полярограммы раствор не перемешивать и поддерживать постоянной его температуру, то практически исчезнет механическая и тепловая конвекция. В качестве фона применяют различные соли, кислоты, основания или буферные смеси, ионы которых имеют более отрицательные потенциалы выделения, чем определяемые ионы. Особенно часто применяют растворы солей щелочных и щелочно-земельных металлов (KСI, КСNS, NH4Cl, Na2SO4 и т.д.). Иногда в качестве фона применяют комплексообразующие реагенты (NH4ОН, цитраты, тартраты и т.д.), которые не только подавляют миграционный ток, но и изменяют потенциалы полуволны анализируемых ионов, позволяя определять ионы с близкими значениями Е1/2.
Изобретенный Гейровским анализ на ртутной капле можно считать теперь классическим. Но применять такой электрод не всегда удобно. На ртути можно восстановить многие металлы, но не все. Например, для растворов солей металлов с высокоположительным потенциалом (например, платина) ртутный электрод непригоден, так как потенциал ртути отрицательнее потенциала платины. Нельзя применять его и при анализе расплавленных при высокой температуре электролитов. Более удобными в таких условиях оказываются электроды из благородных металлов (платина, золото). А чтобы избавиться от неудобств твердого неподвижного электрода, был изобретен вращающийся дисковый электрод, теория которого была разработана, в основном, советским ученым В. Г. Левичем.[4]
2. ПРИМЕНЕНИЕ ПОЛЯРОГРАФИИ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
2.1. Условия проведения полярографического анализа
При проведении полярографического анализа требуется соблюдение, следующих условий:
1) Для поддержания необходимой электропроводности анализируемого раствора в него вводят фоновый электролит, например, хлорид или нитрат калия, хлорид аммония, соли тетраалкиламмония и др. Ионы фонового электролита должны разряжаться на ртутном капающем микроэлектроде при более высоких значениях приложенного потенциала, чем полярографируемое вещество. Концентрация фонового электролита должна быть выше концентрации полярографически активного вещества в оптимальном случае не менее чем в 100 раз. При этом концентрация самого полярографически активного вещества обычно лежит в пределах от
2) Перед проведением полярографического анализа из анализируемого раствора должен быть удален растворенный в нем кислород. Это достигается чаще всего путем пропускания тока инертного газа (например. азота) через раствор в течение
15 минут перед началом полярографирования.
3) Иногда на полярограмме появляются максимумы, соответствующие протеканию электрического тока, превышающего предельный ток. Появление максимумов обусловлено движением поверхности капли жидкой ртути при каплеобразовании, что приводит к перемешиванию диффузного слоя растворана поверхности капли, к увеличению числа диффундирующих частиц полярографически активных веществ и к их разряду на микроэлектроде, следствием чего и является увеличение электрического тока, протекающего через полярографическую ячейку.
Для подавления максимумов тока в раствор вводят добавки желатина или других поверхностно-активных веществ (агар-агар, метиловый красный, фуксин и т.д.). которые изменяют поверхностное натяжение ртутной капли и препятствуют движению поверхностных слоев ртутной капли.
4) Необходимо термостатировать полярографическую ячейку, поддерживая температуру постоянной с точностью ±0,5 оС.
2.2. Применение метода полярографического анализа
Лекарственные средства (ЛС) представляют собой сложные химические вещества как неорганической, так и органической природы, и для контроля их качества используют весь комплекс аналитических методов анализа .
Сборником обязательных общегосударственных стандартов и положений, нормирующих качество лекарственных средств, является Государственная Фармакопея (ГФ) . Последнее издание Государственной Фармакопеи (ГФ XII, вып.1, 2007г.) включает не только классические химические методы определения подлинности препаратов, чистоты и их количественного содержания (гравиметрия, титриметрия), но в ней также широко представлены современные инструментальные методы анализа.
Аналитический контроль лекарственных средств или определенных ингредиентов в препарате необходим, чтобы гарантировать их безопасность и эффективность на протяжении всего срока годности, включая хранение, распределение и использование.
Полярография используется для определения малых количеств неорганических и органических веществ. Разработаны тысячи методик количественного полярографического анализа. Предложены способы полярографического определения практически всех катионов металлов, ряда анионов (бромат-, иодат-, нитрат-, перманганат-ионов), органических соединений различных классов, содержащих диазогруппы. Карбонильные, пероксидные, эпоксидные группы, двойные углерод-углеродные связи, а также связи углерод-галоген, азот-кислород, сера-сера. Полярографию широко используют в анализе алкалоидов, витаминов, гормонов, антибиотиков, сердечных гликозидов.
Метод — фармакопейный, применяется для определения салициловой кислоты, норсульфазола, витамина В1, алкалоидов, фолиевой кислоты, келлина в порошке и в таблетках, никотинамида, пиридоксина гидрохлорида, препаратов мышьяка, гликозидов сердечного действия, а также кислорода и различных примесей в фармацевтических препаратах.
Метод обладает высокой чувствительностью (до 10-5 — 10-6 моль/л); селективностью; сравнительно хорошей воспроизводимостью результатов (до
2 %); широким диапазоном применения; позволяет анализировать смеси веществ без их разделения, окрашенные растворы, небольшие объемы растворов (объем полярографической ячейки может составлять всего 1 мл); вести анализ в потоке раствора; автоматизировать проведение анализа.
К недостаткам метода относятся токсичность ртути, ее довольно легкая окисляемость в присутствии веществ-окислителей, относительная сложность используемой аппаратуры.
Электpохимические методы анализа (ЭМА) основаны на процессах, пpотекающих на электpодах или межэлектpодном пpостpанстве. ЭМА являются одними из стаpейших ФХМА (некотоpые описаны в конце 19 века). Их достоинством является высокая точность и сpавнительная пpостота как обоpудования, так и методик анализа. Высокая точность опpеделяется весьма точными закономеpностями используемыми в ЭМА, напpимеp закон Фаpадея. Большим удобством является то, что в ЭМА используют электpические воздействия, и то, что pезультат этого воздействия (отклик) тоже получается в виде электрического сигнала. Это обеспечивает высокую скоpость и точность отсчета, откpывает шиpокие возможности для автоматизации. ЭМА отличаются хорошей чувствительностью и селективностью, в pяде случаев их можно отнести к микpоанализу, так как для анализа иногда достаточно менее 1 мл pаствоpа.
Полярография один из важнейших электрохимических методов анализа веществ, исследования кинетики химических процессов.
Полярография широко используется в металлургии , геологии , органической химии , медицине , электрохимии для определения ряда ионов ( кадмий , цинк , свинец и др.), органических веществ (аминокислот, витаминов), их концентрации, для изучения механизма электродных и фотохимических реакций, протекающих в фотоэлектрохимических ячейках.
Широкое применение полярография нашла в фармацевтической промышленности.
1. Васильев, В.П. Аналитическая химия. В 2 кн. Кн. 2: Физико-химические методы анализа. Учебник для студ.вузов, обучающихся на химико-технол.спец. Издательство «Дрофа», 2002 С. 211-230
2. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн. 2: Количественный анализ. Физико-химические (инструментальные) методы анализа. Издательство «Высшая школа», 2001. С. 466-481
3. Крешков, А.П. Основы аналитической химии, ч.2.
Издательство «Химия», Москва, 1976 С. 412, 443
4. Полярография лекарственных препаратов. М и с к —
Мискиджьян С. П., Кравченюк Л. П Издательское объединение «Вища школа», 1976, 232 с
5. Хенце Г. Полярография и вольтамперометрия. Теоретические основы и аналитическая практика./ Г. Хенце; пер. с нем. А. В. Гармаша и А. И. Каменева. — М.: Бином. Лаборатория знаний, — 2008. -284 с
7. Полярография Медицинская энциклопедия.- Электрон. дан. — URL: http://www.medical-enc.ru/15/polarography.shtml
8 . Полярогафия URL: http://www.chemport.ru/polarography.shtml
Список использованных источников литературы
http://farmf.ru/lekcii/kulonometriya-voltamperometriya-polyarografiya/
http://refleader.ru/polatyotrotrmer.html