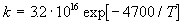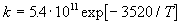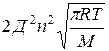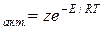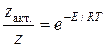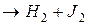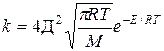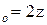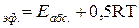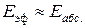Уравнение тас для константы скорости реакции
Основная задача теорий химической кинетики — предложить способ расчета константы скорости элементарной реакции и ее зависимости от температуры, используя различные представления о строении реагентов и пути реакции. Мы рассмотрим две простейшие теории кинетики — теорию активных столкновений (ТАС) и теорию активированного комплекса (ТАК).
Теория активных столкновений основана на подсчете числа столкновений между реагирующими частицами, которые представляются в виде твердых сфер. Предполагается, что столкновение приведет к реакции, если выполняются два условия: 1) поступательная энергия частиц превышает энергию активации EA; 2) частицы правильно ориентированы в пространстве относительно друг друга. Первое условие вводит в выражение для константы скорости множитель exp(-EA/RT), который равен доле активных столкновений в общем числе столкновений. Второе условие дает так называемый стерический множитель P — константу, характерную для данной реакции.
В ТАС получены два основных выражения для константы скорости бимолекулярной реакции. Для реакции между разными молекулами (A + B 
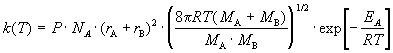
Здесь NA — постоянная Авогадро, r — радиусы молекул, M — молярные массы веществ. Множитель в больших круглых скобках — это средняя скорость относительного движения частиц A и B.
Константа скорости бимолекулярной реакции между одинаковыми молекулами (2A 
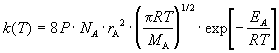
Из (9.1) и (9.2) следует, что температурная зависимость константы скорости имеет вид:
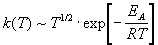
Согласно ТАС, предэкспоненциальный множитель слабо зависит от температуры. Опытная энергия активации Eоп, определяемая по уравнению (4.4), связана с аррениусовской, или истинной энергией активации EA соотношением:
Мономолекулярные реакции в рамках ТАС описывают с помощью схемы Линдемана (см. задачу 6.4), в которой константу скорости активации k1 рассчитывают по формулам (9.1) и (9.2).
В теории активированного комплекса элементарную реакцию представляют как мономолекулярный распад активированного комплекса по схеме:
Предполагается, что между реагентами и активированным комплексом существует квазиравновесие. Константу скорости мономолекулярного распада рассчитывают методами статистической термодинамики, представляя распад как одномерное поступательное движение комплекса по координате реакции.
Основное уравнение теории активированного комплекса имеет вид:
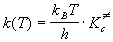
где kB = 1.38 . 10 -23 Дж/К — постоянная Больцмана, h = 6.63 . 10 -34 Дж. с — постоянная Планка, 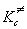
В статистическом подходе константу равновесия выражают через суммы по состояниям:
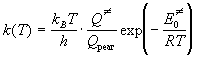
где 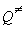
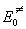
Полные суммы по состояниям обычно разлагают на сомножители, соответствующие отдельным видам движения молекул: поступательному, электронному, вращательному и колебательному:
Поступательная сумма по состояниям для частицы массой m равна:
Qпост = 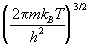
Эта поступательная сумма имеет размерность (объем) -1 , т.к. через нее выражаются концентрации веществ.
Электронная сумма по состояниям при обычных температурах, как правило, постоянна и равна вырожденности основного электронного состояния: Qэл = g0.
Вращательная сумма по состояниям для двухатомной молекулы равна:
Qвр = 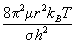
где m = m1m2 / (m1+m2) — приведенная масса молекулы, r — межъядерное расстояние, s = 1 для несимметричных молекул AB и s =2 для симметричных молекул A2. Для линейных многоатомных молекул вращательная сумма по состояниям пропорциональна T, а для нелинейных молекул — T 3/2 . При обычных температурах вращательные суммы по состояниям имеют порядок 10 1 -10 2 .
Колебательная сумма по состояниям молекулы записывается как произведение сомножителей, каждый из которых соответствует определенному колебанию:
Qкол = 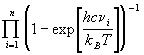
где n — число колебаний (для линейной молекулы, состоящей из N атомов, n = 3N-5, для нелинейной молекулы n = 3N-6), c = 3 . 10 10 см/с — скорость света, n i — частоты колебаний, выраженные в см -1 . При обычных температурах колебательные суммы по состояниям очень близки к 1 и заметно отличаются от нее только при условии: T > n . При очень высоких температурах колебательная сумма для каждого колебания прямо пропорциональна температуре:
Qi 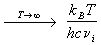
Отличие активированного комплекса от обычных молекул состоит в том, что он имеет на одну колебательную степень свободы меньше, а именно: то колебание, которое приводит к распаду комплекса, не учитывается в колебательной сумме по состояниям.
В термодинамическом подходе константу равновесия выражают через разность термодинамических функций активированного комплекса и исходных веществ. Для этого константу равновесия, выраженную через концентрации, переводят в константу, выраженную через давления. Последняя константа, как известно, связана с изменением энергии Гиббса в реакции образования активированного комплекса:
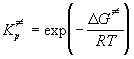
Для мономолекулярной реакции, в которой образование активированного комплекса происходит без изменения числа частиц, 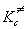
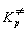
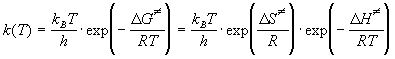
Энтропийный множитель exp (
Для бимолекулярной реакции, протекающей в газовой фазе, в эту формулу добавляется множитель RT / P0 (где P0 = 1 атм = 101.3 кПа), который нужен для перехода от 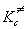
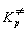
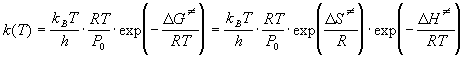
Для бимолекулярной реакции в растворе константу равновесия 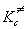
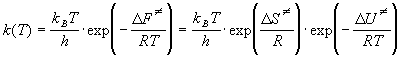
Пример 9-1. Константа скорости бимолекулярной реакции
2NO2 
при 627 К равна 1.81 . 10 3 см 3 /(моль. с). Вычислите истинную энергию активации и долю активных молекул, если диаметр молекулы NO2 можно принять равным 3.55 А, а стерический множитель для этой реакции равен 0.019.
Решение. При расчете будем опираться на теорию активных столкновений (формула (9.2)):
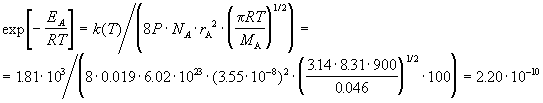
Это число представляет собой долю активных молекул.
При расчетах констант скорости с использованием различных теорий химической кинетики необходимо очень аккуратно обращаться с размерностями. Обратите внимание на то, что радиус молекулы и средняя скорость выражены через см для того, чтобы получить константу в см 3 /(моль. с). Коэффициент 100 служит для перевода м/с в см/с.
Истинную энергию активации легко вычислить через долю активных молекул:
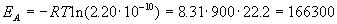
Пример 9-2. Используя теорию активированного комплекса, определите температурную зависимость константы скорости тримолекулярной реакции 2NO + Cl2 = 2NOCl при температурах, близких к комнатной. Найдите связь между опытной и истинной энергиями активации.
Решение. Согласно статистическому вариант ТАК, константа скорости равна (формула (9.4)):
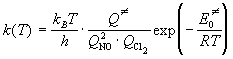
В суммах по состояниям активированного комплекса и реагентов мы не будем учитывать колебательные и электронные степени свободы, т.к. при низких температурах колебательные суммы по состояниям близки к единице, а электронные — постоянны.
Температурные зависимости сумм по состояниям с учетом поступательного и вращательного движений имеют вид:
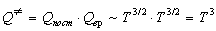
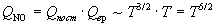
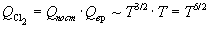
Активированный комплекс (NO)2Cl2 — нелинейная молекула, поэтому его вращательная сумма по состояниям пропорциональна T 3/2 .
Подставляя эти зависимости в выражение для константы скорости, находим:
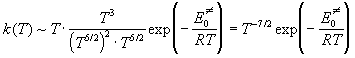
Мы видим, что тримолекулярные реакции характеризуются довольно необычной зависимостью константы скорости от температуры. При определенных условиях константа скорости может даже убывать с ростом температуры за счет предэкспоненциального множителя!
Опытная энергия активации этой реакции равна:
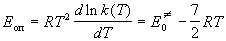
Пример 9-3. Используя статистический вариант теории активированного комплекса, получите выражение для константы скорости мономолекулярной реакции.
Решение. Для мономолекулярной реакции
A 

константа скорости, согласно (9.4), имеет вид:
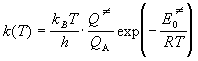
Активированный комплекс в мономолекулярной реакции представляет собой возбужденную молекулу реагента. Поступательные суммы реагента A и комплекса AN одинаковы (масса одинакова). Если предположить, что реакция происходит без электронного возбуждения, то и электронные суммы по состояниям одинаковы. Если предположить, что при возбуждении строение молекулы реагента изменяется не очень сильно, то вращательные и колебательные суммы по состояниям реагента и комплекса почти одинаковы за одним исключением: активированный комплекс имеет на одно колебание меньше, чем реагент. Следовательно, колебание, приводящее к разрыву связи, учитывается в сумме по состояниям реагента и не учитывается в сумме по состояниям активированного комплекса.
Проводя сокращение одинаковых сумм по состояниям, находим константу скорости мономолекулярной реакции:
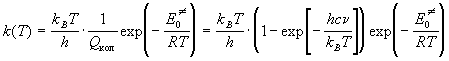
где n — частота колебания, которое приводит к реакции. Скорость света c — это множитель, который используют, если частота колебания выражена в см -1 . При низких температурах колебательная сумма по состояниям равна 1:
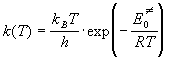
При высоких температурах экспоненту в колебательной сумме по состояниям можно разложить в ряд: exp(-x)
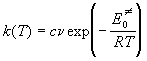
Этот случай соответствует ситуации, когда при высоких температурах каждое колебание приводит к реакции.
Пример 9-4. Определите температурную зависимость константы скорости для реакции молекулярного водорода с атомарным кислородом:
H2 + O . 
при низких и высоких температурах.
Решение. По теории активированного комплекса константа скорости для этой реакции имеет вид:
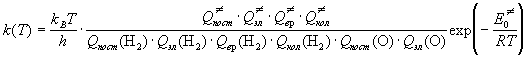
Будем считать, что электронные множители от температуры не зависят. Все поступательные суммы по состояниям пропорциональны T 3/2 , вращательные суммы по состояниям для линейных молекул пропорциональны T, колебательные суммы по состояниям при низких температурах равны 1, а при высоких температурах пропорциональны температуре в степени, равной числу колебательных степеней свободы (3N — 5 = 1 для молекулы H2 и 3N — 6 = 3 для линейного активированного комплекса). Учитывая все это, находим, что при низких температурах
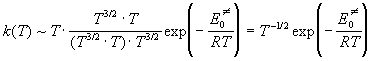
а при высоких температурах
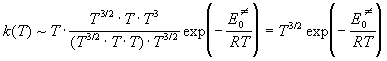
Пример 9-5. Кислотно-основная реакция в буферном растворе протекает по механизму: A — + H + 
k = 2.05 . 10 13. e -8681/T (л . моль -1. с -1 ).
Найдите опытную энергию активации и энтропию активации при 30 о С.
Решение. Так как бимолекулярная реакция происходит в растворе, для расчета термодинамических функций используем выражение (9.7). В это выражение нужно ввести опытную энергию активации. Поскольку предэкспоненциальный множитель в (9.7) линейно зависит от T, то Eоп = 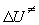
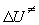
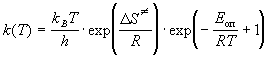
Отсюда следует, что опытная энергия активации равна Eоп = 8681. R = 72140 Дж/моль. Энтропию активации можно найти из предэкспоненциального множителя:
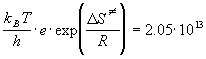
откуда 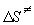
9-1. Диаметр метильного радикала равен 3.8 А. Какова максимальная константа скорости (в л/(моль. с)) реакции рекомбинации метильных радикалов при 27 о С?(ответ)
9-2. Вычислите значение стерического множителя в реакции димеризации этилена
2C2H4 
при 300 К, если опытная энергия активации равна 146.4 кДж/моль, эффективный диаметр этилена равен 0.49 нм, а опытная константа скорости при этой температуре равна 1.08. 10 -14 см 3 /(моль. с).(ответ)
9-3. Опытная константа скорости реакции
C2H4 + H2 ѕ 
равна 1.77. 10 -2 л/(моль. с) при 787 К. Средний диаметр молекулы этилена — 2 А, молекулы водорода — 1 А, стерический множитель равен 0.05. Найдите истинную энергию активации этой реакции.(ответ)
*9-4. Термическое разложение ацетальдегида — бимолекулярная реакция. Опытная энергия активации равна 45.5 ккал/моль, а диаметр молекулы — 4.5 А. Рассчитайте период полупревращения этой реакции при давлении 1 атм и температуре 800 К.(ответ)
9-5. Определите температурную зависимость константы скорости для реакции N2 + O2 
9-6. Определите температурную зависимость константы скорости для реакции CH3I 
9-7. Определите температурную зависимость константы скорости для реакции H . + Br2 
9-8. Для реакции CO + O2 = CO2 + O зависимость константы скорости от температуры при низких температурах имеет вид:
Какую конфигурацию — линейную или нелинейную — имеет активированный комплекс?(ответ)
9-9. Для реакции 2NO = (NO)2 зависимость константы скорости от температуры при невысоких температурах имеет вид:
Какую конфигурацию — линейную или нелинейную — имеет активированный комплекс?(ответ)
9-10. Используя теорию активного комплекса, вычислите истинную энергию активации E0 для реакции
CH3 . + C2H6 
при T = 300 K, если опытная энергия активации при этой температуре равна 8.3 ккал/моль .(ответ)
9-11. Выведите соотношение между опытной и истинной энергиями активации для реакции
2AB 
9-12. Определите энергию активации мономолекулярной реакции при 1000 К, если частота колебаний по разрываемой связи равна n = 2.4 . 10 13 с -1 , а константа скорости равна k = 510 мин -1 .(ответ)
9-13. Константа скорости реакции первого порядка разложения бромэтана при 500 о С равна 7.3 . 10 10 с -1 . Оцените энтропию активации этой реакции, если энергия активации равна 55 кДж/моль. (ответ)
9-14. Разложение перекиси ди-трет-бутила в газовой фазе представляет собой реакцию первого порядка, константа скорости которой (в с -1 ) зависит от температуры следующим образом:
Используя теорию активированного комплекса, рассчитайте энтальпию и энтропию активации при температуре 200 о С. (ответ)
9-15. Изомеризация диизопропилового эфира в аллилацетон в газовой фазе представляет собой реакцию первого порядка, константа скорости которой (в с -1 ) зависит от температуры следующим образом:
Используя теорию активированного комплекса, рассчитайте энтальпию и энтропию активации при температуре 400 о С. (ответ)
9-16. Зависимость константы скорости разложения винилэтилового эфира
C2H5-O-CH=CH2 
от температуры имеет вид
k = 2.7. 10 11. e -10200/T (с -1 ).
Рассчитайте энтропию активации при 530 о С. (ответ)
9-17. В газовой фазе вещество А мономолекулярно превращается в вещество В. Константы скорости реакции при температурах 120 и 140 о С равны, соответственно, 1.806 . 10 -4 и 9.14 . 10 -4 с -1 . Рассчитайте среднюю энтропию и теплоту активации в этом температурном интервале. (ответ)
Вывод уравнения ТАС.
Теории химической кинетики. Теория активных столкновений (ТАС).
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.
Вывод уравнения ТАС.
z – общее число столкновений в единицу времени.
z=
Д – эффективный диаметр молекул;
n – число молекул в единице объема;
M – молекулярная масса.
С помощью закона Больцмана определяем количество активных столкновений z 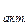
z
Тогда доля активных столкновений составит:
Рассмотрим бимолекулярную газовую реакцию типа: 2А 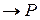
2HJ
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
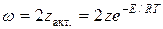
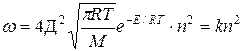
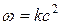
Отсюда видно, что скорость реакции зависит от квадрата концентрации.
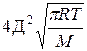
k=k 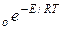
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k 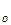
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z 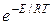
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
k = pz
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Е
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора.
Теория активных столкновений
Теория активных столкновений (С. Аррениус) основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активации.
В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты совершается в момент столкновения активных молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы, хотя в действительности химические реакции происходят путем постепенной перестройки молекул и перераспределения энергии между химическими связями.
Согласно молекулярно-кинетической теории энергия активации равна разности между средней энергии активных столкновений и средней энергии всех столкновений. Доля активных молекул, как показывают расчеты, составляет примерно от 10 -20 до 10 -10 . Если эта доля меньше, то скорость реакции мала, если же она больше, то реакция происходит быстро, иногда практически мгновенно. Чем выше энергия активации данной реакции, тем при более высоких температурах она совершается. Энергия активации ниже энергии диссоциации реагирующих молекул, так как для протекания реакции достаточно такого ослабления связей в молекулах, при котором начинают преобладать силы образования новых связей.
Источники активации могут быть самые разнообразные. Реакции между ионами в растворе происходят с небольшой энергией активации, которая требуется для дегидратации ионов. Реакции между свободными атомами и радикалами не требуют энергии активации, так как атомы и радикалы являются активными частицами. В гомогенных газовых реакциях основным источником активации служат столкновения, доля которых определяется законом распределения Больцмана и растет с температурой. В гетерогенных каталитических реакциях источниками активации могут служить изменения, происходящие в реагирующих молекулах при адсорбции их поверхностью катализатора. Активация может быть вызвана также внешними причинами: поглощением квантов света при фотохимических реакциях, действием электрических разрядов, ударом электронов, α – частиц, нейтронов и других излучений.
При подсчете числа столкновений нужно учитывать эффективный диаметр молекул ?. Рассмотрим элементарную бимолекулярную реакцию:
А + В → Продукты (XI.1)
Предположим, что молекула А неподвижна, а молекулы В движутся в пространстве параллельно прямой, проходящей через центр молекулы А. При отсутствии взаимодействия между молекулами А и В с молекулой А столкнутся все молекулы В, центры которых находятся внутри цилиндра, имеющего радиус r.
где σ1 и σ2 – диаметры молекул А и В соответственно. При притяжении между молекулами А и В прямолинейные пути молекул В, начиная с некоторого расстояния, искривляются, и молекулы сближаются, в результате чего с молекулой А столкнется часть молекул В, центры которых первоначально находились вне цилиндра с радиусом r. Тогда
При отталкивании молекул
где σ’1, σ’2, σ»1, σ»2 – эффективные диаметры молекул. Таким образом, эффективный диаметр молекул характеризует не только диаметры сталкивающихся молекул, но и взаимодействие между ними. Величина πσ 2 12 называется сечением соударений и имеет большое значение в современной теории кинетики химических реакций.
Эффективный диаметр σ молекул одного вида в газе рассчитывается с помощью молекулярно-кинетической теории или по эмпирическим уравнениям. Средний эффективный диаметр при столкновении с молекул разного вида вычисляем по уравнению

Согласно молекулярно-кинетической теории газов полное число столкновений L0 за 1 с в 1 м 3 между одинаковыми молекулами рассчитываются по уравнению

где n – число молекул в 1 м 3 ; m – масса частиц, кг.
Если в системе реагируют молекулы двух разных видов, то

Число столкновений активных молекул La, рассчитанное на основе закона распределения Максвелла–Больцмана, определяется соотношением

где L0 – полное число столкновений; E’ – энергия активации.
Исходя из теории активных соударений и молекулярно-кинетических представлений, вычислим константу скорости элементарной бимолекулярной реакции (XI.1) с участием молекул двух видов. Скорость рассматриваемой элементарной реакции согласно основному постулату химической кинетики выражается уравнением
где k – константа скорости; c1 и c2 – концентрации веществ А и В, моль/м 3 ;


где n1 и n2 – число частиц А и В в 1 м 3 ; NA – число Авогадро.
Число активных столкновений равно числу реагирующих молекул А или В:

При этом скорость реакции

И с учетом (XI.8) и (XI.5) примет вид

Приравнивая правые части уравнений (XI.6) и (XI.10) с учетом (XI.7), получаем

Подставляя L0 из (XI.4) в (XI.11), получаем уравнение для расчета константы скорости реакции



Можно написать вместо (XI.13)
Подставляя (XI.15) в (XI.12), получаем:

Логарифмирование уравнения (XI.16) дает:

Дифференцирование по T равенства (XI.17) приводит к соотношению (так как В’ приближенно не зависит от температуры)

Прологарифмированное уравнение Аррениуса
где k – константа скорости реакции; A – предэкспоненциальный множитель; E – энергия активации. Продифференцируем его и сравним с (XI.18), то получим

При температуре 300 — 400 К RT/2 = 1,2 — 1,4 кДж/моль. Поскольку энергия активации химической реакции обычно имеет значение от 50 до 200 кДж/моль, то при практических расчетах можно считать Е ≈ Е’. Поэтому для приближенного расчета констант скоростей бимолекулярных реакций вместо Е’ можно использовать энергию активации Е, вычисленную по уравнению Аррениуса на основании опытных данных.
Уравнение (XI.12) можно рассматривать как теоретическое обоснование уравнения Аррениуса на основе теории активных столкновений. Энергия активации в теории активных столкновений не вычисляется, а определяется опытным путем по зависимости скорости реакции от температуры. (Для некоторых сравнительно простых элементарных реакций энергия активации может быть вычислена из квантово-химических представлений). Предэкспоненциальные множители для бимолекулярных элементарных реакций рассчитываются по уравнению (XI.13). Однако бимолекулярные реакции, для которых экспериментально найденные предэкспоненциальные множители совпадают с рассчитанными, встречаются сравнительно редко. Чаще всего предэкспоненциальные множители, рассчитанные теоретически как для реакций в газах, так и растворах, значительно превышают экспериментальные значения. Это связано с упрощенным характером теории активных столкновений, которая считает, что столкновения между молекулами аналогичны столкновениям упругих шаров. В связи с этим в уравнение (XI.12) вводится множитель P, учитывающий отклонение теоретических расчетов от опытных данных. Этот множитель называется стерическим или энтропийным фактором. Уравнение (XI.12) с учетом этого фактора принимает вид

При столкновении активных молекул должно быть вполне определенное расположение в пространстве активных групп, входящих в состав молекулы, которое бы обеспечило образование конечных продуктов. Стерический фактор P в большинстве случаев характеризует вероятность определенной геометрической конфигурации частиц при столкновении.
Есть и другие причины, приводящие к расхождению теории активных столкновений с опытом, которые также учитываются стерическим или энтропийным фактором. Вследствие туннельного эффекта элементарный акт может произойти при значениях энергии активации меньше Е. Это формально характеризуется величиной Р > 1. Вновь образующиеся молекулы могут быть сильно возбужденными. Если такие молекулы не освободятся от избытка энергии после своего возникновения, то они вновь могут превратиться в молекулы исходного вещества; в этом случае Р > k2

где k1 = cAB / (cA cB) – константа равновесия. Вторая стадия реакции является лимитирующей.
Во втором предельном случае при k-1 3 раствора; dc2 / dr – градиент концентрации вещества B.
Чтобы определить поток J , разделим переменные r и c2 и проинтегрируем (XI.96) от R * до ∞ и от 0 до c2:

где R * – расстояние между молекулами A и B при образовании пары столкновения; полагаем, что на расстоянии меньше R, c2 = 0.
Для простоты полагаем, что раствор достаточно разбавленный, и в процессе диффузии молекул B к молекуле A через слой раствора они не встречаются с другими молекулами, A и, поэтому, поток J имеет постоянное значение.
В результате интегрирования (XI.97), получаем
Скорость реакции, контролируемая диффузией, определяется скоростью потока молекул B к молекуле A. При этом скорость реакции w равна числу пар столкновения, которые образуются в 1 с в 1 м 3 раствора:

где n1 = NA c1 – число молекул A в 1 м 3 раствора.
Подставляя значение J из (XI.98) в (XI.99), определяем
где D = D1 + D2, так как нужно учесть, что молекулы A также диффундируют в растворе навстречу молекулам B.
Приравнивая правые части уравнений (XI.100) и (XI.92), получаем для k3 выражение
Это выражение можно преобразовать, если для D1 и D2 использовать соотношение Стокса–Эйнштейна



где η – коэффициент вязкости раствора (или растворителя для достаточно разбавленного раствора). Подставляя (XI.103) в (XI.101), получаем


Таким образом, в рассмотренном предельном случае ( k1 ≠ → Продукты (XI.105)
константа скорости согласно (*) (при χ = 1) равна

Но термодинамическая константа равновесия в растворе выражается через активности


Подставляя уравнение (XI.108) в (XI.106), получаем

При γA = γB = γ ≠ = 1 уравнение (XI.109) преобразуется к виду
где k0 – константа скорости реакции, коэффициенты активности равны единице. Между константами k и k0 имеется соотношение

С этим случаем мы встречаемся, например, когда одна и та же реакция может проводиться как в газовой фазе ( k0 ), так и в растворе ( k ).
Если исходные вещества A и B являются молекулами и, кроме того, принять γA = γB = γ ≠ = γ, то из выражения (XI.110) получаем, что k = k0 γ. Это означает, что для бимолекулярных реакций между молекулами константы скорости реакции при проведении ее в газовой фазе и в растворе различны.
Для мономолекулярной реакции
А → А ≠ → Продукты (XI.111)
Рассуждая аналогично, получаем выражение

Если вещество A находится в растворе в молекулярной форме и принимая γA = γ ≠ = γ, то из уравнения (XI.112) получаем, что k = k0, т.е. для мономолекулярной реакции теория абсолютных скоростей реакций предсказывает слабое влияние растворителя и его природы на кинетику реакции, если конфигурация активированного комплекса мало отличается от исходных молекул.
Опыт во многих случаях подтверждает теорию. Например, мономолекулярная реакция разложения оксида азота ( N2O5 ) в газовой фазе при температуре 293 К имеет константу скорости, равную 3,4 ⋅ 10 -5 с -1 . При использовании в качестве растворителя хлороформа, дихлорэтана, нитрометана, жидкого брома и тетрахлорида углерода константы скорости при той же температуре равны соответственно 3,7 ⋅ 10 -5 ; 4,2 ⋅ 10 -5 ; 3,1 ⋅ 10 -5 ; 4,1 ⋅ 10 -5 с -1 . В случае бимолекулярных элементарных реакций перенос реакции из газовой фазы в раствор, а также изменение природы растворителя, как правило, заметно влияют на константу скорости реакции в соответствии с предсказанием теории абсолютных скоростей реакций.
Важное подтверждение теории абсолютных скоростей реакций получила для реакций между ионами в растворах сильных электролитов, так как в этом случае коэффициенты активности могут быть вычислены из теории сильных электролитов Дебая–Хюккеля. Если раствор электролита разбавленный, то коэффициенты активности можно выразить приближенно с помощью предельного закона Дебая–Хюккеля:

где A – теоретический коэффициент, который для водных растворов равен 0,509; zi – заряд i-го иона; I – ионная сила раствора.
Если в реакции (XI.105) исходные вещества A и B являются ионами с зарядами zA и zB , то коэффициенты активности в уравнении (XI.110) можно приближенно выразить из уравнения (XI.113), принимая, что заряд активированного комплекса равен алгебраической сумме zA + zB зарядов реагирующих ионов:

Таким образом, из теории активированного комплекса следует, что если в бимолекулярной реакции в растворе участвуют два иона с одинаковыми зарядами ( zA zB > 0 ), то lg ( k / k0 ) > 0 и константа скорости реакции увеличивается с ростом ионной силы раствора. Если же заряды ионов противоположные ( zA zB < 0 ), то и константа скорости реакции уменьшается с ростом ионной силы. Кроме того, согласно уравнению (XI.114) график в координатах lg ( k / k0 ) — √I в достаточно разбавленных растворах должен изображаться прямыми линиями, выходящими из начала координат, причем чем больше произведение zA zB, тем больше должен быть угол наклона этих прямых. Опытные данные хорошо подтверждают предсказания теории (рис.2).
Влияние ионной силы раствора на константу скорости реакции между ионами из-за изменения коэффициента активности ионов в растворах сильных электролитов называется первичным (или кинетическим) солевым эффектом. В реакциях с участием одного из ионов слабого электролита (например, иона водорода слабой кислоты) посторонний электролиз может влиять непосредственно на его концентрацию и, следовательно, на скорость реакции. Это – вторичный солевой эффект.
http://helpiks.org/9-70685.html
http://www.corrosion.su/the_theory_of_active_collisions.php