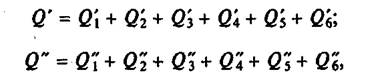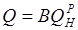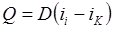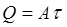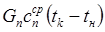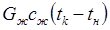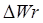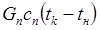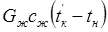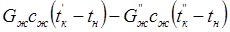Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
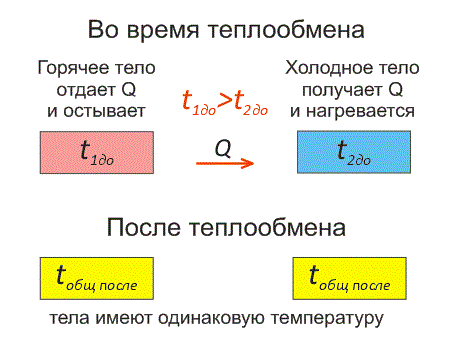
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
\(\large Q_<\text<остывания горяч>> \left( \text <Дж>\right) \) – это количество теплоты горячее тело теряет.
\(\large Q_<\text<нагревания холод>> \left( \text <Дж>\right) \) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
\[\large Q_ <1>+ Q_ <2>= 0 \]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
\[\large \boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ \ldots + Q_
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- \(\large c_<\text<воды>> \) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность \(\large (t_<\text<общ>> — t_<\text<горяч>> ) \) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность \(\large (t_<\text<общ>> — t_<\text<холодн>> ) \) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
\[\large 4200 \cdot 0,2 \cdot (t_<\text<общ>> — 80 ) + 4200 \cdot 0,1 \cdot (t_<\text<общ>> — 15 ) = 0 \]
\[\large 840 \cdot (t_<\text<общ>> — 80 ) + 420 \cdot (t_<\text<общ>> — 15 ) = 0 \]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- \(\large Q_ <1>\) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- \(\large Q_ <2>\) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- \(\large Q_ <3>\) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Тепловой расчет аппарата. Виды расчетов тепловых аппаратов. Тепловой баланс аппарата. Виды расчетов тепловых аппаратов
Страницы работы
Фрагмент текста работы
Лекция 4Тепловой расчет аппарата
1. Виды расчетов тепловых аппаратов.
2. Тепловой баланс аппарата.
1. Виды расчетов тепловых аппаратов.
Целью конструкторского расчета является определение поверхности теплообмена и конструктивных размеров аппарата.
Поверочный расчет производят с целью выявления возможности использования стандартных теплообменных аппаратов для заданного технологического процесса.
Из основного уравнения теплопередачи рассчитывается тепловая нагрузка аппарата Q (Вт):
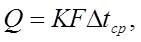
где К — коэффициент теплопередачи, Вт/(м 2 ·К);
F — поверхность теплопередачи, м 2 ;
Δtср — средняя разность температур (движущая сила теплообмена), °С.
Уравнение теплового баланса имеет вид:
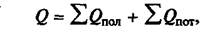
где Q — количество подведенной теплоты в аппарате, Вт;
ΣQпол — сумма составляющих полезно используемой теплоты, Вт;
ΣQпоn — суммарные потери теплоты в аппарате, Вт.
2. Тепловой баланс аппарата
Уравнения теплового баланса для нестационарного и стационарного режимов работы аппарата:
где — один штрих относится к режиму разогрева, а два штриха — к стационарному режиму;
Таблица 1. Составляющие элементы теплового баланса в зависимости от вида энергоносителя (режим разогрева)
Вид энергоносителя в тепловом аппарате
Полез-но используемая тепло-та
Потери теплоты, Вт
с уходящими продуктами сгора-ния топлива
от химической непол-ноты сгорания топлива
от механичес-кой неполноты сгорания топлива
наружными ограждения-ми аппа-рата
на разогрев конструкции аппарата
Газообразное и жидкое топливо
Таблица 2. Определение количества теплоты, вносимой в аппарат, в зависимости от вида энергоносителя
Вид энергоносителя, используемого в тепловом аппарате
Твердое, жидкое и газообразное топливо
В — расход топлива, кг/с или м 3 /с; 
D — расход пара, кг/с; ii — iк — теплосодержание соответственно пара и конденсата, Дж/кг
А — расход электроэнергии, Вт/с; τ – продолжительность процесса, с
Количество полезно используемой теплоты является основной характеристикой теплового аппарата и определяет его коэффициент полезного действия (η):
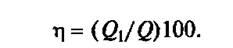
Расход полезно используемой теплоты Q1 при расчете теплового баланса аппарата можно разделить на три основные составляющие:
— нагрев продукта от его начальной температуры до температуры технологического процесса и выдержка его при этой температуре до достижения необходимой степени готовности);
— нагрев технологической среды (молоко, бульон, вода, жир, соус, воздух) от начальной температуры до температуры, требуемой в данном технологическом процессе, и поддержание этой температуры в течение всего процесса;
— расход теплоты на испарение воды из продукта и технологической среды.
Таблица 3. Основные составляющие элементы уравнений для определения полезно используемой теплоты Q1
Технологический процесс тепловой обработки
на нагрев технологической среды
на испарение воды из продукта и технологической
Основное уравнение для определения Q1 будет иметь следующий вид:
а) при варке: 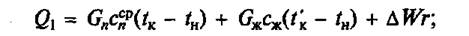
б) при жарке основным способом: 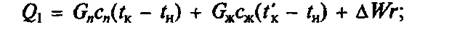
в) при жарке во фритюре: 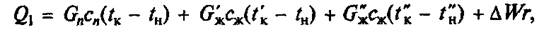
где Gn — общее количество жидкости (вода, бульон, молоко), загружаемой в аппарат, кг; сж — средняя массовая удельная теплоемкость жидкости в интервале температур tн – tк, Дж/(кг • К); tк — температура кипения содержимого котла, °С или К; tн — начальная температура жидкости, 0 С или К; ΔW — количество испарившейся воды, кг; r — удельная массовая теплота испарения, Дж/кг.
Расчет числа компонентов производится по формуле:
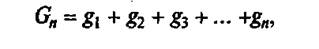
При варке многокомпонентной смеси при расчете используют среднюю массовую удельную теплоемкость 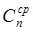
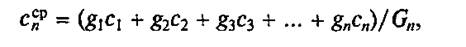
где с1, с2, с3, . сn — средние массовые удельные теплоемкости отдельных продуктов в интервале температур tн-tк, Дж/(кг·К).
Удельная теплоемкость отдельных компонентов смеси рассчитывается по универсальной для всех влажных продуктов формуле:
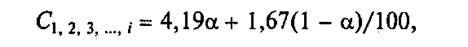
где α — влажность продукта, %.
Начальная температура tн при тепловой обработке многокомпонентной смеси принимается равной её средней температуре:
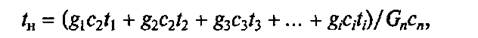
где t1, t2, t3 — начальные температуры отдельных продуктов, загружаемых в котел, °С или К.
Полезно используемую теплоту для режима слабого кипения (стационарный) 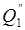
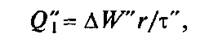
где Δ W» — количество воды, удаляемой в процессе кипения, кг; τ» — продолжительность стационарного режима, с.
Для расчета количества отдельных продуктов, загружаемых в котел, необходимо определить число порций (n) приготовляемой продукции:
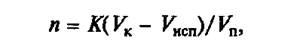
где К — коэффициент заполнения котла, равный 0,8 — 0,9; VK — объем котла, дм 3 ; Vк — объем испарившейся воды за весь период варки, дм 3 ; Vn — объем одной порции, дм 3 .
Количество воды, удаляемой в процессе варки отдельных блюд, зависит
Уравнение теплового баланса — формула, суть и примеры решений
Общие сведения
Баланс в переводе на русский язык означает равновесие. Когда теплоизолированная система приходит в состояние теплового равновесия, то температура всех тел, образующих эту совокупность, становится одинаковой. Такую ситуацию называют законом теплового равновесия или нулевым уравнением термодинамики.
Впервые с уравнением теплового баланса знакомят в средней школе на уроке физики. Ученикам в седьмом классе предлагается решить несколько простых заданий, используя равенство. Формула и определение даётся без доказательства, так как для понимания процесса нужно знать понятия, которые разбираются в выпускных классах школы. Например, то, что теплоёмкость не является характеристикой вещества, при этом она может быть разной в зависимости от проходящих процессов.
Закон теплового баланса позволяет утверждать, что когда в изолированной системе физических тел происходит только теплообмен, то часть тепла, переданного телами, внутреннее состояние энергии которых уменьшается, численно равняется теплу, полученному объектами с возрастающей внутренней энергии. Математически уравнение записывается в виде следующей формулы: Q 1 + Q 2 + Q 3 + …+ Qn = 0, где:
- n — число тел, находящихся в теплоизолированной системе;
- Q — полученное количество теплоты.
Если предположить, что имеется совокупность, состоящая из двух тел, из которых одно отдаёт тепло, а другое принимает его, то справедливо будет записать: Q1 = Q2. Таким образом, теплоотдача всегда равняется теплоприёму. Поэтому этот закон и называют правилом сохранения энергии в тепловых процессах.
Когда тела два, то понять, какое из них отдаёт тепло, а какое получает, несложно. То, что имеет большее нагревание, — будет отдавать. Если же объектов три и более, и некоторые из них имеют промежуточную температуру, определить, какие из них принимают тепло, довольно сложно. Вот тут на помощь и приходит уравнение термодинамики.
Изменение внутренней энергии объясняется теплопередачей, то есть случаем, когда работа не совершается. Поэтому в физике уравнение теплового баланса используется при анализе процессов теплопередачи, нахождении КПД. Это равенство можно применять как при рассмотрении твёрдых тел, так и жидкости.
Суть уравнения
Следует рассмотреть процесс установления теплового равновесия в теплоизолированной системе. Это такая совокупность, в которой объекты взаимодействуют только друг с другом. Простейшая система будет состоять из двух тел. Например, в термос налит сок и в него вброшен лёд. В этом случае термос является изолятором от внешнего воздействия. Пусть первое тело имеет температуру t1, а второе t2. Допустим, что t1 больше t2. Это допущение не является принципиальным, поэтому его можно использовать.
В начальный момент времени тела находятся далеко друг от друга и теплообмен между ними не происходит. Как только, они соприкоснутся — начнётся взаимодействие. Так как температура первого тела больше, то оно начнёт остывать, а второе нагреваться. Происходит теплопередача. В какой-то момент времени она прекратится и наступит тепловое равновесие. То есть температура двух тел станет одинаковой: t1 = t2.
Получившаяся температура называется равновесной. Обозначается она греческой буквой тета — θ. Так как раньше первое тело имело большую температуру, то получается, что в процессе взаимодействия оно отдало тепло. Записать это можно как Q1 — — количество теплоты, отданное первым телом. Второй же объект в процессе подогрелся — увеличил температуру. Обозначить это можно как +Q2 — количество теплоты, полученное вторым телом.
Получить тепло второй объект мог только от первого тела, так как рассматриваемая система изолированная. Соответственно, и отдать определённое количество теплоты первое тело могло только второму. Отсюда можно сделать вывод, что если система теплоизолированная, то эти два количества теплоты одинаковы: Q1 — = +Q2. Фактически это есть уравнение баланса.
Такая запись даётся в школьных учебниках. Но профессиональные физики записывают его в другой форме. Для термодинамики неважно, какой объект отдаёт, а какой получает тепло. Наука изучает только количество теплоты, полученное в процессе. Взяв простую аналогию с весом, когда о похудевшем человеке на два килограмма можно сказать, что он поправился на минус два кило, будет верным записать: Q1 — = -Q1 или -Q1 = Q2.
Если собрать два слагаемых таким образом, чтобы они находились с одной стороны знака равенства, то можно записать: Q1 + Q2 = 0.
Суммарное количество теплоты, образуемое при теплообмене тел в теплоизолированной системе, равно нулю. При этом это правило будет справедливо и для энного количества объектов.
Доказательство закона
Пусть имеется теплоизолированная система, состоящая из нескольких помещённых в неё объектов. Сами тела могут обмениваться теплом только друг с другом. Первый закон термодинамики для системы в целом можно записать как Q = А’ + Δ U. То есть количество теплоты, полученное всей системой, равняется суммарной работе, совершённой всеми телами в совокупности над внешним миром, складывающейся с изменением энергии всех тел внутри системы.
По условию задачи внутренняя энергия меняется не за счёт совершения работы. Поэтому А’ = 0. С другой же стороны, теплоизоляция обозначает, что Q = 0. Иными словами, количество энергии, поступающее из окружения Земли, равняется нулю. Следовательно, изменение внутренней энергии всех тел в системе будет нулевым: Δ U = 0.
Энергия системы состоит из внутренних энергий каждого из входящих в неё тел: U = U1 + U2 +…+ Un. Изменение же её Δ U = Δ U 1 + Δ U 2 + … + Δ Un. Отсюда следует, что если внутренняя энергия остаётся неизменной, то сумма Δ U будет нулевой: Δ U 1 + Δ U 2 + … + Δ Un = 0.
Первый закон термодинамики персонально для каждого из тел входящих в систему можно записать как следующую систему:
Все уравнения, входящие в неё, можно сложить почленно. При этом распределив слагаемые для удобства дальнейшего анализирования: Q1 + Q2 +…+ Q n = (А n1′ + А n2′ + … + А n’) + (Δ U1 + Δ U2 + … + Δ Un). Из полученного выражения можно сделать вывод, что сумма дельт второго члена в правой части равняется нулю. В первом же члене с правой стороны каждое слагаемое также равняется нулю. Поэтому можно записать: Q1 + Q2 +…+ Q n = 0. Что и следовало доказать.
Для решения задач полезно вспомнить, на что может идти полученное тепло. К таким частным случаям относят:
- Процессы, при которых нет фазовых переходов. В таком случае полученное количество идёт на увеличение теплоты потенциальной и кинетической энергии: Q = c * m * ΔT (изохорная теплоёмкость).
- Плавление. Например, есть тающий лёд, к которому подводят тепло, при этом кинетическая энергия остаётся постоянной. Значит, изменяется только потенциальная мощность. В этом случае происходит превращение льда в воду. Это действие называют плавлением — переход кристаллического вещества из твёрдого состояния в жидкое: Q = λ * m.
- Парообразование. Выделение из жидкости пара: Q = L * m.
Типовое задание
Явление теплового баланса используется как в изучении процессов при переходе из одного агрегатного состояния в другое, так и для твёрдых или жидких тел, не изменяющих решётку. Существуют типовые задания, входящие в школьную программу. Ученик, решая их, научится находить удельные параметры и сможет понять всю важность выражения теплового баланса.
В латунный котёл массой 128 граммов, содержащий 240 граммов воды, при 8,4 градусах опущено металлическое тело массой 192 грамма, нагретое до 120 градусов Цельсия. Окончательная установившаяся температура составила 21,5 градус. Определить удельную теплоёмкость рассматриваемого тела. Для решения задачи необходимо из справочника взять значение энергетической теплоёмкости латуни. Она составляет 400 Дж/ кг *С 0 . При этом нужно учитывать, что котёл теплоизолирован.
Температуру, которая установилась через время, обозначают буквой θ. Решение подобных задач начинают с установления количества тел, участвующих в теплообмене. В этом примере их три: вода, котёл, испытываемое тело. Количество тепла, полученное всеми тремя объектами, согласно закону, будет равняться нулю: Qв + Qк +Qт = 0. Теперь следует каждое слагаемое расписать отдельно:
- Qв = mв * cв * Св (θ — Tв).
- Qк = mк * cл * (θ — Tв).
- Qт = mт * cт * (θ — Tк).
Полученные формулы нужно подставить в исходное уравнение. При этом следует обратить внимание, что при подстановке образуется общий множитель (θ — T в), который можно вынести за скобки: (m в * c в + m к * c л) * (θ — T в) + m т * c т * (θ — T к) = 0.
Из условия задачи известно, что у тела температура 100 градусов, а равновесная температура меньше. Поэтому последняя скобка будет отрицательной. Значит, есть смысл перенести это слагаемое вправо, поменяв местами вычитаемое и уменьшаемое: (m в * c в + m к * c л) * (θ — T в) = m т * c т * (T к — θ). Отсюда можно выразить удельную теплоёмкость массы тела. Она будет равняться: C т = (m в * c в + m к * c л) * (θ — T в) / m т * (T к — θ) .
Все данные, используемые в формуле, известны. Остаётся только провести расчёты, подставив значения: Cт = (0,24 кг * 4,2 кДж/кг*С + 0,128 кг * 0,4 кДж/кг*С *(21,5 — 8,4) С) / 0,192 кг * (100 — 21,5)С = 0,921 кДж/ кг *С 0 . Полученное вещество является алюминием.
Примеры высокого уровня
Эти задачи рассчитаны на подготовленных учащихся, понимающих суть процессов и знающих уравнение баланса. Например, электрическая установка с мощностью P = 350 Вт не может нагреть воду массой 0,6 кг до кипения. Убедившись в этом, её выключают. Нужно определить, каким останется конечный нагрев воды через 15 секунд.
Из условия можно утверждать, что мощность теплопотерь равняется мощности нагревателя: Pпот = P. По сути, мощность теплопотерь это количество тепла, отдаваемое телом в единицу времени. То есть: P пот = Q — / ΔT. С другой стороны, отданное тепло находится из формулы: Q — = c * m * (-ΔT). Отсюда можно записать: P = — c * m * ΔT / Δt. Из последнего выражения легко выразить искомый параметр: ΔT = -(P * Δt) / (c * m). Все необходимые данные есть в условии и их необходимо просто подставить: ΔT = — 350 Вт * 15 с / 4200 Дж * 0,6 кг = — 2,1 С 0 . Минус в ответе показывает, что температура понижается. Задача решена.
Вот ещё одна задача, для решения которой необходимо вначале исследовать ситуацию. В ёмкость поместили смесь, состоящую из пяти килограммов воды и трёх килограммов льда. Затем туда пустили 0,2 кг водяного пара при температуре 100 0 С. Нужно определить, что произойдёт.
По условию задачи даны три массы mв, mл, mп. Можно предположить, что при смешении в момент запуска пара температура в системе была нулевой. Это исходит из того, что в ёмкости одновременно находится лёд и вода. Поступающий пар конденсирует, и из него образуется вода. Через время она остывает до нуля. Поэтому в начальный момент выделившаяся энергия идёт только на таяние льда. Cуществует три варианта развития события:
- Лёд не растает ( θ =0 0 С).
- Лёд полностью растает (0 0 С).
- Вода начнёт кипеть ( θ = 100 0 С) .
Для того чтобы выяснить, какой вариант верный, нужно найти выделившуюся энергию: Qпл = λ * m = 330 * 3 = 990 кДж. Получается, чтобы растопить лёд, нужно 990 кДж теплоты. Пар, вступая в реакцию, отдаёт: Q- = L* m + cв * mв (Tпар – Tпл) = 2300 + 0,2 + 4,2 * 0,2 * 100 = 544 кДж. Учитывая два полученных результата, можно утверждать, что при конденсации основного пара выделившейся теплоты будет недостаточно для расплавления льда. Следовательно θ = 0 0 С.
http://vunivere.ru/work71200
http://nauka.club/fizika/uravneni%D0%B5-teplovogo-balansa.html