Решение задач на теплообмен с использованием уравнения теплового баланса (методические рекомендации)
Разделы: Физика
Пособие рекомендовано учащимся, желающим получить практические навыки в решении задач на теплообмен, и может быть полезным для учителей и абитуриентов.
При соприкосновении тел, имеющих разные температуры, между этими телами происходит теплообмен. С точки зрения молекулярно-кинетической теории, это объясняется так: молекулы более нагретого тела имеют большую кинетическую энергию, чем молекулы тела, менее нагретого. При “столкновениях” молекул соприкасающихся тел происходит процесс выравнивания их средних кинетических энергий. Молекулы более нагретого тела теряют часть своей кинетической энергии, при этом нагретое тело будет остывать. Кинетическая энергия молекул холодного тела возрастает, поэтому температура этого тела будет увеличиваться. В конечном итоге кинетические энергии молекул обоих тел сравняются, и температуры тел станут одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в процессе теплообмена, называют количеством теплоты (Q).
Количество теплоты, как и все другие виды энергии, измеряется в системе СИ в Джоулях: [Q] = Дж. (Здесь и в дальнейшем единицы измеряются в системе СИ.)
Нагревание или охлаждение
При нагревании или охлаждении тела количество теплоты, поглощаемое или выделяемое им, рассчитывается по формуле:
(t2 – t1) – разность температур тела,° С (или К);
с – удельная теплоёмкость вещества, из которого состоит тело,
Удельная теплоёмкость вещества – это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1° С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1° С).
Значения удельных теплоемкостей других веществ можно найти в справочниках, а также в школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия увеличивается. Это требует притока энергии к телу от других тел. Значит, оно поглощает некоторое количество теплоты, принимая его от других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия уменьшается. Поэтому остывающее тело отдаёт кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в результате теплообмена, обозначают греческой буквой 
В формуле (1) произведение cm для каждого конкретного тела есть величина постоянная. Её называют теплоёмкостью тела и обозначают С:
Размерность теплоемкости: 
Теплообмен между телами, имеющими одинаковые температуры, не происходит, даже если контактируют вещества, находящиеся в разных агрегатных состояниях. Например, при температуре плавления (0° С) лёд и вода могут находиться бесконечно долго, при этом количество льда и количество воды останутся неизменными. Аналогично ведут себя пар и жидкость, находящиеся при температуре кипения. Теплообмен между ними не происходит.
Плавление или кристаллизация
Если при нагревании тела его температура достигнет температуры плавления, то начинает происходить процесс перехода этого вещества из твердого состояния в жидкое. При этом идут изменения в расположении и характере взаимодействия молекул. Температура при плавлении не изменяется. Это означает, что средние кинетические энергии молекул жидкости и твердого тела при температуре плавления одинаковы. Однако внутренняя энергия тела при плавлении возрастает за счет увеличения энергии взаимодействия молекул. Количество теплоты, поглощаемое телом при плавлении, рассчитывается по формуле

где m – масса тела, кг;

При кристаллизации, наоборот, внутренняя энергия тела уменьшается на величину 
Удельная теплота плавления показывает, сколько энергии нужно сообщить одному килограмму данного вещества, взятого при температуре плавления, чтобы полностью превратить его при этой температуре в жидкость (или сколько энергии выделяет 1 кг жидкости, взятой при температуре кристаллизации, если вся она при этой температуре полностью превратится в твёрдое тело).
Удельную теплоту плавления любого вещества можно найти в справочниках. Для льда же
Температура плавления у каждого вещества своя. Её также можно найти в справочниках. Важно подчеркнуть, что температура плавления вещества равна температуре кристаллизации этого же вещества. У льда tпл = 0° С.
Кипение или конденсация
При достижении жидкостью температуры кипения начинает происходить другой фазовый переход – кипение, при котором расстояния между молекулами значительно увеличиваются, а силы взаимодействия молекул уменьшаются. Вся подводимая к жидкости теплота идет на разрыв связей между молекулами. При конденсации пара в жидкость, наоборот, расстояния между молекулами значительно сокращаются, а силы взаимодействия молекул увеличиваются. Для кипения жидкости энергию к жидкости нужно подводить, при конденсации пара энергия выделяется. Количество теплоты, поглощаемое при кипении или выделяемое при конденсации, рассчитывается по формуле:
где m – масса тела, кг; L – удельная теплота парообразования,
Удельная теплота парообразования показывает, сколько энергии нужно сообщить одному килограмму жидкости, взятой при температуре кипения, чтобы при этой температуре полностью превратить её в пар (для конденсации: сколько энергии выделяет один килограмм пара, взятого при температуре конденсации, полностью превращаясь в жидкость).
При одинаковом давлении температура кипения и температура конденсации одного и того же вещества одинаковы.
Температуры кипения и удельные теплоты парообразования также можно найти в справочниках. Для воды же они соответственно равны: рис. 9 (при нормальном атмосферном давлении).
Уравнение теплового баланса
Тела, участвующие в теплообмене, представляют собой термодинамическую систему. Термодинамическая система называется теплоизолированной, если она не получает энергию извне и не отдаёт её; теплообмен происходит только между телами, входящими в эту систему. Для любой теплоизолированной системы тел справедливо следующее утверждение: количество теплоты, отданное одними телами, равно количеству теплоты, принимаемому другими телами.
Это утверждение описывает частный случай закона сохранения и превращения энергии в применении к процессу теплообмена. А формула (5) является одним из видов уравнения теплового баланса.
При решении задач с помощью данного вида уравнения теплового баланса в формуле (1) в качестве t2 следует брать большую температуру, а в качестве t1 – меньшую. Тогда разность (t2 – t1) будет положительна и всё произведение cm(t2–t1) также будет положительным. Все теплоты, отданные и полученные, будут положительными.
Уравнение теплового баланса можно записать и в таком виде:
где n – количество тел системы.
Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю.
Q1, Q2, …, Qn – это теплоты, поглощаемые или выделяемые участниками теплообмена. Очевидно, что в этом случае какие-то теплоты должны быть положительны, а какие-то – отрицательны. При записи уравнения теплового баланса в виде (6) всегда t2 – конечная температура, а t1 – начальная.
Если тело нагревается, то разность (t2 – t1) положительна и все произведение cm(t2 – t1) положительно. То есть Q > 0 тогда, когда теплота к данному телу подводится.
А если t2 0; если тело выделяет энергию (кристаллизация, конденсация), то Q
 | Проведём анализ: Вода и калориметр находились в тепловом равновесии, поэтому они имели одинаковую температуру: t1 = t2 = 20° С. При опускании в воду с температурой 20° С свинцового тела с температурой 90° С между водой и свинцом будет происходить теплообмен. Свинец будет остывать, а вода — нагреваться. В этом же процессе участвует и калориметр, который, как и вода, будет тоже нагреваться. |
 | Изменение температур тел с течением времени удобно изображать на графике зависимости t(t ). Отрезок АВ соответствует графику изменения температуры свинцового тела. Стрелка, идущая от него, показывает, что, остывая, свинец выделяет энергию Q3. |
| Два параллельных отрезка СВ соответствуют графикам изменения температур калориметра и воды. Стрелки, идущие к ним, показывают, что для нагревания калориметра и воды требуется энергия Q1 и Q2, которую они поглощают. | |
| Решим задачу с использованием уравнения теплового баланса в виде (5): |
Решим задачу с использованием уравнения теплового баланса в виде (6):
Ответ: Вода нагреется до 24° С.
Предлагаю читателю самостоятельно сделать проверку размерности.
Фазовые переходы и уравнение теплового баланса
теория по физике 🧲 термодинамика
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
Определение Отвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Парообразование и конденсация
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
Определение Конденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
Тепловые процессы при нагревании и охлаждении
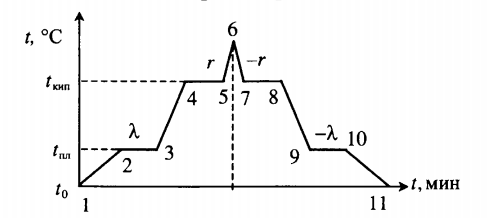
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.
| Процесс | Что происходит | Количество выделенной теплоты | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1–2 | Нагревание твердого тела | |||||||||||||||||||||||||||||||||||||||||||||||||
| 2–3 | Плавление при температуре плавления (tпл) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3–4 | Нагревание жидкости | |||||||||||||||||||||||||||||||||||||||||||||||||
| 4–5 | Кипение при температуре кипения (tкип) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 5–6 | Нагревание пара | |||||||||||||||||||||||||||||||||||||||||||||||||
| 6–7 | Охлаждение пара | |||||||||||||||||||||||||||||||||||||||||||||||||
| 7–8 | Кипение при температуре кипения (tкип) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 8–9 | Охлаждение жидкости | |||||||||||||||||||||||||||||||||||||||||||||||||
| 9–10 | Отвердевание при температуре плавления (tпл) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 10–11 | Охлаждение твердого тела |
| Что происходит | График | Формула количества теплоты | |||||||||||||||||||||||||||||||||||||
| Полностью растопили лед, имеющий отрицательную температуру. | 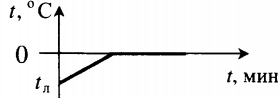 | ||||||||||||||||||||||||||||||||||||||
| Лед, взятый при отрицательной температуре, превратили в воду при комнатной температуре. | 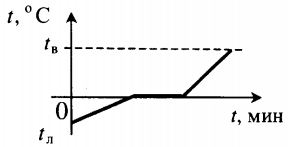 | ||||||||||||||||||||||||||||||||||||||
| Взяли лед при температуре 0 о С и полностью испарили. | 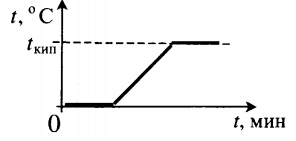 | ||||||||||||||||||||||||||||||||||||||
| Взяли воду при комнатной температуре и половину превратили в пар. | 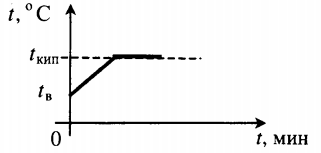 |
| Единицы измерения | Температуру можно оставлять в градусах Цельсия, так как изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах. |
| Кипяток | Вода, которая при нормальном атмосферном давлении имеет температуру в 100 о С. |
| Объем воды 5 л | m = 5 кг, так как: m = ρ V =10 3 · 5 · 10 − 3 м 3 = 5 к г Внимание! Равенство V (л) = m (кг) справедливо только для воды. |
Пример №1. Какое количество теплоты нужно сообщить льду массой 2 кг, находящемуся при температуре –10 о С, чтобы превратить его в воду и нагреть ее до температуры +30 о С?
Можно выделить три тепловых процесса:
- Нагревание льда до температуры плавления.
- Плавление льда.
- Нагревание воды до указанной температуры.
Поэтому количество теплоты будет равно сумме количеств теплоты для каждого из этих процессов:
Q = Q 1 + Q 2 + Q 3
Q = c л m ( 0 − t 1 ) + λ m + c в m ( t 2 − 0 )
Удельные теплоемкости и удельную теплоту плавления смотрим в таблицах:
- Удельная теплоемкость льда = 2050 Дж/(кг∙К).
- Удельная теплоемкость воды = 4200 Дж/(кг∙К).
- Удельная теплота плавления льда = 333,5∙10 3 Дж/кг.
Q = 2050 · 2 ( 0 − ( − 10 ) ) + 333 , 5 · 10 3 · 2 + 4220 · 2 · 30 = 961200 ( д ж ) = 961 , 2 ( к Д ж )
Уравнение теплового баланса
Суммарное количество теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
Математически уравнение теплового баланса с учетом знаков количества теплоты записывается так:
Q о т д = − Q п о л
Отданное количество теплоты меньше нуля (Qотд 0).
Подсказки к задачам на уравнение теплового баланса
| Теплообмен происходит в калориметре | Потерями энергии можно пренебречь. |
| Жидкость нагревают в некотором сосуде | Начальные и конечные температуры жидкости и сосуда совпадают. |
| В жидкость опускают термометр | Через некоторое время он покажет конечную температуру жидкости и термометра. |
| Мокрый снег | Содержит воду и лед при 0 о С. Учтите, что лед плавится, если он находится при температуре 0 о С и получает энергию от более нагретого тела. Вода кристаллизируется при температуре 0 о С, если она отдает энергию более холодному телу. Если лед и вода находятся при температуре 0 о С, то никаких агрегатных переходов между ними не происходит. |
Частные случаи теплообмена
| В воду комнатной температуры бросили ком снега, содержащий некоторое количество воды, после чего установилась некоторая положительная температура. | 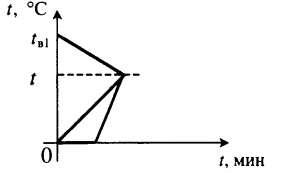 Уравнение теплового баланса: Уравнение теплового баланса:Q 1 + Q 2 + Q 3 = 0 c в m в 1 ( t − t в 1 ) + c в m в 2 ( t − 0 ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||||||||
| Для получения некоторой положительной температуры воды используют горячую воду и лед, имеющий отрицательную температуру. | 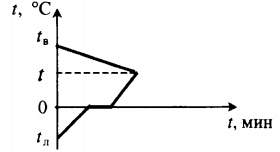 Уравнение теплового баланса: Уравнение теплового баланса:c в m в ( t − t в ) + c л m л ( 0 − t л ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||||||||
| В воду комнатной температуры бросают раскаленное твердое тело, в результате часть воды испаряется. | 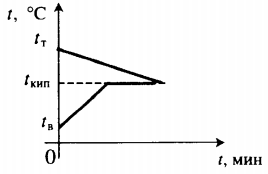 Уравнение теплового баланса: Уравнение теплового баланса:c т m т ( 100 − t т ) + c в m в ( 100 − t в ) + r m п = 0 | ||||||||||||||
| Воду комнатной температуры нагревают до кипения, вводя пар при t = 100 о С. | 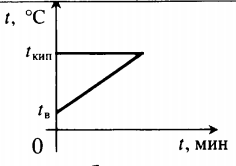 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m в ( 100 − t в ) = 0 | ||||||||||||||
| Лед, имеющий температуру плавления, нагревают до положительной температуры, вводя пар при t = 100 о С. | 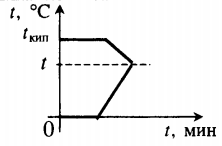 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m п ( t − t к и п ) + λ m л + c в m л ( t − t п л ) = 0 Пример №2. В кастрюлю, где находится вода объемом 2 л при температуре 25 о С, долили 3 л кипятка. Какая температура воды установилась? Количество теплоты, отданное кипятком, равно количеству теплоты, принятому более прохладной водой. Поэтому: c m 1 ( t − t 0 ) = − c m 2 ( t − t к и п ) m 1 ( t − t 0 ) = − m 2 ( t − t к и п ) m 1 t + m 2 t = m 1 t 0 + m 2 t к и п ( m 1 + m 2 ) t = m 1 t 0 + m 2 t к и п t = m 1 t 0 + m 2 t к и п m 1 + m 2 . . t = 2 · 25 + 3 · 100 2 + 3 . . = 350 5 . . = 70 ( ° C ) Взаимные превращения механической и внутренней энергииЕсли в тексте задачи указан процент одного вида энергии, перешедший в другой, то он указывается в виде десятичной дроби перед этой энергией, которой тело обладало вначале. Частные случаи закона сохранения энергии
|







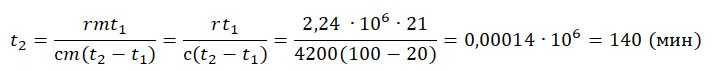
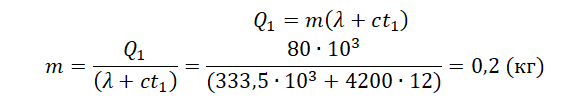
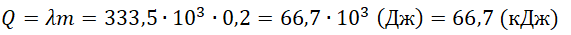
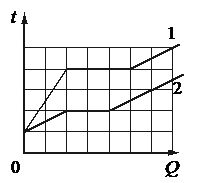 На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
 ((рис. 12.1, а) выражает количество теплоты, полученное веществом при нагревании в твердом состоянии (от
((рис. 12.1, а) выражает количество теплоты, полученное веществом при нагревании в твердом состоянии (от  до
до  ), отрезок
), отрезок  — при плавлении и отрезок
— при плавлении и отрезок  — при нагревании в жидком состоянии. Отрезок
— при нагревании в жидком состоянии. Отрезок  (рис. 12.1,6) выражает количество теплоты, отданной веществом при охлаждении в жидком состоянии (от
(рис. 12.1,6) выражает количество теплоты, отданной веществом при охлаждении в жидком состоянии (от  ), отрезок
), отрезок  — при отвердевании и отрезок
— при отвердевании и отрезок  — при охлаждении в твердом состоянии. Опыт показывает, что плавление и отвердевание определенного вещества происходит при одинаковой температуре, не изменяющейся, пока совместно существуют твердая и жидкая фазы вещества. Эта температура называется температурой плавления. Отметим, что при плавлении и отвердевании вещества всегда существует резкая граница между твердой и жидкой фазами.
— при охлаждении в твердом состоянии. Опыт показывает, что плавление и отвердевание определенного вещества происходит при одинаковой температуре, не изменяющейся, пока совместно существуют твердая и жидкая фазы вещества. Эта температура называется температурой плавления. Отметим, что при плавлении и отвердевании вещества всегда существует резкая граница между твердой и жидкой фазами. , имеем
, имеем
 . Величина
. Величина 


 , тоже зависит от давления. При больших внешних давлениях вещество в процессе расширения должно совершать заметную работу против сил внешнего давления. Поэтому у тех веществ, которые при плавлении расширяются, удельная теплота плавления при увеличении внешнего давления возрастает, а у льда, висмута и галлия — убывает. Например, если при нормальном давлении для ртути
, тоже зависит от давления. При больших внешних давлениях вещество в процессе расширения должно совершать заметную работу против сил внешнего давления. Поэтому у тех веществ, которые при плавлении расширяются, удельная теплота плавления при увеличении внешнего давления возрастает, а у льда, висмута и галлия — убывает. Например, если при нормальном давлении для ртути  = 11,5 . 10 3 Дж/кг и для висмута
= 11,5 . 10 3 Дж/кг и для висмута  =54,5 . 10 3 Дж/кг, то при давлении 12 . 10 3 атм
=54,5 . 10 3 Дж/кг, то при давлении 12 . 10 3 атм  , в котором находится некоторое количество воды
, в котором находится некоторое количество воды  при температуре
при температуре  . Чтобы определить
. Чтобы определить  льда, бросим в калориметр кусочек тающего льда массой
льда, бросим в калориметр кусочек тающего льда массой  при температуре
при температуре  . Допустим, что, когда весь лед растаял, в калориметре установилась температура
. Допустим, что, когда весь лед растаял, в калориметре установилась температура  . Тогда можно считать, что лед получал теплоту, когда таял, а образовавшаяся из него вода — когда нагревалась до температуры
. Тогда можно считать, что лед получал теплоту, когда таял, а образовавшаяся из него вода — когда нагревалась до температуры 

 имеем
имеем
 =3,3 . 10 5 Дж/кг.
=3,3 . 10 5 Дж/кг.


