Тепловой баланс и адиабатическая температура горения
Тепловой баланс процессов горения основан на определении тепла, поглощѐнного продуктами горения.
Уравнение теплового баланса имеет вид:
где Qпг -теплота, поглощенная продуктами горения,
Qр — теплота химической реакции,
Qисх — теплота, поступившая из внешних источников,
Qпот — тепловые потери.
Тепловой баланс процесса горения складывается из следующих составляющих:
Основная статья приходной части теплового баланса – это теплота горения вещества Qгор.
Вторая составляющая – Qисх – теплота исходных веществ, т.е. теплосодержание горючего и окислителя. Эта величина зависит от агрегатного состояния и химической природы горючего. Например, для метана Qисх
QПГ – теплота, уходящая с продуктами горения. Так как продукты горения создают конвективный поток над пламенем, то QПГ называют также теплотой конвекции или конвективной теплотой. QПГ колеблется в пределах 35 – 95 % от Qгор.
Анализ этого уравнения показывает, что практически единственным источником тепловой энергии любого процесса горения, а значит, и любого пожара, является тепловой эффект химических реакций окисления в пламени, т.е. теплота горения, которая относится к важнейшим характеристикам пожарной опасности веществ и материалов [2, с 26].
Одним из важных параметров термодинамического расчета является адиабатическая температура процесса. Адиабатическая температура связана с реальными параметрами течения взрыва, горения [5, с. 11].
Адиабатическая температура горения — есть средняя температура продуктов стехиометрического полного горения, получаемая из уравнения теплового баланса горючей системы при условии, что вся энергия исходных компонентов преобразована а тепловую энергию продуктов горения.
Существуют различные алгоритмы расчета адиабатической температуры горения, взрыва, но в методологическом плане проблема разработана не полностью. Это обусловлено тем, что проверить расчеты экспериментально не представляется возможным – адиабатический процесс не реализован на практике. Следует выделить основные положения методики расчетов. Основы расчетов базируются на первом законе термодинамике и следствиях из него.
Существует несколько равнозначных определений первого закона термодинамики и одно их них формулируется следующим образом – теплота процесса расходуется на увеличение внутренней энергии и совершении работы системой:
Для расчета адиабатической температуры применяют уравнения Кирхгофа для изобарного и изохорного процесса:
Здесь ΔН, ΔU – изменение энтальпии, внутренней энергии, Дж/моль;
Ср, Сv – соответственно изобарная и изохорная теплоемкости, Дж/моль. град;
v – стехиометрические коэффициенты формальной схемы процесса,
T – температура, К.
Процедура оценки адиабатической температуры горения, взрыва состоит из следующих этапов.
1. Составление формальной схемы процесса.
2. Расчет энтальпии химической реакции
3. Составление системы уравнений с учетом константы равновесия Kp.
4. Расчет адиабатической температуры горения, взрыва:
Для удобства расчетов температуры величины энтальпии и внутренней энергии внесены под знак модуля. Таким образом, необходимо правильно записать формальную схему процесса – указать все продукты реакции и исходные вещества. Более того, необходимо указать, как меняется теплоемкость, стехиометрический состав смеси в зависимости от температуры процесса, фазовые переходы. В расчетах энтальпии или внутренней энергии необходимо учитывать алгебраические суммы по теплоемкостям продуктов реакции и исходных веществ.
ТЕПЛОВОЙ БАЛАНС ПРОЦЕССА ГОРЕНИЯ. РАСЧЁТ ТЕМПЕРАТУРЫ ГОРЕНИЯ
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2000 К.
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273 К и при отсутствии потерь в окружающую среду.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т. к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т. д.
Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для жидкостей и твёрдых материалов. Однако в ряде случаев теория позволяет с достаточной для практики точностью вычислить температуру горения веществ, основываясь только на знании их химической формулы, состава исходной горючей смеси и продуктов горения.
В общем случае для вычислений используется следующая зависимость (приближённая, так как 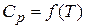
где QПГ — энтальпия продуктов горения;
VПГ — количество продуктов горения, м 3 /кг;
Ср — средняя объемная теплоемкость смеси продуктов горения в интервале температур от Т0 до ТГ, кДж/(м 3 ×К);
ТГ — температура горения, К.
Энтальпия продуктов горения определяется из уравнения теплового баланса:
где Qисп – теплота испарения;
Qпот – потери тепла за счёт излучения, недожога и диссоциации продуктов горения.
В зависимости от рода учитываемых потерь теплоты в зоне горения (на излучение, недожог, диссоциацию продуктов горения) вычисляется та или иная температура.
При кинетическом горении газопаровоздушных смесей потери теплоты из зоны горения пренебрежимо малы, поэтому для этих смесей действительная температура горения близка к адиабатической, которую и используют в пожарно-технических расчетах.
Среднюю теплоемкость смеси продуктов горения определить очень сложно. Ориентировочно энтальпия смеси продуктов горения может быть выражена как сумма энтальпий ее компонентов:
где (VПГ)i — количество i-го компонента продуктов горения;
Ср — средняя объемная теплоемкость i-го компонента при ТГ и постоянном давлении;
При расчётах температуры горения пользуются величиной Qн (низшей теплотой сгорания), так как при температуре горения вода находится в газообразном состоянии.
Значения низшей теплоты сгорания вещества (тепловой эффект химической реакции) приводятся в справочной литературе, а также могут быть рассчитаны из следствия закона Гесса:

где 
ni – количество молей i-го вещества.
Согласно следствию из закона Гесса, тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. Напомним из курса химии, что теплота образования простых веществ (кислорода, азота и др.) равна нулю.
Например, рассчитаем теплоту сгорания (тепловой эффект) этана:
Низшая теплота сгорания согласно следствию из закона Гесса:

Подставляя значения теплоты образования СО2, Н2О и С2Н6 из справочных данных, определяют низшую теплоту сгорания этана.
При сгорании смеси индивидуальных веществ сначала определяют теплоту сгорания каждого компонента, а затем их суммируют с учётом процентного содержания каждого горючего вещества в смеси, кДж/кг
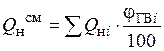
Если горючее является сложным веществом и его элементный состав задан в массовых процентах, то для расчёта теплоты сгорания используют формулу Менделеева:

где С, Н, О, N, S – процентное содержание данного элемента в горючем
W – содержание влаги в веществе, масс. %.
Для расчёта температуры горения составим уравнение теплового баланса, считая, что выделившееся в результате сгорания тепло нагревает продукты горения от начальной температуры Т0 до температуры ТГ.

где h — коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания);


Расчёт объёма продуктов горения (СО2, Н2О, SO2, N2) проводится по следующим формулам 17-20.
Из уравнения теплового баланса

Трудность в определении температуры горения по этой формуле заключается в том, что теплоёмкость газа зависит от температуры. Так как газы нагреваются от температуры Т0 до температуры ТГ, то в формулу (37) необходимо подставить среднее значение теплоёмкости именно в этом интервале температур. Но температура горения нам неизвестна, и мы хотим её найти. В этом случае можно поступить следующим образом. Среднее значение температуры горения большинства веществ в воздухе составляет примерно 1500 К. Поэтому с небольшой погрешностью в определении ТГ для расчётов можно взять среднее значение теплоёмкости в интервале температур от 273 до 1500 К. Эти значения для основных продуктов горения приведены в табл. 19.
Средние значения теплоёмкостей основных продуктов горения в интервале температур 273-1500 К
| Вещество | Удельная теплоёмкость,  | |
| кДж/(м 3 ×К) | кДж/(моль×К) | |
| Диоксид углерода | 2,27 | 5,08×10 -2 |
| Диоксид серы | 2,28 | 5,11×10 -2 |
| Вода (пар) | 1,78 | 3,99×10 -2 |
| Азот | 1,42 | 3,18×10 -2 |
| Воздух | 1,44 | 3,23×10 -2 |
Средние значения теплоёмкостей некоторых газообразных веществ в различных температурных интервалах приведены также в приложении 8.
Рассмотрим примеры решения задач на расчёт температуры горения.
Тепловой баланс процессов горения
1333. Тепловой баланс процессов горения
3.1 Расчёт теплоты сгорания
При тепловых расчётах определят, как правило, низшую теплоту сгорания вещества. Низшая теплота рассчитывается как количество тепла, выделяющегося при сгорании единицы количества вещества или единицы массы при газообразном состоянии воды как продукта реакции. В первом случае речь идёт о мольной теплоте сгорания, во втором – об удельной теплоте сгорания. Связь мольной и удельной теплоты сгорания даётся формулой

где 

Формулы, для расчёта низшей теплоты сгорания приводятся в таблице 3-1.
Табл. 3-1 Расчётные формулы для определения низшей теплоты сгорания.


Формула (3.2) представляет следствие из закона Гесса. Согласно этому следствию тепловой эффект реакции будет равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. Здесь 


Формула (3.3) носит название формулы . Она применяется для расчёта теплот сгорания сложных веществ, если известен их состав в массовых процентах. Здесь C, H,S, N,O – содержание соответствующего элемента в массовых процентах, W — влажность горючего.
Теплоту сгорания газовоздушных смесей определяют по формуле

где Qн – низшая теплота сгорания газообразного горючего, ц – содержание горючего в смеси (в объёмных %). В случае нескольких горючих газов производится суммирование по всем горючим

Пример 1. Рассчитать мольную и удельную теплоту сгорания уксусной кислоты.
Горючее – индивидуальное вещество. Для расчёта мольной теплоты сгорания воспользуемся следствием из закона Гесса (3.4). Запишем уравнение реакции
CH3CO2H + 2(O2 +3,76N2) = 2CO2 + 2H2O + 2·3,76N2.
Кислород и азот – простые вещества и их стандартные теплоты образования равны нулю. теплоты образования остальных участников реакции возьмём из справочных данных: ДfH0(CH3CO2H) = -485,6 кДж/моль, ДfH0(CO2) = -396,9 кДж/моль, ДfH0(H2O) = -242,2 кДж/моль. Теплота сгорания уксусной кислоты будет равна 

Пример 2. Рассчитать низшую теплоту сгорания органического вещества состава С – 62%, H – 8%, O – 28%, S – 2%.
Горючее – сложное вещество, для расчёта теплоты сгорания воспользуемся формулой Менделеева (3.3). 
Пример 3. Рассчитать теплоту сгорания газовой смеси состава (в об. %) CH4 – 40%, C4H10 – 20%,O2 – 15%, H2S – 15%, NH3 – 10%, CO2 – 10%.
Определим низшую теплоту сгорания каждого горючего газа в смеси CH4, C4H10, H2S и NH3 используя следствие из закона Гесса (3.4). Теплоты образования горючих продуктов реакции возьмём из справочных таблиц. Поскольку теплота образования азота равна нулю (простое вещество) то для простоты не будем включать азот воздуха в уравнение реакции.
Табл. 3-2. Теплоты сгорания компонентов газовой смеси.
Теплота сгорания, кДж/моль
CH4 +2O2 = CO2 + 2H2O
C4H10 + 6,5O2 = 4CO2 + 5H2O
H2S +1,5O2 = H2O + SO2
NH3 +0,75O2 = 0,5N2 + 1,5H2O
По формуле (3.6) определим теплоту сгорания газовой смеси.


Пример 4: Рассчитать теплоту сгорания 1 м3 стехиометрической смеси гексана с воздухом.
Стехиометрический состав смеси находится из уравнения реакции
C6H14 + 9,5(O2 + 3,76N2) = 6CO2 + 7H2O + 9,5·3,76N2.
Весь объём участников реакции, т. е. сумму стехиометрических коэффициентов, примем за 100%. А количество горючего (1 моль) будет соответствовать стехиометрической концентрации 



3.2 Тепловой баланс и расчёт температуры горения
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2000 К
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273 К и при отсутствии потерь в окружающую среду.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т. к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т. д.
Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для жидкостей и твёрдых материалов. Однако в ряде случаев теория позволяет с достаточной для практики точностью вычислить температуру горения веществ, основываясь только на знании их химической формулы, состава исходной горючей смеси и продуктов горения.
В общем случае используется зависимость вида

где Qпг – теплота, перешедшая в продукты горения (энтальпия или теплосодержание продуктов горения), Vпг – объём продуктов горения, Cp – удельная теплоёмкость продуктов горения при постоянном давлении, Tг – температура горения. Но напрямую пользоваться формулой (3.7) нельзя, т. к. теплоёмкость есть функция температуры (
Энтальпия продуктов горения определяется из уравнения теплового баланса.


где Qпг – энтальпия продуктов горения, Qисп – теплота испарения, Qпот – тепловые потери за счёт излучения (Qи), недожога (Qнед) и диссоциации (Qдисс) продуктов горения. В зависимости от рода учитываемых потерь теплоты в зоне горения (на излучение, недожог, диссоциацию продуктов горения) вычисляется та или иная температура.
Энтальпия продуктов реакции может быть представлена как сумма энтальпий всех продуктов реакции.

где Vпг. i – объём i-того продукта горения, Cp, i – его изобарная теплоёмкость, Tг – температура горения.
При кинетическом горении газопаровоздушных смесей потери теплоты из зоны горения пренебрежимо малы, поэтому для этих смесей действительная температура горения близка к адиабатической, которую и используют в пожарно-технических расчетах.
Для расчёта температуры горения составим уравнение теплового баланса, учитывая, что выделяющееся тепло нагревает продукты горения от начальной температуры T0 до температуры Tг.

где з — коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания). из уравнения теплового баланса следует

Трудность в определении температуры горения по этой формуле заключается в том, что теплоёмкость газа зависит от температуры. Так как газы нагреваются от температуры T0 до температуры Тг, то в формулу (3.12) необходимо подставить среднее значение теплоёмкости именно в этом интервале температур. Но температура горения нам неизвестна и мы хотим её найти. В этом случае можно поступить следующим образом. Среднее значение температуры горения большинства веществ в воздухе составляет примерно 1500 К. Поэтому с небольшой погрешностью в определении Тг для расчётов можно взять среднее значение теплоёмкости в интервале температур 273–1500 К.
3.3 Расчёт температуры горения методом последовательных приближений
Для более точных расчётов температуры горения используют метод последовательных приближений, по известной зависимости теплосодержания (энтальпии) продуктов горения от температуры. Если теплосодержание продуктов горения при Т=273 К принять равным нулю, то полное теплосодержание продуктов горения при Тг будет равно количеству теплоты, выделившейся в результате химической реакции. Учётом теплопотерь

где Hпг, i – энтальпия i – того продукта горения. Задача состоит в том, чтобы найти температуру, при которой будет справедливо это равенство. Энтальпии продуктов горения приведены в справочных таблицах.
Алгоритм расчёта приведён в табл. 3-3.
Табл. 3-3. Алгоритм расчёта температуры горения.
Объём и состав продуктов горения
Низшая теплота сгорания или количество тепла, пошедшего на нагрев продуктов горения (при наличии теплопотерь)
Среднее значение энтальпии продуктов горения

Температура горения T1 по средней энтальпии с помощью справочным таблицам, ориентируясь на азот (наибольшее содержание в продуктах горения)
Теплосодержание продуктов горения с температурой Т1

Теплосодержание продуктов горения с температурой Т2 Если Q1>Qпг то T2 T1
Расчёт ведётся до получения неравенства 

Температура взрыва, протекающего в изохорно-адиабатическом режиме (при постоянном объёме) рассчитывается по уравнению теплового баланса (3.13) и алгоритму табл. 3-3, В отличие от горения вместо энтальпии продуктов горения используется их внутренняя энергия (также находимая по справочным таблицам)

где Cv – теплоёмкость при постоянном объёме кДж/моль·К, кДж/кг·К.
Пример 5: Рассчитать адиабатическую температуру горения стехиометрической смеси этилового спирта (C2H6O) с воздухом.
Так как горючее – индивидуальное вещество для определения состава и объёма продуктов горения запишем уравнение реакции.
C2H6O + 3(O2 + 3,76N2) = 2CO2 + 3H2O + 3·3,76N2.
Объёмы продуктов реакции 










Пример 6: Рассчитать адиабатическую температуру горения органического вещества состава С – 60%, H – 7%, O – 25%, W – 8%.
Горючее – сложное вещество, состав продуктов горения определяем по формулам §2.2. 










Пример 7: Рассчитать действительную температуру горения фенола (C6H6O, 
Так как горючее – индивидуальное вещество составим уравнение реакции горения фенола.
C6H6O + 7(O2 + 3,76N2) = 6CO2 + 3H2O + 7·3,76N2
Определим объём и состав продуктов горения фенола. 






Пример 8: Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава.
Расчет едём по алгоритму, изложенному в табл. 3-3. с учётом формулы (3.17). Составим уравнение реакции взрыва и найдём объём и состав продуктов горения
CH4 + 2(O2 + 3,76N2) = CO2 + 2H2O + 2·3,76N2.
Объёмы продуктов горения 










3.4 Задачи для самостоятельного решения
1. В каком случае в условиях пожара при горении бутана выделится больше тепла: при полном горении или неполном, протекающем по реакции С4Н10 + 4,5О2→4СО+5Н2О. Ответ необходимо подтвердить расчётом с использованием закона Гесса.
2. Вычислить теплоту образования ацетилена (C2H2) из элементов, если его теплота горения равна 1411, 2 кДж/моль.
3. Определить теплоту сгорания 12 кг бензола (C6H6), если теплота его образования составляет -82,9 кДж/моль/
4. Определить теплоту образования пимелиновой кислоты (С7Н12О4), если теплота её сгорания составляет 3453, 5 кДж/моль.
5. Определить теплоту сгорания салициловой кислоты (C7H6O3), если теплота её образования составляет -589,5 кДж/моль.
6. Вычислить теплоту образования метана, если при сжигании 10 г его в стандартных условиях выделяется 556,462 кДж тепла.
7. Определить теплоту сгорания бензилового спирта (С7Н8О), если теплота его образования составляет -875, 4 кДж/моль.
8. При образовании октана (C8H18) из элементов выделяется 208,45 кДж/моль тепла. Рассчитать его теплоту горения.
9. Теплота образования ацетона (C3H6O) составляет -248,28 кДж/моль. Определить его теплоту горения и количество тепла, которое выделится при сгорании 30 г. вещества.
10. Рассчитать теплоту сгорания сульфапиридазина (С11Н12О3N4S) без учёта потерь на испарение влаги.
11. Определить теплоту сгорания сульфофенилгидразина (С6Н8О3N2S) с учётом потерь на испарение воды. Содержание влаги в веществе 20 %.
12. Определить теплоту сгорания 4, 4-диаминодифенилсульфона (С12Н12О2N2S) без учёта потерь на испарение влаги по формуле .
13. Определить теплоты сгорания 4, 6-диметилгексагидро-1, 3, 5-триазинтиона-2 (С5Н9N3S) по формуле .
14. Определить теплоту сгорания по формуле диаминомезитилен-6-сульфокислоты (С9Н14О3N2S), если содержание влаги в веществе 35 %.
15. Определить низшую теплоту горения древесины состава: С – 41,5%; Н – 6%; О – 43 %; N – 2%; W– 7,5%.
16. Определить теоретическую температуру горения ацетона (C3H6O) с использованием средних значений теплоёмкостей.
17. Определить теоретическую температуру горения пентана (C5H12) с использованием средних значений теплоёмкостей.
18. Определить теоретическую температуру горения октана (C8H18) и использованием средних значений теплоёмкостей.
19. Определить теоретическую температуру горения бензола (C6H6) с использованием средних значений теплоёмкостей.
20. Методом последовательных приближений рассчитать адиабатическую температуру горения пропанола (C3H8O).
21. Рассчитайте температуру горения для стехиометрической смеси горючего вещества с воздухом (табл. 3-4).
http://mydocx.ru/4-90447.html
http://pandia.ru/text/81/493/91060.php











