Термодинамика замкнутых систем
Вы будете перенаправлены на Автор24
Термодинамическими системами, зачастую, будут называться не любые, а исключительно макроскопические системы, пребывающие в термодинамическом равновесии. Аналогичным образом, термодинамическими параметрами будут считаться такие параметры, которые могут характеризовать систему в термодинамическом равновесии.
Рисунок 1. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
В свою очередь, внутренние параметры системы будут подразделяться на определенные разновидности:
- интенсивные (не зависимые от массы и количества частиц в системе), способны принимать в каждой ее точке определенные значения;
- экстенсивные (пропорциональны массе или числу частиц в системе), еще называются аддитивными и характеризуют систему в формате целого.
Разновидности систем в термодинамике
Рисунок 2. Типы термодинамических систем. Автор24 — интернет-биржа студенческих работ
Системы в термодинамике подвержены классификации следующим образом:
- замкнутая (изолированная) система (система с отсутствующим энергообменом с внешними телами, также они не обмениваются веществом и информацией);
- закрытая система (здесь наблюдается исключительно энергетический обмен);
- адиабатно изолированная система (наблюдается наличие энергообмена исключительно в формате теплоты);
- открытая система (здесь уже присутствует три вида обмена: информацией, веществом и энергией).
Готовые работы на аналогичную тему
На базе первого начала термодинамики, внутренняя энергия системы представляет однозначную функцию ее состояния, а изменение осуществляется исключительно в условиях воздействия внешних факторов. Первое начало можно сформулировать в таких видах:
- появление и ликвидация энергии становятся невозможными;
- любая форма движения в состоянии и обязана становиться любой иной формой движения;
- внутренняя энергия представляет собой однозначную форму состояния;
- исключается возможность вечного двигателя первого рода;
- бесконечно малое изменение внутренней энергии считается полным дифференциалом;
- исключается зависимость суммы количества теплоты и работы от пути процесса.
Первый закон термодинамики постулированием закона сохранения энергии для термодинамической системы не может указывать направление выполняемых в природе процессов, которое устанавливает второе начало термодинамики.
Второй закон термодинамики для замкнутых систем
Рисунок 3. Второй закон термодинамики. Автор24 — интернет-биржа студенческих работ
При изучении второго закона термодинамики, для лучшего понимания замкнутых систем, стоит рассматривать такой вид систем на примерах. Так, можно рассмотреть замкнутую систему, состоящую из двух контактирующих между собой тел с различными температурами. Тепло при этом начнет передаваться от тела с большей температурой к телу, обладающему меньшей.
Подобный принцип теплового распределения будет продолжительным до того момента, пока температуры этих двух тел не выровняются. В итоге такого процесса, будет наблюдаться передача от одного тела к другому конкретного количества тепла, энтропия при этом (у первого) снизится на величину, более меньшую, сравнительно с увеличением у второго тела (не принимающего теплоту).
Вследствие подобного самопроизвольного процесса, энтропия системы из двух тел окажется большей, чем сумма энтропий этих тел до начала процесса. Другими словами, самопроизвольный процесс теплопередачи от тела с высокой температурой телу с более низкой спровоцировал увеличение энтропии системы из данных двух тел.
Это создает еще одну формулировку второго закона термодинамики: в условиях прохождения в изолированной системе самопроизвольных процессов, наблюдается возрастание энтропии. Другими словами, энтропия подобной системы стремится к своему максимуму, поскольку самопроизвольные процессы теплопередачи всегда будут происходить при перепадах температур.
Суть термодинамики замкнутых систем
В природе не существует термодинамических систем замкнутого типа. Термодинамические процессы обязательно будут сопровождаться фазовыми переходами вещества, по той причине, что даже у гелия – (наиболее инертного из газов) присутствует в нормальных условиях 0,08196% молекул, пребывающих в состоянии динамического равновесия с атомами. То есть коэффициент конденсации не равен единичному значению.
Неравновесность системы определяется за счет градиента частоты ее осцилляторов, сама система стремится к равновесию (равенство частот). Распространение энергии происходит исключительно от большей частоты к меньшей. Обратный процесс допускается через третье тело, которое испытывает в этот момент фазовый переход.
Теплопроводность является энергопроводностью, когда осцилляторы, обладающие большей частотой, производят передачу ее осцилляторам с меньшей, что происходит за счет конвективного перемешивания.
Несмотря на равенство такого пути по своей протяженности половине расстояния до Луны, он оказывается при этом совершенно не затратным. Это объясняется тем фактом, что в объеме глобулы осциллятор оказывается единственным телом, перемещающимся в истинном вакууме. Наряду с тем, перемещение глобулы в отношении соседних сопровождается определенным трением и по этой причине представляет собой процесс, энергетически затратный.
Коэффициент энергопередачи (теплопередачи) в естественных условиях, например, при конвекции, у стенки будет пропорциональным частоте осцилляторов пристенного слоя, ее шероховатости, критическому расстоянию непосредственного взаимодействия осцилляторов и также обратно пропорциональным объему глобул газа вдали от стенки.
Таким образом, механизм возникновения конвективного тока газа будет логично представлять в таком формате: допустим, что одна глобула на дне получит приращение частоты и энергии. Ее объем при этом будет возрастающим, плотность станет меньше, и тогда произойдет ее всплытие с заталкиванием соседствующих глобул (на ее месте при этом окажется другая глобула, которая далее направится вверх ровно следом за первой). Таким способом появляется элементарный восходящий конвекционный ток.
Первый закон термодинамики
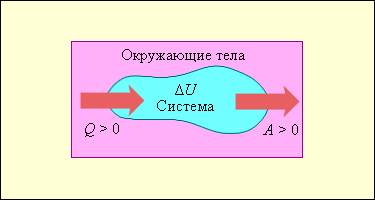
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
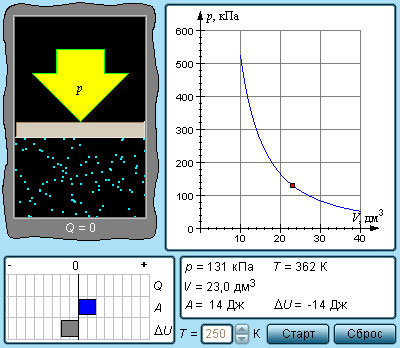
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
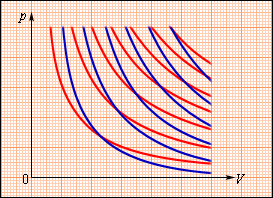
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
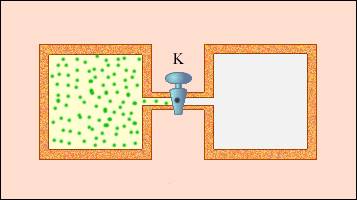
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Действительно, если к телу не поступает теплота (Q — 0), то работа A’, согласно уравнению 
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам .
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
http://zaochnik.com/spravochnik/fizika/termodinamika/pervyj-zakon-termodinamiki/
http://www.calc.ru/Perviy-Zakon-Termodinamiki.html