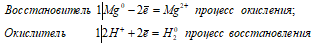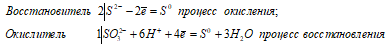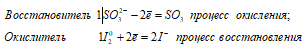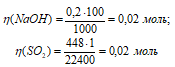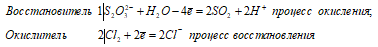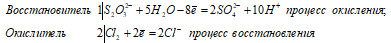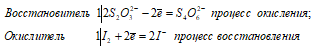Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
Реакция взаимодействия тиосульфата натрия и иода
2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Реакция взаимодействия тиосульфата натрия и иода с образованием тетратионата натрия и иодида натрия. Тиосульфат натрия — разбавленный раствор.
Реакцию широко используют в аналитической химии для иодометрического определение восстановителей и окислителей.
Особенности
проведения эксперимента
в химическом кружке
для третьеклассников
Окончание. Начало см. в № 8/2004
Химический эксперимент
Покажем на примере, как следует учитывать особенности проведения химического эксперимента.
Взаимодействие раствора тиосульфата натрия с йодом
Оборудование. Мыло в мыльнице (2 шт.), тазик небольших размеров, наполненный теплой водой (на случай отсутствия в классе водопровода), полотенце (2 шт.), аптечка, в которой содержатся: бинт, пластырь, вата (небольшой рулон), 5%-я спиртовая йодная настойка, перманганат калия (крист., 5 г), водный или спиртовой раствор бриллиантового зеленого (зеленка), водные растворы: 3%-го пероксида водорода, 10%-го нашатырного спирта, 3%-й питьевой соды, 3%-й лимонной кислоты, 5%-го тиосульфата натрия.
Раздаточный материал. Полиэтиленовые пакеты и подносы* (по одному на парту, на каждом подносе по два лоскутка хлопчатобумажной ткани и по два комочка ваты).
Последовательность действий при подготовке ученического эксперимента:








Демонстрационный эксперимент





Руководитель организует деятельность членов кружка.








После проведения опыта руководитель занятия просит объяснить наблюдаемое явление. Нередко учащиеся выдвигают версию о том, что пятно просто отстиралось. Руководитель кружка обращает внимание учащихся на то, что вата, с помощью которой удалось избавиться от пятна, не окрасилась, т. е. йод удалился не механически. Затем он объясняет, что вата была пропитана раствором бесцветного вещества, при попадании этого вещества на йодное пятно произошла химическая реакция между йодом и веществом. Признаком химической реакции стало изменение цвета (обесцвечивание раствора). После этого руководитель задает учащимся вопросы.
1. Нужно ли вещи специально пачкать йодом? Почему?
2. Всегда ли под рукой может быть такая чудо-жидкость?
3. Какое название можно дать этой чудо-жидкости?
* Вместо подноса можно использовать пластиковые одноразовые тарелки.
Инструкция для проведения
домашнего эксперимента
Члены кружка получают инструкцию в печатном варианте.
Домашний опыт: наблюдение за изменением
окраски вещества в кислой и содовой среде
Подготовка к исследованию
Попроси у взрослых:
· химическую скатерть (клеенку или полиэтиленовый пакет);
· лимонную кислоту (1/2 чайной ложки или 1/4 лимона);
· пищевую соду (1/2 чайной ложки);
· варенье (смородиновое, вишневое, малиновое) или ягодный сок, компот с темной окраской
(3 чайные ложки);
· чистые стаканы (6 шт.): 2 – для лимонной воды, 2 – для содовой воды, 2 – для раствора окрашенного вещества (размер стаканов не имеет значения);
· чайные ложки (3 шт.): одну – для размешивания в воде лимонной кислоты или лимонного сока, другую – для размешивания соды, третью – для размешивания варенья;
· теплую (не горячую) кипяченую воду;
· тряпочку, чтобы убрать за собой рабочее место.
Для твердых веществ предварительно сделай кузовок из бумаги, напиши название вещества на боковой части кузовка, а затем уже высыпь в кузовок вещество. Варенье не держи в ложках, положи его на блюдечко. Сок или компот налей в емкость. На блюдцах с вареньем и стаканчиках с соком или компотом сделай этикетки (бумага, скотч) с указанием того, что находится в блюдце или стакане.
Опыты можешь проводить за кухонным или письменным столом. Будь аккуратен!
Рецепт приготовления окрашенного вещества



Рецепт приготовления лимонной воды




Рецепт приготовления содовой воды




Когда будешь делать опыты, не перепутай стаканы с лимонной и содовой водой. Поставь их на листы бумаг, на которых напиши: «Лимонная вода» и «Содовая вода».
Проведение опыта: изменение окраски
вещества-определителя в лимонной воде





Проведение опыта: изменение окраски
вещества-определителя в содовой воде






Наблюдения за изменением окраски
вещества-определителя в кислой и щелочной (содовой) средах
| Вещество- определитель | Собственная окраска | Окраска в лимонной воде | Окраска в содовой воде |
|---|---|---|---|
| Смородиновый сок | . |  | . |
| . | . | . | . |
Индикатор – это вещество-определитель.
Химический индикатор определяет кислую и щелочную (содовую) среду жидкостей.
Отметь свои наблюдения в строках таблицы.
Что тебе удалось сделать сразу, а над чем пришлось потрудиться?
Напиши об этом: .
Также ученикам предлагается самостоятельно определить окраску индикаторов в яблочном соке и мыльной воде.
Запись химического процесса
Поскольку ученики еще не знакомы с химической символикой, формулами, уравнениями реакций, для записи химического опыта они используют специальные символы и знаки. Газообразное вещество можно обозначить в виде облачка, жидкость – кругом или овалом, твердое вещество – квадратом или ромбом, как показано на схемах 1 и 2.
Безусловно, подготовка к регулярному проведению химического эксперимента на занятиях химического кружка для школьников младшего возраста занимает много времени. Но эти затраты оправдываются неугасающим интересом детей к кружковым занятиям и стабильностью состава кружка. Наш опыт показывает, что, несмотря на имеющиеся в литературе сведения о неустойчивости интересов школьников младшего возраста и довольно быстрой потере интереса к содержанию деятельности кружков естественно-научного направления, основной состав членов кружка вполне возможно сохранить в течение года и более.
http://chemiday.com/reaction/3-1-0-997
http://him.1sept.ru/article.php?ID=200401102