Угольная кислота и ее соли
Угольная кислота и её соли. Значение и применение карбонатов. Переход карбонатов в гидрокарбонаты и обратно. Распознавание карбонат-иона.
H 2 CO 3
Угольная кислота слабая, существует только в водном растворе: CO 2 + H 2 O « H 2 CO 3
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H 2 CO 3 « H + + HCO 3 —
HCO 3 — « H + + CO 3 2-
Характерны все свойства кислот.
Угольная кислота образует соли двух типов:
средние соли — карбонаты (СO 3 2- ) Na 2СO 3, (NH 4) 2CO 3
кислые соли — бикарбонаты, гидрокарбонаты (HCO 3 — ) NaHCO 3 , Ca(HCO 3) 2
Карбонаты в природе
CaCO 3 карбонат кальция (мел, мрамор, известняк)
Na 2CO 3 – сода, кальцинированная сода
K 2CO 3(поташ, в золе растений)
Na 2CO 3 x 10H 2O – кристаллическая сода
Физические свойства карбонатов:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO 3 t˚C → Na 2 CO 3 + H 2 O + CO 2 ↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO 3 t˚C → CaO+ CO 2 ↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Превращение гидрокарбонатов в карбонаты
Са(HCO 3 ) 2 + Са(OH) 2 = СаCO 3 +H 2 O
Me(HCO 3 ) n t˚C = MeCO 3 ↓+H 2 O+CO 2 ↑
Превращение карбонатов в гидрокарбонаты
СаCO 3 +H 2 O+CO 2 = Са(HCO 3 ) 2
Специфические свойства солей угольной кислоты:
Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑
Задания для самостоятельной работы:
1. Осуществите превращения
2) Ca → CaC 2→ Ca(OH) 2→ CaCO 3→ CO 2→ C
4) CaCO 3 → CO 2 → NaHCO 3 → Na 2CO 3
2. Решите задачу
Вычислите объём углекислого газа, который выделится при обжиге карбоната кальция массой 150 г (н.у.)
Угольная кислота и её соли — получение и применение
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
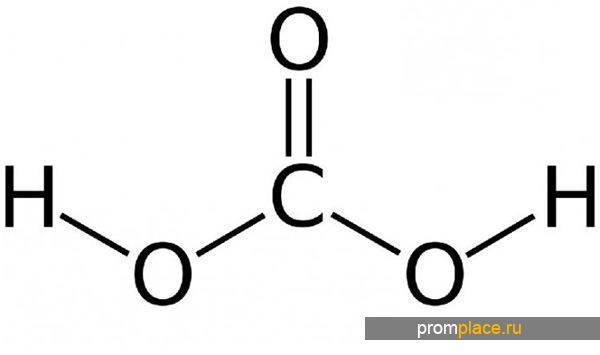
Структурная формула
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.
Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота — одноосновная.
Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.
Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
- • диссоциации,
- • с металлами,
- • с основаниями,
- • с основными оксидами.
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.
Соли угольной кислоты. 9-й класс
Разделы: Химия
Класс: 9
Цели урока: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
– отработать навыки в решении расчетных и экспериментальных задачах;
– повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
– воспитывать коммуникативную культуру, уверенность в себе и своих знаниях, навыки контроля и самоконтроля.
Тип урока: изучение новой темы
Методические приемы: рассказ, демонстрации опытов.
Оборудование: раствор Na2CO3; раствор HCl, H2SO4, Ca(OH)2, Na2CO3 твердая, индикатор – фенолфталеин, штатив, газоотводная трубка; карточки – задания
Ход урока
I. Оргмомент.
II. Проверка домашнего задания.
Сегодня на уроке мы должны изучить соли угольной кислоты. Но прежде чем отправимся в увлекательный мир карбонатов, нам надо повторить свойства и строение H2CO3.
(2 человека у доски, 3 человека на рабочем месте)
1. Дать характеристику угольной кислоте: сила, основность, содержание кислорода. Составить уравнение диссоциации.
2. Химические свойства угольной кислоты.
а) адсорбция – это процесс – …
б) процесс выделения поглощенных веществ называется …
Пока ребята готовят ответы на вопрос, мы проведем небольшую письменную работу (10 вопросов)
- Разновидности простого вещества, образованного одним и тем же химическим элементом? (Аллотропные видоизменения)
- Электронная формула атома углерода. (1s 2 2s 2 2p 2 )
- Количество электронов на внешнем уровне у элементов IV группы главной подгруппы (четыре)
- Летучие водородные соединения С и Si? (СН4 – метан, SiН4 – силан)
- Формула высших оксидов элементов IV группы главной подгруппы? (RО2)
- Масса 0,5 моль СО2
? (22г)
- Объем 2 моль СН4 при н.у.? (44,8 л)
- Чего больше по массе в угарном газе углерода или кислорода? (кислорода С:О=3:4)
- Степень окисления углерода в угарном газе и углекислом газе? (+2;+ 4)
- Что такое сухой лед?
Проверка (правильные ответы на доске)
Ребята проверяют исправляют ошибки, выставляют себе оценки.
Проверка ответов у доски: рассмотрим свойства H2CO3.
III. Объяснение нового материала.
H2CO3 диссоциирует в две стадии. Сколько типов солей образует данная соль?
(По ходу опроса записывают схему на доске)
В повседневной жизни мы часто сталкиваемся с солями угольной кислоты (питьевая сода, известняк, мрамор, мел и т.п.)
Списывают с доски в тетрадь тривиальные названия солей.
Стихотворение о карбонатах. (Пока учащиеся пишут)
На земле живут три брата
Из семейства карбонатов.
Старший брат красавец – мрамор.
Славен именем каррары
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк
Потому и назван так.
Знаменит своим трудом
Возводя за домом дом.
И способен и умел младший
Мягкий братец мел.
Как рисует посмотри
Этот …СаСО3.
CaCO3 – мел, известняк, мрамор
NaHCO3 – питьевая сода
Na2CO3 – кальцинированная сода
Na2CO3·10H2O – кристаллическая сода
CaCO3 – жемчуг (минерал арагонит)
Получение солей: назовите лабораторный способ получения солей.
(кислота + основание–> соль + вода – реакция нейтрализации)
Для получения солей угольной кислоты используют –>C02
2NaOH+CO2

Na2CO3+CO2
Отношение к нагреванию.
CaCO3
CaHCO3–>CaCO3

(Это свойство позволяет использовать гидрокарбонаты в пищевой промышленности в качестве разрыхлителя теста)
В результате реакций выделяется CO2
— через раствор известковой воды (Ca (OH)2) образуется осадок белого цвета.
Ca(OH)2+CO2

но если дальше пропускать CO2 
CaCO3

Реагирует солями (тип реакций?)
(На доске расписывает ученик полное и сокращенное ионное уравнение)
Na2CO3+2HCl–>2NaCl+CO2
Реакция взаимодействия солей H2CO3 с кислотами – качественная.
Геологи используют это свойство для определения карбонатных минералов.
CaCO3(мел)+HCl
вскипание
Самостоятельно составьте уравнения химических реакций.
Испытать раствор Na2CO3 индикатором фенолфталеином (раствор малинового цвета)
Вывод: соли угольной кислоты имеют общие свойства солей и специфические: 1) взаимодействие с кислотами; 2) гидролиз.
IV. Решение задачи
Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
http://promplace.ru/himicheskie-soedineniya-staty/ugolnaya-kislota-2286.htm
http://urok.1sept.ru/articles/597439