Угольная кислота. Получение угольной кислоты.
Получение угольной кислоты.
При растворении углекислого газа образуется угольная кислота, причем в растворе присутствует равновесие:
В природе не встречается, очень неустойчива и легко распадается.
Угольная кислота двухосновная и образует 2 типа солей: кислые (гидрокарбонаты) и средние (карбонаты).
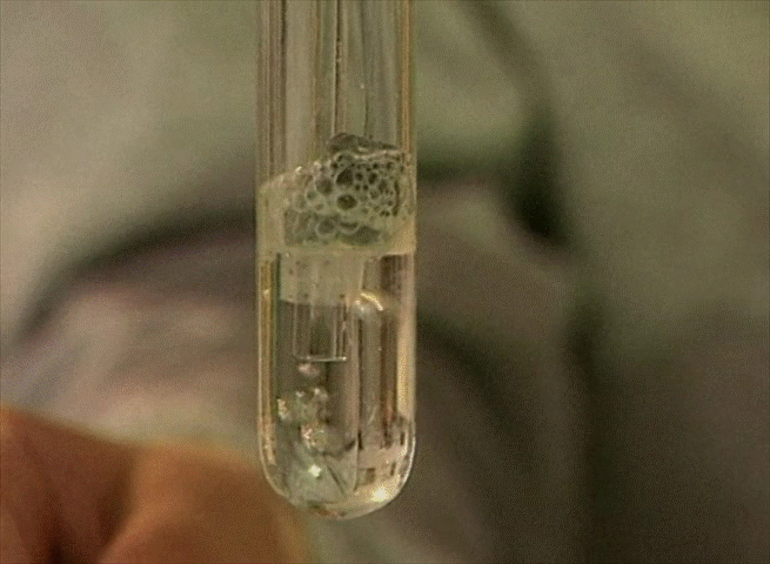
Качественная реакция на присутствие H2CO3: воздействие сильных кислот на соли H2CO3, в результате чего улетучивается СО2:
При пропускании углекислого газа через известковую воду выпадает белый осадок:
Только карбонаты щелочных металлов и аммония, а также гидрокарбонаты, растворимы в воде.
Если через выпавший осадок пропустить углекислый газ, то из нерастворимого карбоната образуется растворимый гидрокарбонат:
Гидрокарбонаты при температуре разлагаются на СО3 2- , Н2О и газ:
Карбонаты (кроме щелочных металлов) при темпеатуре распадаются:
Основное значение из всех солей имеет сода, из которой получают различные кристаллогидраты: Na2CO3·10H2O (наиболее устойчив, называется кристаллической содой), Na2CO3·7H2O, Na2CO3·H2O.
Угольная кислота. Свойства, получение, применение и цена угольной кислоты
Ее сложно увидеть. Угольная кислота известна науке в форме раствора. В воде размешен углекислый газ . Последнее вещество – это диоксид углерода с формулой CO2. Химическая запись воды, как известно, — H2O.
Вместе получается угольная кислота. Формула вещества записывается как H2CO3. Однако, выделить кислоту в виде порошка, как многие, не получается. Максимум – льдинки. Почему? Давайте разбираться.
Свойства угольной кислоты
Раствор угольной кислоты легко составляется и столь же просто распадается на изначальные компоненты. Особенно активно углекислый газ выделяется при нагреве. При пониженных температурах диссоциация угольной кислоты замедляется.
Вещество превращается в прозрачные кристаллы . Но, температуры, делающие кислоту стабильной, нетипичны для обычных условий. Поэтому, героиню статьи считают слабой, не способной сохранить собственную структуру и с трудом взаимодействующей с другими веществами.
Так, с растворами щелочей, металлами и их оксидами угольная кислота реагирует минимум в 2-е ступени. Сильная угольная кислота лишь в связке с еще более слабыми кислотами . Их героиня статьи вытесняет из растворов солей . «Капитулировать» приходится, к примеру, метакремниевой кислоте .
Химические свойства угольной кислоты являются робким выражением свойств двухосновных кислот . Героиня статьи относится к ним, поскольку содержит в структуре 2 атома водорода . Если точнее, в молекуле угольного соединения есть 2-е группы COOH.
Это, в частности, заставляет героиню статьи проявлять электролитические свойства. Проводить ток позволяет частичное распадение кислоты на ионы. У твердых электролитов они движутся внутри кристаллических решеток. Угольная кислота выделяет ионы только в растворах.
Как и прочие двухосновные вещества, угольная кислота в реакции вступает, дающие два ряда солей . Это бикарбонаты и простые карбонаты. Последние нерастворимы в воде и известны людям под видом мрамора , мела , известняка . Все три камня основаны на карбонате кальция с формулой CaCO3.
Угольная кислота и ее соли бесцветны. Помните, что мел, известняк и мрамор, зачастую, белые ? В растворе героиня кислоты тоже белеса, находится, в основном, в свободном виде.
Так именуют отдельное существование молекул воды и распределенного в ней углекислого газа. Но, встречаются в растворах и карбонатные ионы CO 32- и бикарбонатные частицы HCO3. Все вместе представляет долю кислоты в воде.
Система отличается кинетическим равновесием, то есть, неизменной концентрацией составляющих. Если допускается избыточное содержание диоксида углерода, вода становится агрессивной. Такой раствор расщепляет металлы , бетоны, различные конструкции и камни .
В обычных условиях доля угольной кислоты в воде мала, как и в воздухе, почве. В земле вещества, к примеру, от 0,0002 до 0,0005 частей. Ученые считают, что так было не всегда.
Ища причины гигантских размеров древних растений, исследователи пришли к выводу, что в прошлые эпохи и в почве, и в атмосфере, героини статьи было в несколько раз больше.
Растения способны усваивать вещество и пользуются его влиянием на растворимость в земле минеральных веществ, необходимых травам, кустам и деревьям для питания.
Проводились опыты выращивания растений в атмосферах с разным содержанием угольной кислоты. Рекорды показали экземпляры, находящие в воздухе с содержанием H2CO3 от 5-ти до 10-ти процентов.
Получение угольной кислоты
Важно не столько получение угольной кислоты, сколько ее соединений. Одно из них, к примеру, сода . Она является солью угольного соединения. Сода – кристаллическое вещество.
Но, как засечь образование чистой кислоты , раз она бесцветна? Отличить раствор от простой воды поможет лакмусовая бумажка . Она фиолетовая . В нейтральной среде цвет не меняется. Кислота окрасит лакмус в красный .
Раз героиня статьи получается добавлением в воду диоксида углерода, для начала нужно получить его. Поможет соляная кислота . Она сильная, с легкостью растворяет многие камни, в том числе и мрамор. Реакция ведет к выделению углекислого газа. С водой он смешается самостоятельно.
Получение углекислой кислоты , кстати, налажено в человеческом организме. Героиня статьи входит в буферные системы крови . Они контролируют постоянный pH организма.
Если извне поступают продукты с явной кислотностью или щелочной средой, буферные агенты удерживают нужный pH, пока «гости» переработаются и выведутся с потом, калом, мочой.
Лишние ионы блокируются и нейтрализуются. Это делают белковый, бикарбонатный, фосфатный и гемоглобиновый буферы. Каждый из них состоит из слабой кислоты , одной из ее солей и сильного основания.
В промышленности углекислоту получают 5-ю путями. Первый – извлечение вещества, как сопутствующего углеводородам при их откачке из скважин. При сжигании нефти , угля , кокса, кислоту тоже получают. Получается углекислота и при производстве аммиака . Героиня статьи становится побочным продуктом реакции.
Побочным продуктом углекислота является, так же, при брожении. Так что, соединением запасаются, к примеру, во время изготовления вина. Еще один источник углекислоты – выпуск гашеной извести.
Правда, от нее «отлетают» еще и азот, прочие примеси. Они же затрудняют получение реагента при сжигании углеводородов и на аммиачных заводах . Так что, эффективными способами промышленного получения героини статьи считаются лишь три из перечисленных.
Применение угольной кислоты
В чистом виде угольная кислота нужна не только организму человека растениям, но и на производствах. В процессе сварки, к примеру, героиня статьи служит защитной средой, подобно аргону.
Правда, углекислое соединение приходится раскислять. Для этого используют марганец и кремний . Иначе, нагрев при сварке провоцирует выделение из диоксида углерода активного кислорода.
Он провоцирует коррозию металлов. Именно из-за необходимости обработки угольной кислоты в качестве защитной среды чаще выбирают газ аргон. В пищевой промышленности углекислота – антиокислитель. Его добавляют в чаи , сыры, кофе . Примесь консервирует их, способствуя продолжительному хранению.
Пожарные бригады знают героиню статьи, как средство борьбы с огнем . Кислотой заполняют емкости, из которых соединение поступает к соплам. Для этого используют распределительные трубопроводы. Сопла находятся в защищаемых помещениях.
Выходя «на свободу» кислота превращается в пар, поглощая тепло окружающей среды, заполняя площади. В открытых помещениях системы углекислого пожаротушения не используют, лишь в трюмах, кладовых, насосных, отсеках электростанций. Принцип действия сводится к снижению уровня кислорода до 8%. Горение при таком показатели прекращается.
Раз угольная кислота нужна организму, ее используют медики, фармацевты. Вещество применяется в производстве аспирина, добавляется при некоторых видах анестезии, к примеру, в кислородные маски .
К угнетению дыхательного центра прибегают, в основном, при отравлениях летучими ядами и асфиксии новорожденных. Асфиксия – удушение. У младенцев вызывается, обычно, рвотными массами и первородным калом. Углекислота способствует сокращению легочных тканей, восстановлению их функции.
Применяют медики и углекислый снег. Это те самые кристаллы кислоты , которые получают при низких температурах. Так что, врачам удается увидеть героиню статьи в кристаллическом виде.
Удается это, так же, больным волчанкой, бородавками, лепрозными узлами. Соприкасаясь с кислотным льдом, пораженные участки кожи разрушаются. Грубо говоря, угольная кислота вырезает лишнее, подобно лазеру.
В жидком виде углекислота тоже может выступать хладагентом, используется в морозильном оборудовании. Еще одно поле применения – умягчение воды. Ее, правда, улучшает не чистая кислота, а одна из ее солей – атронная известь.
Цена угольной кислоты
Структурная формула угольной кислоты вмещается промышленниками в баллоны и цистерны. Прежде чем поместить героиню статьи в них, ее охлаждают. Это помогает сгустить вещество.
Предложений купить его единицы. Чаще, реализуют углекислые соединения. За димитилкарбонат, к примеру, просят около 1 500 рублей за килограмм. Вещество растворяет эфиры целлюлозы, а посему, применяется в органическом синтезе.
За натриевую соль, а попросту соду, приходится выкладывать 80-200 рублей за килограмм. Ценники разнятся в зависимости от производителей и добавок к продукту. Так, бывает, к примеру, кальцированная сода.
Если смотреть в глобальных масштабах, угольная кислота бесценна. Именно она является источником углерода для живых материй, причем, единственным. Углерод есть и в нефти, вулканических выбросах.
Элемент составляет ряд минералов, к примеру, графит и алмаз . Но, там элемент непотребен для животных . Они, как и растения, развиваются за счет угольной кислоты.
Есть даже мнение, что атланты – не чудо-люди или пришельцы из космоса, а всего лишь достойные «дети» атмосферы, насыщенной соединением воды и углекислого газа. Но, это теория в стиле «РенТВ». Сосредоточимся на научных фактах.
Роль угольной кислоты в жизни человека , животных, растений, ученые осознали и изучили около 3-ех столетий назад. С тех пор соединение и стали именовать бесценным. Наибольший вклад в изучение углекислоты внес Ян Ингенхоуз.
Голландский химик жил на рубеже 18-го и 19-го веков. Свои исследования Ян сосредоточил на гелиотропизме растений. Так именуют стремление зелени к солнцу , поворот стебля и бутонов в его сторону. Заодно, Ингенхоуз изучил газы, выделяемые растениями. Отсюда, собственно, и «понеслась» тема со значением в жизни трав и жизни вообще углекислоты.
Угольная кислота — свойства, получение и применение
Физические и химические свойства
Угольная кислота способна существовать в равновесии с диоксидом углерода в водных растворах. Однако при изменении условий, в частности, температуры, этот карбонатный класс склонен распадаться, одновременно происходит окисление гидроксида. Также встречается безводная форма, которая представляет собой небольшие бесцветные кристаллы, образующиеся при температурах ниже минус 30 градусов. При ее нагревании происходит диссоциация угольной кислоты, при которой твёрдая форма полностью разлагается.
Соляный ангидрид свое название получил из-за формулы угольной кислоты, в которой содержится СО2. Газ может подвергаться обратному гидролизу, создавая устойчивую кислую среду. В растворах, содержащих эти элементы, возникает равновесная сложная система, которая сохраняет свою химическую формулу и физические свойства. При повышении температуры стабильность и равновесие такого раствора нарушается, а кислота начинает разлагаться. Полностью этот процесс завершается при кипячении водного раствора.
Угольная кислота, графическая формула которой выглядит как H2CO3, имеет нейтральную реакцию, образуя кислые и средние соли, в том числе гидрокарбонаты и карбонаты. На сегодняшний день это вещество отлично изучено, химикам известна степень, молярное уравнение, масса, константа и степень валентности. Такие соединения получили широкое распространение в пищевой промышленности, их используют в качестве консервантов и раскислителей, а также в бытовой химии для изготовления различных чистящих и моющих средств.
Способы получения
Наибольшее распространение на сегодняшний день получила технология изготовления кислоты угольной путем растворения в воде структурной газовой формы диоксида углерода. Для производства этих соединений используют соответствующие установки, позволяющие увеличивать давление углекислоты, одновременно понижая температуру раствора. В подобных условиях концентрация угольной кислоты увеличивается и в последующем имеется возможность получения твердой формы за счёт понижения температуры до отметки -35 градусов и ниже.
Также в последние годы популярностью стала пользоваться технология производства солей путем взаимодействия гидрокарбонатов и карбонатов с еще более сильными кислотами. При этом лучшая часть полученных соединений разлагается на диоксид углерода и воду. Преимуществом такой технологии является простота используемого оборудования, не требуется одновременно охлаждать растворы и повышать давление CO2, но при этом отмечается большое количество отходов. Недостатком этой технологии является то, что требуется утилизировать углеродный диоксид, который превращается в пар.
Используемые сегодня высокотехнологичные установки позволяют получать чистую кислоту угольную, в особенности при применении технологии с экстремально низкими температурами. В последующем необходимо лишь обеспечить правильное хранение кристаллов, которые при температурах выше минус 30 градусов начинают растворяться, быстро теряя все свои свойства. Также возможно производство и последующее хранение различных солей на основе этого соединения, которые сохраняют свою форму и параметры даже при положительных температурах и доступе воздуха.
Особенности применения
Угольная кислота и её соли сегодня активно используются в различных сферах жизнедеятельности человека. Они применяются в медицине, строительстве и кулинарии. Без этих микроэлементов невозможно было бы получение и возникновение следующих составов и материалов:
- мраморный камень;
- известняковые породы;
- кристаллическая и пищевая сода;
- мел;
- поташ.
Также из кислоты угольной получают углекислый газ, который требуется для изготовления газированной воды. Свойства этих соединений изменять показатели давления в зависимости от содержания ионов и кислотности позволяют на их основе выпускать хладагенты для морозильников и солнечных генераторов.
Такие кислоты и соли широко используются в пищевой промышленности, они полностью безопасны для организма человека. Из нее делаются разнообразные консерванты, которые не ухудшают свойства продуктов питания, существенно продлевая их срок хранения. Это соединение используется в качестве антиокислителя, его добавляют в кофе, чай и сыры. С открытием этой кислоты появилась возможность изготавливать разнообразные шипучие напитки, в том числе минералку, Coca- Cola и даже шампанское.
В последние годы широкое распространение получила литиевая соль, которую изготавливают из этой кислоты. Она применяется для производства керамических изделий, также ее добавляют в топливо для реактивных двигателей. Сегодня это химическое соединение активно применяется в стекловарении. На его основе выполняют специальные добавки, которые повышают прочность и эксплуатационные характеристики конечного материала. Силикатное стекло, в которое была добавлена литиевая соль, отличается не только прочностью, но и великолепными показателями проницаемости светового потока.
Кислоту угольную активно используют пожарные бригады, что позволяет им эффективно бороться с огнём. В жидком виде такие соединения содержат в специальных емкостях, после чего под высоким давлением направляют в распылители, смешивая со специальными химикатами, образующими густую пену. Это позволяет не только бороться с открытым пламенем, но и быстро тушить горящую нефть и различные нефтепродукты.
Использование в сельском хозяйстве
Кислота угольная сегодня широко используется в сельском хозяйстве для производства различных качественных минеральных удобрений. Это экологически чистые компоненты, которые применяются для подкормки различных овощных, фруктовых и плодовых культур, позволяя существенно повысить показатели урожайности.
На основе кислоты угольной выполняются следующие минеральные удобрения:
- кальцинированная сода;
- литиевая соль;
- карбамид или мочевина.
Наибольшее распространение сегодня получила мочевина или как она стала сегодня называться карбамид. Это простое в использовании эффективное удобрение, которое отличается универсальностью. С одинаковым успехом его можно вносить под плодовые деревья, фрукты и овощи, различные декоративные растения.
Несомненным преимуществом таких удобрений на основе угольной кислоты является доступная стоимость минеральных составов, их простота использования, эффективность и полная экологичность.
Средняя стоимость
На сегодняшний день в России имеется несколько крупных производителей кислоты угольной, которые изготавливают как соли, так и чистые вещества. В среднем стоимость одного килограмма такого соединения составляет 3−4 тысячи рублей.
Также востребован мел, который изготавливают с использованием этой кислоты, он применяется в кормовых и технических целях. За одну тонну мела обычно просят 1200 рублей.
В редких случаях используется так называемый угольный снег, то есть кристаллы твердой формы этой кислоты. Они имеют крайне высокую стоимость, доходящую до 10000 рублей за килограмм и более. При этом необходимо обеспечить соответствующие условия хранения, в том числе поддержание температуры на уровне минус 30−35 градусов, что предупреждает его разложение. Это соединение применяется в химической промышленности, а также при производстве разнообразных продуктов питания.
http://tvoi-uvelirr.ru/ugolnaya-kislota-svojstva-poluchenie-primenenie-i-cena-ugolnoj-kisloty/
http://nauka.club/khimiya/ugoln%D0%B0y%D0%B0-kislot%D0%B0.html