4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе».
Раствором называют гомогенную смесь двух или более компонентов.
Вещества, смешением которых получен раствор, называют его компонентами.
Среди компонентов раствора различают растворенное вещество, которое может быть не одно, и растворитель. Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Иногда понятие растворитель может быть применимо в равной степени к любому из компонентов. Например, это касается тех растворов, которые получены смешением двух или более жидкостей, идеально растворимых друг в друге. Так, в частности, в растворе, состоящем из спирта и воды, растворителем может быть назван как спирт, так и вода. Однако чаще всего в отношении водосодержащих растворов традиционно растворителем принято называть воду, а растворенным веществом — второй компонент.
В качестве количественной характеристики состава раствора чаще всего используют такое понятие, как массовая доля вещества в растворе. Массовой долей вещества называют отношение массы этого вещества к массе раствора, в котором оно содержится:
где ω(в-ва) – массовая доля вещества, содержащегося в растворе (г), m(в-ва) – масса вещества, содержащегося в растворе (г), m(р-ра) – масса раствора (г).
Из формулы (1) следует, что массовая доля может принимать значения от 0 до 1, то есть составляет доли единицы. В связи с этим массовую долю можно также выражать в процентах (%), причем именно в таком формате она фигурирует практически во всех задачах. Массовая доля, выраженная в процентах, рассчитывается по формуле, схожей с формулой (1) с той лишь разницей, что отношение массы растворенного вещества к массе всего раствора умножают на 100%:
Для раствора, состоящего только из двух компонентов, могут быть соответственно рассчитаны массовые доли растворенного вещества ω(р.в.) и массовая доля растворителя ω(растворителя).
Массовую долю растворенного вещества называют также концентрацией раствора.
Для двухкомпонентного раствора его масса складывается из масс растворенного вещества и растворителя:
Также в случае двухкомпонентного раствора сумма массовых долей растворенного вещества и растворителя всегда составляет 100%:
Очевидно, что, помимо записанных выше формул, следует знать и все те формулы, которые напрямую из них математически выводятся. Например:
Также необходимо помнить формулу, связывающую массу, объем и плотность вещества:
а также обязательно нужно знать, что плотность воды равна 1 г/мл. По этой причине объем воды в миллилитрах численно равен массе воды в граммах. Например, 10 мл воды имеют массу 10 г, 200 мл — 200 г и т.д.
Для того чтобы успешно решать задачи, помимо знания указанных выше формул, крайне важно довести до автоматизма навыки их применения. Достичь этого можно только прорешиванием большого количества разнообразных задач. Задачи из реальных экзаменов ЕГЭ на тему «Расчеты с использованием понятия «массовая доля вещества в растворе»» можно порешать здесь.
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO3) = 5 г, а m(Н2O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H2O) = x г = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
1-й раствор
2-й раствор
3-й раствор
где mр.в., mр-ра и ωр.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
Вставим все эти значения в таблицу, получим:
1-й раствор
2-й раствор
3-й раствор
Нам следует вспомнить следующие формулы, необходимые для расчетов:
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
Внесем рассчитанные значения в таблицу:
1-й раствор
2-й раствор
3-й раствор
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
Внесем рассчитанные значения в таблицу, получим:
1-й раствор
2-й раствор
3-й раствор
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор
2-й раствор
3-й раствор
В первом столбце известны два значения, значит можем посчитать третье:
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор
2-й раствор
3-й раствор
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
1-й раствор
2-й раствор
3-й раствор
Теперь можем рассчитать массовую долю в третьем растворе:
Массовая доля
О чем эта статья:
Что такое массовая доля
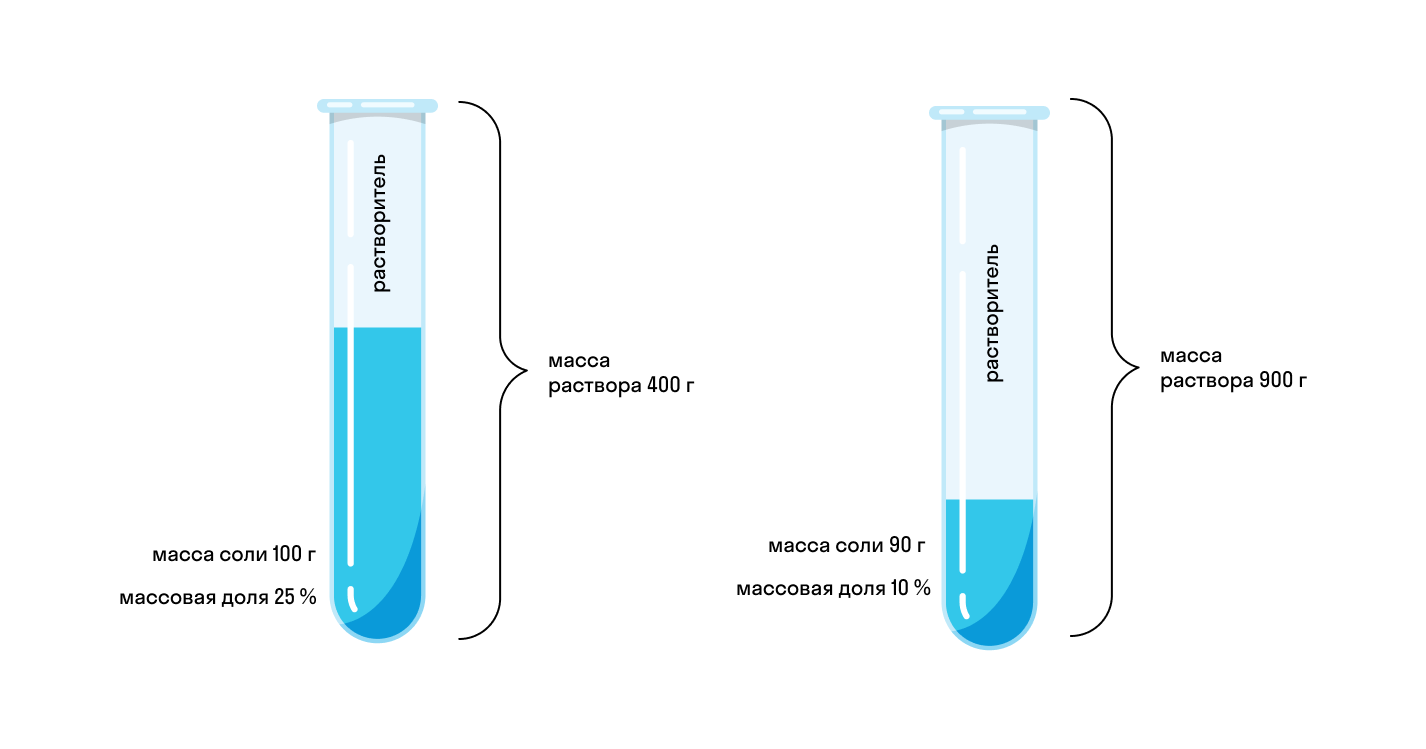
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
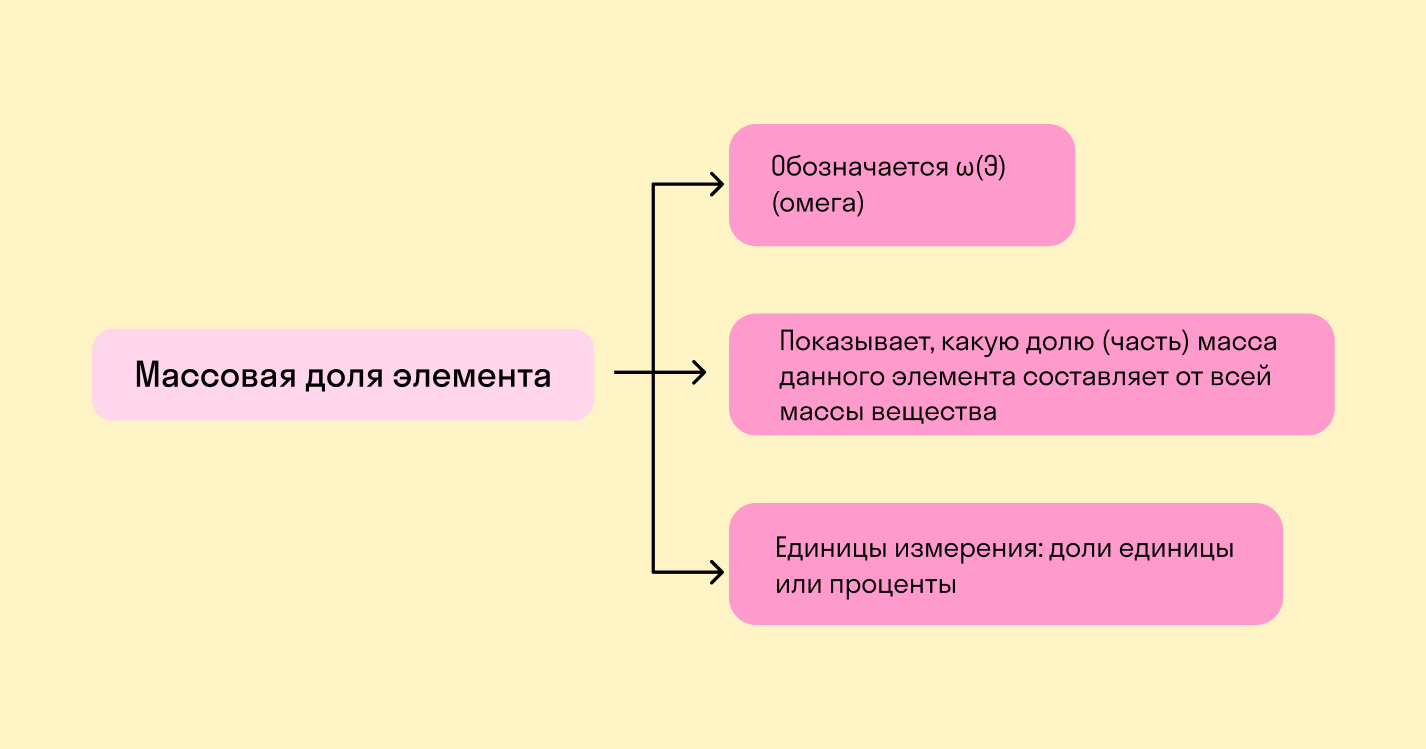
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Массовая доля вещества
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
Раствор — однородная смесь различных веществ в жидком виде.
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике « Химия . 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
Электронная форма учебника (ЭФУ) Химия. 8 класс включена в состав учебно-методического комплекта (УМК) по предмету Химия 8 класса Габриелян О. С. Химия. 8 класс соответствует требованиям Федерального государственного образовательного стандарта. ЭФУ рекомендована Министерством образования и науки Российской Федерации.
Итак, с теорией разобрались. Переходим к практике.
Дано: Директор школы подозревает, что один из его поваров нечист на руку и ворует сахарозу, которая предназначена для школьных завтраков. Вы работаете экспертами-криминалистами в лаборатории и для исследования вам доставили три стакана с растворами, выданными школьникам в три разных дня.
В первый день школьникам на завтрак выдали 200 г 10% раствора сахарозы, во второй день 200 г 8% раствора, а в третий 200 г 5%. Нужно рассчитать , сколько граммов сахарозы содержится в каждом растворе, и какой из поваров ворует больше всех.
1. Сначала определяем растворитель и растворенное вещество.
В нашем случае это вода и сахароза соответственно.
2. Используя формулу (2) составляем уравнение для первого раствора.
ω (сахарозы)= m (сахарозы)/m (р-ра)*100%
х=20 (г) — сахарозы содержится в первом стакане.
3. Аналогично находим содержание сахарозы в остальных стаканах.
Ответ : В первом растворе содержится 20 граммов сахарозы, во втором 16 граммов, а в третьем всего 10 граммов. Учитывая это, можно предположить, что третий повар ворует больше всех. А вот словить его за руку – задача специалистов другого профиля.
На ферме по выращиванию крокодилов опытным путем установили, что лучше всего крокодилы развиваются в 7% растворе NaСl. Работник фермы оставил на подоконнике склянку со 100 граммами 2% раствора и склянку с 200 граммами 4% раствора. Уборщице тете Мане нужна была пустая склянка, чтобы полить цветы, и она слила растворы в одну емкость. Необходимо определить, сколько граммов NaСl нужно добавить к полученному раствору, чтобы получить 7% раствор.
Задачу лучше решать с помощью таблицы.
| 2% р-р | 4% р-р | х%р-р | 7%р-р |
| m (в-ва) | |||
| m (р-ра) | |||
| ω (в-ва) |
1. Заполняем известные данные.
100+200 = 300 г ( масса полученного раствора и масса нужного 7% раствора)
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | ||||
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
2. Используя формулу (2), рассчитываем массу вещества в 2% и 4% растворах.
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
математически преобразовываем формулу, чтобы найти неизвестное.
m (в-ва)=ω (в-ва)/100%* m (р-ра)
х=2 (г) — содержалось в первом растворе
х=8 (г) — содержалось во втором растворе
3. Определяем, сколько граммов содержится в третьем растворе
2+8=10 (г) — содержится в третьем растворе.
4. Определяем, сколько граммов NaСl должно быть в четвертом растворе.
х=21 (г) — должно содержаться в третьем растворе
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | 2 | 8 | 10 | 21 |
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
5. Определяем, сколько граммов NaСl нужно добавить в третий раствор, чтобы получить нужную концентрацию.
Ответ: 11 граммов NaСl нужно добавить в третий раствор, чтобы получить 7% концентрацию.
Однако, только уметь решать задачи для успешной сдачи ЕГЭ мало. Нужно закрепить знания и довести навык до автоматизма. С этой задачей помогут справиться учебники и задачники на платформе LECTA .
http://skysmart.ru/articles/chemistry/massovaya-dolya
http://rosuchebnik.ru/material/massovaya-dolya-veshchestva/