Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
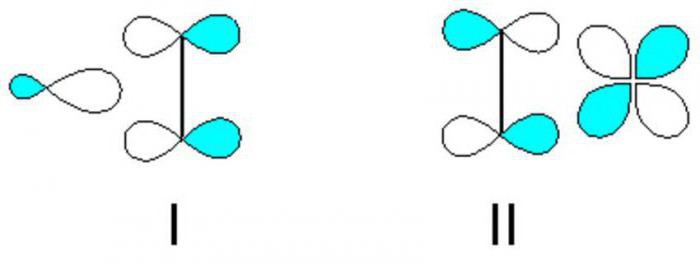
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
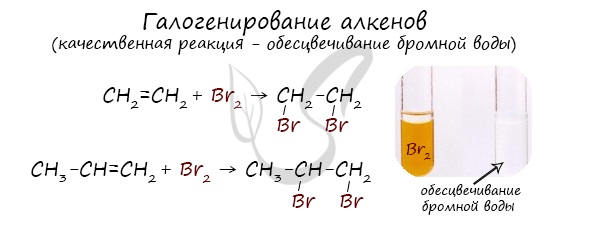
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
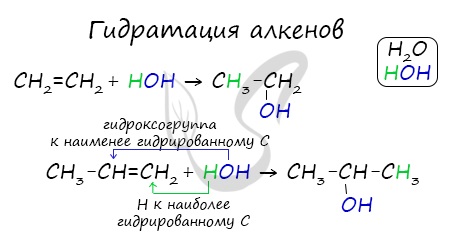
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
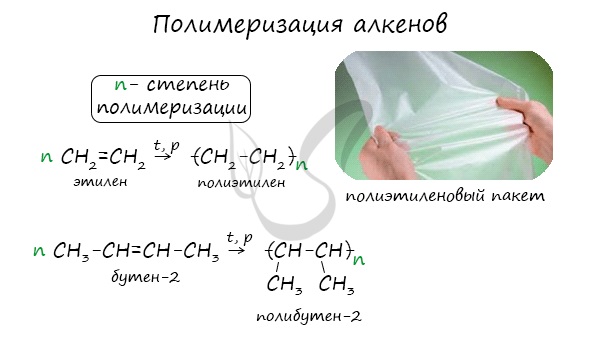
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
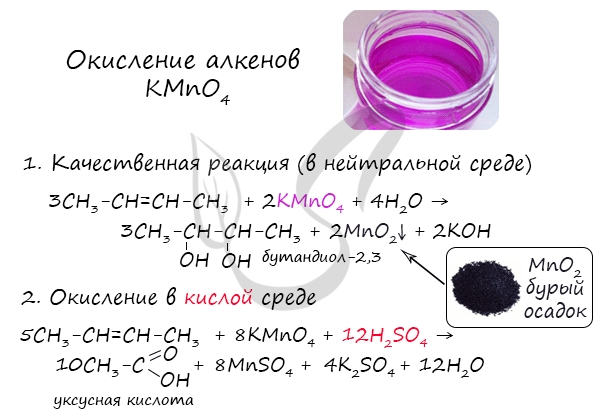
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
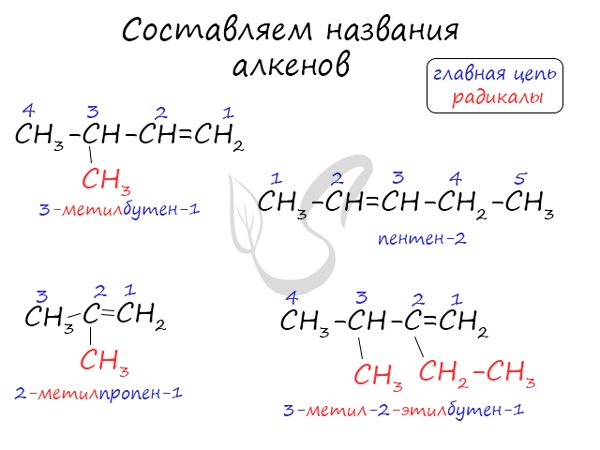
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
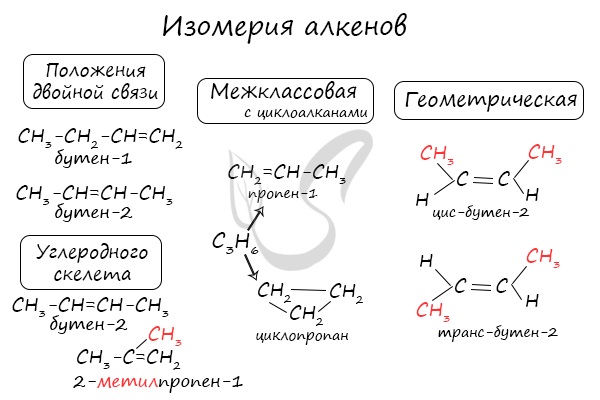
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Гидратация алкенов: реакция и уравнения
Выясним, что представляет собой реакция гидратации алкена. Для этого дадим краткую характеристику данного класса углеводородов.
Общая формула
Алкены — это ненасыщенные органические соединения, имеющие общую формулу СпН2п, в молекулах которых есть одна двойная связь, а также присутствую одинарные (простые) связи. Углеродные атомы при ней находятся в sp2 гибридном состоянии. Представителей этого класса называют этиленовыми, так как родоначальником данного ряда является этилен.
Особенности номенклатуры
Для того чтобы понять механизм гидратации алкена, необходимо выделить особенности их наименования. Согласно систематической номенклатуре, при составлении названия алкена используют определенный алгоритм действий.
Для начала необходимо определить самую длинную углеродную цепочку, включающую двойную связь. Цифрами указывают расположение углеводородных радикалов, начиная с самого маленького в русском алфавите.
При наличии в молекуле нескольких одинаковых радикалов, в названии добавляют уточняющие приставки ди-, три-, тетра.
Только после этого называют саму цепочку из углеродных атомов, добавляя в конце суффикс -ен. Чтобы уточнить расположение в молекуле непредельной (двойной) связи, ее указывают цифрой. Например, 2метилпентен-2.
Гибридизация в алкенах
Чтобы справиться с заданием следующего типа: «Установите молекулярную формулу алкена, гидратацией которого получили вторичный спирт», необходимо выяснить особенности строения представителей этого класса углеводородов. Наличие двойной связи объясняет способность СхНу вступать в реакции присоединения. Угол между двойными связями составляет 120 градусов. По ненасыщенной связи не наблюдается вращения, поэтому для представителей этого класса характерна геометрическая изомерия. В качестве основного реакционного места в молекулах алкенов выступает именно двойная связь.
Физические свойства
Они аналогичны предельным углеводородам. Низшие представители данного класса органических углеводородов являются при нормальных условиях газообразными веществами. Далее наблюдается постепенный переход к жидкостям, а для алкенов, в молекулах которых содержится больше семнадцати атомов углерода, характерно твердое состояние. Все соединения этого класса имеют незначительную растворимость в воде, при этом они отлично растворяются в полярных органических растворителях.
Особенности изомерии
Присутствие в молекулах соединений ряда этилена объясняет многообразие их структурных формул. Помимо изомеризации углеродного скелета, характерной для представителей всех классов органических соединений, у них есть межклассовые изомеры. В их качестве выступают циклопарафины. Например, для пропена межклассовым изомером является циклопропан.
Присутствие в молекулах данного класса двойной связи объясняет возможность геометрической цис- и транс- изомерии. Такие структуры возможны только у симметрических непредельных углеводородов, имеющих в составе двойную связь.
Существование данного варианта изомерии определяется невозможностью свободного вращения углеродных атомов по двойной связи.
Специфика химических свойств
Механизм гидратации алкена имеет определенные особенности. Данная реакция относится к электрофильному присоединению.
Как протекает реакция гидратации алкена? Чтобы ответить на данный вопрос, рассмотрим правило Марковникова. Суть его состоит в том, что гидратация алкенов несимметричного строения осуществляется определенным образом. Атом водорода будет присоединяться к тому углероду, который более гидрогенизирован. Гидроксильная группа присоединяется к углеродному атому, у которого меньше Н. Гидратация алкенов приводит к образованию вторичных одноатомных спиртов.
Для того чтобы реакция протекала в полном объеме, в качестве катализаторов используют минеральные кислоты. Они гарантируют ввод в реакционную смесь необходимого количества катионов водорода.
Гидратацией алкенов нельзя получить первичные одноатомные спирты, поскольку не будет соблюдаться правило Марковникова. Данная особенность используется в органическом синтезе вторичных спиртов. Любая гидратация алкенов осуществляется без использования жестких условий, поэтому процесс нашел свое практическое использование.
Если в качестве исходного представителя класса СпН2п берут этилен, правило Марковникова не работает. Какие спирты нельзя получить гидратацией алкенов? Невозможно получить в результате такого химического процесса первичные спирты из несимметричных алкенов. Как используется гидратация алкенов? Получение спиртов вторичного вида осуществляется именно таким способом. Если в качестве углеводорода выбирается представитель ряда ацетилена (алкины), гидратация приводит к получению кетонов и альдегидов.
По правилу Марковникова осуществляется гидратация алкенов. Реакция имеет механизм электрофильного присоединения, суть которого хорошо изучена.
Приведем несколько конкретных примеров подобных превращений. К чему приводит гидратация алкенов? Примеры, предлагаемые в школьном курсе химии, свидетельствуют о том, что из пропена можно получить при взаимодействии с водой пропанол-2, а из бутена-1 получают бутанол-2.
В промышленных объемах используется гидратация алкенов. Спирты вторичного состава получают именно таким способом.
Галогенирование
Качественной реакцией на двойную связь считается взаимодействие непредельных углеводородов с молекулами галогенов. Мы уже проанализировали, как происходит гидратация алкенов. Механизм галогенирования аналогичен.
Молекулы галогенов имеют ковалентную неполярную химическую связь. При проявлении временных флуктуаций у каждой молекулы возникает электрофильность. В результате вырастает вероятность протекания присоединения, сопровождающегося разрушением двойной связи в молекулах ненасыщенных углеводородов. После завершения процесса продуктом реакции является дигалогенпроизводное алкана. Бромирование считают качественной реакцией на непредельные углеводороды, поскольку происходит постепенное исчезновение бурой окраски галогена.
Гидрогалогенирование
Мы уже рассмотрели, какова формула гидратации алкенов. Аналогичный вариант имеют и реакции взаимодействия с бромоводородом. В данном неорганическом соединении ковалентная полярная химическая связь, поэтому происходит смещение электронной плотности к более электроотрицательному атому брома. Водород приобретает частичный положительный заряд, отдавая галогену электрон, атакует молекулу алкена.
Если непредельный углеводород имеет несимметричное строение, при его взаимодействии с галогеноводородом происходит образование двух продуктов. Так, из пропена при гидрогалогенировании получают 1-бромпроан и 2-бромпропан.
Для предварительной оценки вариантов взаимодействия учитывают электроотрицательность выбираемого заместителя.
Окисление
Двойная связь, присущая молекулам непредельных углеводородов, подвергается воздействию сильных окислителей. Они также имеют электрофильный характер, применяются в химической промышленности. Особый интерес представляет окисление алкенов водным (либо слабощелочным) раствором перманганата калия. Ее называют реакцией гидроксилирования, так как в итоге получают двухатомные спирты.
Например, при окислении молекул этилена водным раствором перманганата калия получают этиндиол-1,2 (этиленгликоль). Это взаимодействие считают качественной реакцией на двойную связь, так как в ходе взаимодействия наблюдается обесцвечивание раствора перманганата калия.
В кислой среде (при жестких условиях) среди продуктов реакции можно отметить альдегид.
При взаимодействии с кислородом воздуха наблюдается окисление соответствующего алкена до углекислого газа, водяного пара. Процесс сопровождается выделением тепловой энергии, поэтому в промышленности его используют для получения тепла.
Наличие двойной связи в молекуле алкена свидетельствует о возможности протекания у данного класса реакций гидрирования. Взаимодействие СпН2п с молекулами водорода происходит при термическом использовании в качестве катализаторов платины, никеля.
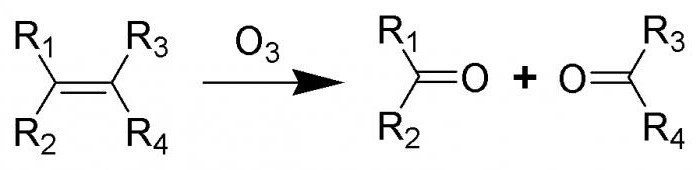
Многие представители класса алкенов склонны к озонированию. При невысоких температурах представители данного класса реагируют с озоном. Процесс сопровождается разрывом двойной связи, образованием циклических перекисных соединений, именуемых озонидами. В их молекулах присутствуют связи О-О, поэтому вещества являются взрывоопасными веществами. Озониды не синтезируют в чистом виде, их разлагают, используя процесс гидролиза, затем восстанавливают с помощью цинка. Продуктами такой реакции выступают карбонильные соединения, выделяемые и идентифицируемые исследователями.
Полимеризация
Данная реакция предполагает последовательное объединение нескольких молекул алкена (мономеров) в крупную макромолекулу (полимер). Из исходного этена получают полиэтилен, имеющий промышленное применение. Полимером называют вещество, которое имеет высокую молекулярную массу.
Внутри макромолекулы располагается определенное количество повторяющихся фрагментов, называемых структурными звеньями. Для полимеризации этилена в качестве структурного звена рассматривается группа — СН2—СН2-. Степень полимеризации показывает количество звеньев, повторяющихся в структуре полимера.
Степень полимеризации определяет свойства полимерных соединений. Например, полиэтилен с короткими цепями представляет собой жидкость, имеющую смазочные свойства. Для макромолекулы с длинными цепями свойственно твердое состояние. Гибкость и пластичность материала применяют в изготовлении труб, бутылок, пленок. Полиэтилен, в котором степень полимеризации составляет пять-шесть тысяч, обладает повышенной прочностью, поэтому применяется при производстве прочных нитей, жестких труб, литых изделий.
Среди продуктов, получаемых путем полимеризации алкенов, имеющих практическое значение, выделим поливинилхлорид. Данное соединение получают путем полимеризации винилхлорида. Получаемый продукт имеет ценные эксплуатационные характеристики. Он отличается повышенной стойкостью к воздействию агрессивных химических веществ, негорюч, легко поддается окрашиванию. Что можно изготовить из поливинилхлорида? Портфели, плащи, клеенку, искусственную кожу, кабели, изоляцию электрических проводов.
Тефлон является продуктом полимеризации тетрафторэтилена. Данное органическое инертное соединение устойчиво к резким перепадам температур.
Полистирол представляет собой упругое прозрачное вещество, образуемое путем полимеризации исходного стирола. Он незаменим при изготовлении диэлектриков в радио- и электротехнике. Кроме того, полистирол в большом количестве применяется для производства кислотоупорных труб, игрушек, расчесок, пористых пластмасс.
Особенности получения алкенов
Представители данного класса востребованы в современной химической промышленности, поэтому были разработаны разнообразные способы их промышленного и лабораторного получения. В природе этилен и его гомологи не существуют.
Многие лабораторные варианты получения представителей данного класса углеводородов связаны с реакциями, обратными присоединению, именуемые отщеплением (элиминированием). Например, при дегидрировании парафинов (предельных углеводородов) получают соответствующие алкены.
При взаимодействии галогенпроизводных алканов с металлическим магнием также можно получить соединения с общей формулой СпН2п. Элиминирование осуществляется по правилу Зайцева, обратному правилу Марковникова.
В промышленных объемах непредельные углеводороды ряда этилена получают путем крекинга нефти. В газах крекинга и пиролиза нефти и газа содержится от десяти до двадцати процентов непредельных углеводородов. В смеси продуктов реакции находятся и парафины, и алкены, которые отделяют друг от друга путем фракционной перегонки.
Некоторые области применения
Алкены являются важным классом органических соединений. Возможность их применения объясняется отличной реакционной способностью, простотой получения, приемлемой стоимостью. Среди многочисленных промышленных отраслей, использующих алкены, выделим полимерную промышленность. Огромное количество этилена, пропилена, их производных уходит на изготовление полимерных соединений.
Именно поэтому так актуальны вопросы, касающиеся поиска новых путей производства алкеновых углеводородов.
Поливинилхлорид считается одним из важнейших по применению продуктов, получаемых из алкенов. Для него характерна химическая и термическая устойчивость, незначительная горючесть. Поскольку данное вещество не растворяется в минеральных, но растворимо в органических растворителях, его можно использовать в разных промышленных отраслях.
Его молекулярная масса составляет несколько сотен тысяч. При повышении температуры вещество способно к разложению, сопровождаемому выделением хлороводорода.
Особый интерес представляют его диэлектрические свойства, используемые в современной электротехнике. Среди отраслей промышленности, в которых применяют поливинилхлорид, выделим изготовление искусственной кожи. Получаемый материал по эксплуатационным характеристикам ничуть не уступает натуральному материалу, при этом имеет гораздо меньшую стоимость. Одежда из такого материала становится все более популярной у модельеров, создающих яркие и красочные коллекции молодежной одежды из поливинилхлорида разного цвета.
В больших количествах поливинилхлорид применяют в качестве уплотнителя в холодильниках. Благодаря эластичности, упругости это химическое соединение востребовано при изготовлении пленок и современных натяжных потолков. Моющиеся обои дополнительно покрывают тонкой пленкой ПВХ. Это позволяет добавить им механическую прочность. Такие отделочные материалы станут идеальным вариантом для проведения косметического ремонта в офисных помещениях.
Кроме того, гидратация алкенов приводит к образованию первичных и вторичных одноатомных спиртов, которые являются отличными органическими растворителями.
http://studarium.ru/article/183
http://www.syl.ru/article/299597/gidratatsiya-alkenov-reaktsiya-i-uravneniya