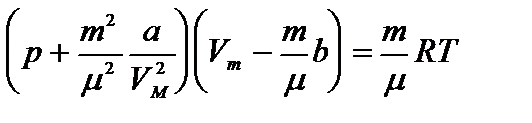Недостатки уравнения Ван-дер-Ваальса
Прежде отметим достоинство этого уравнения. Уравнение Ван-дер-Ваальса правильно описывает явления, связанные с изменением плотности газов при изменении температуры и давления, взаимные переходы жидкости и газа. Из уравнения Ван-дер-Ваальса вытекает наличие у веществ критической точки. В то же время теория Ван-дер-Ваальса имеет существенные недостатки:
а) Параметры 



б) Другое количественное расхождение между теоретическим уравнением и опытом связано со значениями критических параметров Рк, Vк, Тк. Из системы уравнений (5.8) следует, что между этими величинами должно существовать соотношение:

не зависящее от природы вещества. Опыт же показывает, что хотя величина 


В настоящее время принято описывать состояние реального газа более общим уравнением в виде ряда:
Коэффициенты В, С…, которые определяются или из опыта или теоретически, называются вириальными коэффициентами, причем все они зависят от температуры.
Внутренняя энергия газа Ван-дер-Ваальса
Как мы отметили выше, внутренняя энергия неидеальных газов U зависит не только от температуры Т, но и от объема V, т.е.
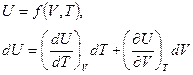
Отметим, что 
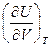


Согласно правилам Максвелла, из выражения (1.49), имеем:


В результате выражение для внутренней энергии газа можно записать в виде:
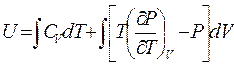
Применим формулу (5.10) для вычисления внутренней энергии газа, описываемого уравнением Ван-дер-Ваальса:

В этом случае легко заметить

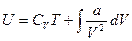
Проинтегрировав вторые слагаемые, получим:

где В — постоянная интегрирования. Для определения значения В, воспользуемся условием, что при 
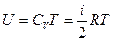


Недостатки уравнения Ван-дер-Ваальса
1. Для реальных веществ
2. Для реальных веществ 

3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состоян
Для исследования поведения реального газа используются изотермы Ван-дер-Ваальса – кривые зависимости 



При 
При некоторой температуре 

При 
Для пояснения характера изотерм, преобразуем уравнение Ван-дер-Ваальса:
Уравнение третьей степени относительно 




Рассматривая различные участки изотермы при 







Выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами Эндрюса. Отличие экспериментальных данных от теоретических заключается в том, что превращению газа в жидкость в первом случае соответствуют в первом случае горизонтальны участки а во втором – волнообразные.
Для нахождения критических параметров подставим их значения в уравнение 








Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму на три части.
Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает сжижение. Газ же при температуре выше критической не может быть превращён в жидкость ни при каком давлении.
Сравнивая изотермы Ван-дер-Ваальса и Эндрюса, видно, что последняя имеет прямолинейный участок 




При достаточно низких температурах изотерма пересекает ось 

28.Сжижение газов —переход вещества из газообразного состояния в жидкое. Оно достигается охлаждением их ниже критической температуры (Тк) и последующей конденсацией в результате отвода теплоты парообразования (конденсации).
Охлаждение газа ниже ТКнеобходимо для достижения области температур, при которых газ может сконденсироваться в жидкость (приТ > ТКжидкость существовать не может). Впервые газ (аммиак) был сжижен в 1792 (голландский физик М. ван Марум). Хлор был получен в жидком состоянии в 1823 (М.Фарадей), кислород — в 1877 (швейцарский учёный Р. Пикте и французский учёный Л. П. Кальете), азот и окись углерода — в 1883 (З. Ф. Вроблевский и К.Ольшевский) водород — в 1898 (Дж. Дьюар), гелий — в 1908 (Х. Камерлинг-Оннес).
отличие от идеального (достаточно разреженного) газа, молекулы которого не взаимодействуют друг с другом в силу их взаимной удалённости, внутренняя энергия реального газа включает не только кинетическую энергию молекул, но и их потенциальную энергию, обусловленную межмолекулярными взаимодействиями. Это взаимодействие — короткодействующее /быстро убывающее/, носящее на очень малых расстояниях характер сильного отталкивания, а на больших расстояниях — характер притяжения.
При расширении реального газа, т. е. при увеличении средних расстояний между молекулами, его потенциальная энергия может, как увеличиваться, так и убывать.
Если при этом газ изолирован (адиабатен) и не совершает работы, т. е. dQ = 0 иdА = 0, то иdU =0 и в силу сохранения внутренней энергии, изменение её потенциальной компоненты должно сопровождаться компенсирующим изменением кинетической энергии (с обратным знаком). Изменение же кинетической энергии молекул связывается с соответствующим изменением температуры газа:
Если газ адиабатно расширяется в пустоту, и его молекулы расходятся на достаточно большие расстояния, где потенциальная энергия их взаимодействия стремится к нулю,
т. е. в итоге возрастает /ибо до этого она была отрицательной/, то газ всегда охлаждается.
Если же газ адиабатно (медленно) проталкивается через пористую перегородку /для устранения турбулентности/ с перепадом давлений, то в зависимости от соотношения Р1, V1и Р2, V2и констант а и b газа, он может и понизить, и повысить, свою температуру. Соответственно имеем положительный и отрицательный эффект Джоуля — Томсона.
двигая медленно поршень 1, убавляем объем V1 до нуля при Р1 » const. Второй поршень при этом перемещается вправо; объем V2 возрастает с нуля при Р2 » const.
Дроссель (пористая перегородка) поддерживает постоянным перепад давлений Р1– Р2.
Работа А1, совершаемая по вытеснению газа в объеме V1, равна А1= Р1V1. После дросселирования газ займет (приобретет) объем V2и совершит работу А2= Р2V2. В условиях теплоизоляции изменение (приращение) внутренней энергии газа равно:
Для идеального газа DТ = 0, эффект Джоуля – Томсона отсутствует.
29.Жи́дкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями [1] . Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости [1] .
Сила поверхностного натяжения направлена по касательной к поверхности жидкости, перпендикулярно к участку контура, на который она действует и пропорциональна длине этого участка. Коэффициент пропорциональности 
В 1983 году было доказано теоретически и подтверждено данными из справочников (посмотреть статью: Журнал физической химии. 1983, № 10, с. 2528—2530), что понятие поверхностного натяжения жидкости однозначно является частью понятия внутренней энергии (хотя и специфической: для симметричных молекул близких по форме к шарообразным). Приведенные в этой журнальной статье формулы позволяют для некоторых веществ теоретически рассчитывать значения поверхностного натяжения жидкости по другим физико-химическим свойствам, например, по теплоте парообразования или по внутренней энергии (подробнее о физической природе поверхностного натяжения жидкости см.соотв. статью на викиучебнике или [2] , [3] )
В 1985 году аналогичный взгляд на физическую природу поверхностного натяжения, как части внутренней энергии, при решении другой физической задачи был опубликован В. Вайскопфом (Victor Frederick Weisskopf) в США (V.F.Weisskopf, American Journal of Physics 53 (1985) 19-20.; V.F.Weisskopf, American Journal of Physics 53 (1985) 618—619.).
Поверхностное натяжение может быть на границе газообразных, жидких и твёрдых тел. Обычно имеется в виду поверхностное натяжение жидких тел на границе «жидкость — газ». В случае жидкой поверхности раздела поверхностное натяжение правомерно также рассматривать как силу, действующую на единицу длины контура поверхности и стремящуюся сократить поверхность до минимума при заданных объёмах фаз.
В общем случае прибор для измерения поверхностного натяжения называется тензиометр.
Сма́чивание — физическое взаимодействие жидкости с поверхностью твёрдого тела или другой жидкости. Смачивание бывает двух видов:
- Иммерсионное (вся поверхность твёрдого тела контактирует с жидкостью)
- Контактное (состоит из трёх фаз — твердая, жидкая, газообразная)
Смачивание зависит от соотношения между силами сцепления молекул жидкости с молекулами (или атомами) смачиваемого тела (адгезия) и силами взаимного сцепления молекул жидкости (когезия).
Если жидкость контактирует с твёрдым телом, то существуют две возможности:
1. молекулы жидкости притягиваются друг к другу сильнее, чем к молекулам твёрдого тела. В результате силы притяжения между молекулами жидкости собирают её в капельку. Так ведёт себя ртуть на стекле, вода на парафине или «жирной» поверхности. В этом случае говорят, что жидкость не смачивает поверхность;
2. молекулы жидкости притягиваются друг к другу слабее, чем к молекулам твёрдого тела. В результате жидкость стремится прижаться к поверхности, расплывается по ней. Так ведёт себя ртуть на цинковой пластине, вода на чистом стекле или дереве. В этом случае говорят, что жидкость смачивает поверхность.
Степень смачивания характеризуется углом смачивания. Угол смачивания (или краевой угол смачивания) — это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз. Измеряется методом лежащей капли [1] . В случае порошков надёжных методов, дающих высокую степень воспроизводимости, пока (по состоянию на 2008 год) не разработано. Предложен весовой метод определения степени смачивания, но он пока не стандартизован.
Измерение степени смачивания весьма важно во многих отраслях промышленности (лакокрасочная, фармацевтическая, косметическая и т. д.). К примеру, на лобовые стёкла автомобилей наносят особые покрытия, которые должны быть устойчивы против разных видов загрязнений. Состав и физические свойства покрытия стёкол и контактных линз можно сделать оптимальным по результатам измерения контактного угла [2] .
К примеру, популярный метод увеличения добычи нефти при помощи закачки воды в пласт исходит из того, что вода заполняет поры и выдавливает нефть. В случае мелких пор и чистой воды это далеко не так, поэтому приходится добавлять специальные ПАВ. Оценку смачиваемости горных пород при добавлении различных по составу растворов можно измерить различными приборами.
Мени́ск (от греч. μενισκος) — искривление свободной поверхности жидкости вследствие её соприкосновения с поверхностью твёрдого тела или (реже) другой жидкости. Образуется в каналах и порах, около стенок сосудов, у края тел, помещённых в жидкость.
В капиллярах мениск имеет сферическую форму, в достаточно узком зазоре между двумя плоскими стенками — цилиндрическую. Радиус кривизны мениска определяется соотношением сил когезии и адгезии на границе раздела.
В случае, если жидкость смачивает твёрдое тело, мениск образуется вогнутым в жидкость — вогнутый мениск, если не смачивает — выпуклым. Над вогнутым мениском давление паров жидкости ниже, над выпуклым выше, чем над плоской свободной поверхностью жидкости. Этим явлением объясняется ряд так называемых капиллярных эффектов, например, всасывание жидкости в пористые материалы, появление разницы уровней между свободной поверхностью жидкости и сообщающейся с ней тонкой трубкой, явление капиллярной конденсации и так далее.
Разность давлений над мениском и плоской свободной поверхностью жидкости называется лапласовским (капиллярным) давлением. Радиусы кривизны мениска (в двух взаимно перпендикулярных плоскостях, нормальных поверхности мениска), капиллярное давление p и поверхностное натяжение жидкости σ связаны формулой
которая называется Законом Лапласа.
30. Твердые тела. 2. Кристаллические тела. 3. Моно- и поликристаллы. 4. Аморфные тела. .5. Упругость. 6. Пластичность.
Каждый может легко разделить тела на твердые и жидкие. Однако это деление будет только по внешним признакам. Для того чтобы выяснить, какими же свойствами обладают твердые тела, будем их нагревать. Одни тела начнут гореть (дерево,уголь) — это органические вещества. Другие будут размягчаться (смола) даже при невысоких температурах — это аморфные. Третьи будут изменять свое состояние при нагревании так, как показано на графике (рис. 12). Это и есть кристаллические тела. Такое поведение кристаллических тел при нагревании объясняется их внутренним строением.Кристаллические тела — это такие тела, атомы и молекулы которых расположены в определенном порядке, и этот порядок сохраняется на достаточно большом расстоянии. Пространственное периодическое расположение атомов или ионов в кристалле называют кристаллической решеткой. Точки кристаллической решетки, в которых расположены атомы или ионы, называютузлами кристаллической решетки.
Кристаллические тела бывают монокристаллами и поликристаллами.Монокристалл обладает единой кристаллической решеткой во всем объеме.
Анизотропия монокристаллов заключается в зависимости их физических свойств от направления. Поликристалл представляет собой соединение мелких, различным образом ориентированных монокристаллов (зерен) и не обладает анизотропией свойств.
Большинство твердых тел имеют поликристаллическое строение (минералы, сплавы, керамика).
Основными свойствами кристаллических тел являются: определенность температуры плавления, упругость, прочность, зависимость свойств от порядка расположения атомов, т. е. от типа кристаллической решетки.
Аморфными называют вещества, у которых отсутствует порядок расположения атомов и молекул по всему объему этого вещества. В отличие от кристаллических веществ аморфные веществаизотропны. Это значит, что свойства одинаковы по всем направлениям. Переход из аморфного состояния в жидкое происходит постепенно, отсутствует определенная температура плавления. Аморфные тела не обладают упругостью, они пластичны. В аморфном состоянии находятся различные вещества: стекла, смолы, пластмассы и т. п.
Упругость — свойство тел восстанавливать свою форму и объем после прекращения действия внешних сил или других причин, вызвавших деформацию тел. Для упругих деформаций справедлив закон Гука, согласно которому упругие деформации прямо пропорциональны вызывающим их внешним воздействиям , где — механическое напряжение,
e — относительное удлинение, Е — модуль Юнга (модуль упругости). Упругость обусловлена взаимодействием и тепловым движением частиц, из которых состоит вещество.
Пластичность — свойство твердых тел под действием внешних сил изменять, не разрушаясь, свою форму и размеры и сохранять остаточные деформации после того, как действие этих сил прекратится.
31.Капилля́рность (от лат. capillaris — волосяной; отсюда происходит встречавшийся ранее в русскоязычной научной литературе термин воло́сность), капиллярность — явление, подъема или опускания жидкости в капиллярах, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной формы, пористых телах. В поле тяжести (или сил инерции, например при центрифугировании пористых образцов) поднятие жидкости происходит в случаях смачивания каналов жидкостями, например воды в стеклянных трубках, песке, грунте и т. п. Понижение жидкости происходит в трубках и каналах, не смачиваемых жидкостью, например ртуть в стеклянной трубке.
Благодаря капиллярности возможны жизнедеятельность животных и растений, различные химические процессы, бытовые явления (например, подъём керосина по фитилю в керосиновой лампе, вытирание рук полотенцем), однако важно отметить, что в биологических объектах капиллярный механизм перемещения жидкости не является единственным (важную роль играет осмос).
31Относительная влажность — отношение парциального давления паров воды в газе (в первую очередь, в воздухе) к равновесному давлению насыщенных паров при данной температуре. Обозначается греческой буквой φ.
Абсолютная влажность]
Абсолютная влажность — количество влаги, содержащейся в одном кубическом метре воздуха. Из-за малой величины обычно измеряют в г/м³. Но в связи с тем, что при определённой температуре воздуха в нём может максимально содержаться только определённое количество влаги (с увеличением температуры это максимально возможное количество влаги увеличивается, с уменьшением температуры воздуха максимальное возможное количество влаги уменьшается), ввели понятие относительной влажности.
Относительная влажность
Эквивалентное определение — отношение массовой доли водяного пара в воздухе к максимально возможной при данной температуре. Измеряется в процентах и определяется по формуле:
где: 


Давление насыщенных паров воды сильно растёт при увеличении температуры. Поэтому при изобарическом (то есть при постоянном давлении) охлаждении воздуха с постоянной концентрацией пара наступает момент (точка росы), когда пар насыщается. При этом «лишний» пар конденсируется в виде тумана или кристалликов льда. Процессы насыщения и конденсации водяного пара играют огромную роль в физике атмосферы: процессы образования облаков и образование атмосферных фронтов в значительной части определяются процессами насыщения и конденсации, теплота, выделяющаяся при конденсации атмосферного водяного пара обеспечивает энергетический механизм возникновения и развития тропических циклонов (ураганов).
Оценка относительной влажности[править | править вики-текст]
Относительная влажность водно-воздушной смеси может быть оценена, если известны её температура (T) и температура точки росы (Td), по следующей формуле:
где Ps — давление насыщенного пара для соответствующей температуры, которое может быть вычислено по формуле Ардена Бака [1] :
где T — температура в градусах Цельсия, Ps — давление в гПа. Для отрицательных температур при отсутствии жидкой фазы используется другая формула Бака:
Для более точных расчётов следует воспользоваться моделями Гоффа-Грэтча или более современными: А. Векслера, ITS-90 [2] , Д. Зонтага. [3]
Относительную влажность приближённо можно вычислить по следующей формуле:
То есть, с каждым градусом Цельсия разницы температуры воздуха и температуры точки росы относительная влажность уменьшается на 5%.
Дополнительно относительную влажность можно оценить по психрометрической диаграммме.
Пересыщенный водяной пар[править | править вики-текст]
В отсутствие центров конденсации при снижении температуры возможно образование пересыщенного состояния, то есть относительная влажность становится более 100 %. В качестве центров конденсации могут выступать ионы или частицы аэрозолей, именно на конденсации пересыщенного пара на ионах, образующихся при прохождении заряженной частицы в таком паре, основан принцип действия камеры Вильсона и диффузионных камер: капельки воды, конденсирующиеся на образовавшихся ионах, образуют видимый след (трек) заряженной частицы.
Другим примером конденсации пересыщенного водяного пара являются инверсионные следы самолётов, возникающие при конденсации пересыщенного водяного пара на частицах сажи выхлопа двигателей.
Средства и методы контроля
Для определения влажности воздуха используются приборы, которые называются психрометрами и гигрометрами. Психрометр Августа состоит из двух термометров — сухого и влажного. Влажный термометр показывает температуру ниже, чем сухой, так как его резервуар обмотан тканью, смоченной в воде, которая, испаряясь, охлаждает его. Интенсивность испарения зависит от относительной влажности воздуха. По показаниям сухого и влажного термометров находят относительную влажность воздуха по психрометрическим таблицам. В последнее время стали широко применяться интегральные датчики влажности (как правило, с выходом по напряжению), основанные на свойстве некоторых полимеров изменять свои электрические характеристики (такие, как диэлектрическая проницаемость среды) под действием содержащихся в воздухе паров воды.
Для определения и подтверждения метрологических характеристик приборов для измерения влажности применяют специальные эталонные (образцовые) установки — климатические камеры (гигростаты) или динамические генераторы влажности газов.
Значение
Относительная влажность воздуха — важный экологический показатель среды. При слишком низкой или слишком высокой влажности наблюдается быстрая утомляемость человека, ухудшение восприятия и памяти. Высыхают слизистые оболочки человека, движущиеся поверхности трескаются, образуя микротрещины, куда напрямую проникают вирусы, бактерии, микробы. Низкая относительная влажность (до 5—7 %) в помещениях квартиры, офиса отмечена в регионах с продолжительным стоянием низких отрицательных температур наружного воздуха. Обычно продолжительность до 1—2 недель при температурах ниже −20 °С приводит к высушиванию помещений. Значительным ухудшающим фактором в поддержании относительной влажности является воздухообмен при низких отрицательных температурах. Чем больше воздухообмен в помещениях, тем быстрее в этих помещениях создаётся низкая (5—7 %) относительная влажность.
Замечено, что при длительных морозах редко возникают заболевания гриппом и ОРЗ, но когда морозы спадают — люди, пережившие эти холода, заболевают, причём в первую продолжительную (до недели) оттепель.
Пищевые продукты, строительные материалы и даже многие электронные компоненты допускается хранить в строго определённом диапазоне относительной влажности воздуха. Многие технологические процессы происходят только при строгом контроле содержания паров воды в воздухе производственного помещения.
Влажность воздуха в помещении можно изменять.
Для повышения влажности применяются увлажнители воздуха.
Функции осушения (понижения влажности) воздуха реализованы в большинстве кондиционеров и в виде отдельных приборов — осушителей воздуха.
В цветоводстве
Относительная влажность воздуха в оранжереях и используемых для культивирования растений жилых помещениях подвержена колебаниям, что обусловлено временем года, температурой воздуха, степенью и частотой поливки и опрыскивания растений, наличием увлажнителей, аквариумов или других ёмкостей с открытой поверхностью воды, системой проветривания и обогрева. Кактусы и многие суккулентные растения легче переносят сухой воздух, чем многие тропические и субтропические растения.
Как правило, для растений родиной которых являются влажные тропические леса, оптимальной является 80—95 % относительная влажность воздуха (зимой может быть снижена до 65—75 %). Для растений тёплых субтропиков — 75—80 %, холодных субтропиков — 50—75 % (левкои, цикламены, цинерарии и др.)
При содержании растений в жилых помещениях многие виды страдают от сухости воздуха. В первую очередь это отражается на листьях; у них наблюдается быстрое и прогрессирующее засыхание верхушек. [4]
Для повышения относительной влажности в жилых помещениях используют электрические увлажнители, наполненные мокрым керамзитом поддоны и регулярное опрыскивание.
Набор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний, то есть одно и то же агрегатное состояние вещества может находиться в различных термодинамических фазах. Именно поэтому описание вещества в терминах агрегатных состояний довольно огрублённое, и оно не может различить некоторые физические разные ситуации.
Богатый набор термодинамических фаз связан, как правило, с различными вариантами порядка, которые допускаются в том или ином агрегатном состоянии.
- В газообразном состоянии вещество не обладает никаким порядком. Соответственно, в газообразном состоянии любое вещество обладает только одной термодинамической фазой. (Фазовые переходы типа диссоциации молекул или ионизации являются, по определению, переходами одного вещества в другое).
- Жидкость обладает ориентационным порядком, но, как правило, не обладает трансляционным порядком. В результате у одной и той же жидкости могут быть разные термодинамические фазы, однако количество их редко превышает единицу. Так, например, существование новой жидкой фазы обнаружено в переохлаждённой воде. Другой пример — сверхтекучее состояние в жидком гелии.
- Кристаллическое твёрдое тело обладает как трансляционным, так и ориентационным порядком. В результате возникает большое число возможных вариантов ориентации соседних молекул друг относительно друга, которые могут оказаться энергетически выгодными при тех или иных давлении и температуре. В результате твёрдые тела обладают, как правило, достаточно сложной фазовой диаграммой. Например, фазовая диаграмма такого, казалось бы, простого вещества, как лёд, насчитывает по крайней мере 12 термодинамических фаз, реализующихся при различных температурах и давлениях.
Выделение фаз[править | править вики-текст]
Выделение фаз — превращение гомогенной системы в двух- или многофазную — широко используется в науке и технике.
Кристаллизация позволяет получать чистые вещества.
При высоких давлениях может наблюдаться такое явление, как расслоение в системе газ — газ. На возможность существования гетерогенного равновесия в газовой смеси выше критической температуры было указано ещё Ван-дер-Ваальсом, и затем это явление было проанализировано Камерлинг-Оннесом и Кеезомом. Экспериментальное доказательство наличия такого явления было впервые получено на примере системы аммиак — азот в 1941 году. Вначале предполагалось, что ограниченная взаимная растворимость наблюдается лишь в газовых смесях, содержащих полярный компонент (аммиак, сероводород). Однако впоследствии было установлено расслоение смесей гелий — диоксид углерода, гелий — этилен и гелий — пропан. В системе гелий — этилен существование поверхности раздела фаз при ограниченной взаимной растворимости газов было подтверждено визуальными наблюдениями и фотографированием мениска между двумя газовыми фазами.
При расслоении смеси газов иногда наблюдается так называемое баротропное явление — перемена местами двух сосуществующих фаз при увеличении давления. К примеру, в двойной системе NH3(ж.) — N2(г.) фаза, более богатая аммиаком, имеет большую плотность. Однако при расслоении смеси (90 °C, 1800 ат (
1,84 кбар)) фаза, более богатая аммиаком, имеет уже меньшую плотность и поднимается вверх [7] .
Водяной пар — газообразное состояние воды. Не имеет цвета, вкуса и запаха. Содержится в тропосфере.
Образуется молекулами воды при её испарении. При поступлении водяного пара в воздух он, как и все другие газы, создаёт определённое давление, называемое парциальным. [1] Оно выражается в единицах давления — паскалях. Водяной пар может переходить непосредственно в твёрдую фазу — в кристаллы льда. Количество водяного пара в граммах, содержащегося в 1 кубическом метре, называют абсолютной влажностью воздуха.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава [1] .
Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация или десублимация.
Вла́жность — показатель содержания воды в физических телах или средах. Для измерения влажности используются различные единицы, часто внесистемные.
Влажность зависит от природы вещества, а в твёрдых телах, кроме того, от степени измельчённости или пористости. Содержание химически связанной, так называемой конституционной воды, например гидроокисей, выделяющейся только при химическом разложении, а также воды кристаллогидратной не входит в понятие влажности.
Единицы измерения и особенности определения понятия «влажность»
- Влажность обычно характеризуется количеством воды в веществе, выраженным в процентах (%) от первоначальной массы влажного вещества (массовая влажность) или её объёма (объёмная влажность).
- Влажность можно характеризовать также влагосодержанием, или абсолютной влажностью — количеством воды, отнесённым к единице массы сухой части материала. Такое определение влажности широко используется для оценки качества древесины.
Эту величину не всегда можно точно измерить, так как в ряде случаев невозможно удалить всю неконденсированную воду и взвесить предмет до и после этой операции.
- Относительная влажность характеризует содержание влаги по сравнению с максимальным количеством влаги, которое может содержаться в веществе в состоянии термодинамического равновесия. Обычно относительную влажность измеряют в процентах от максимума.
Методы определения
Установление степени влажности многих продуктов, материалов и т. п. имеет важное значение. Только при определённой влажности многие тела (зерно, цемент и др.) являются пригодными для той цели, для которой они предназначены. Жизнедеятельность животных и растительных организмов возможна только в определённых диапазонах влажности и относительной влажности воздуха. Влажность может вносить существенную погрешность в массу предмета. Килограмм сахара или зерна с влажностью 5 % и 10 % будет содержать разное количество сухого сахара или зерна.
Измерение влажности определяется высушиванием влаги и титрованием влаги по Карлу Фишеру. Эти способы являются первичными. Помимо них разработано множество других, которые калибруются по результатам измерений влажности первичными способами и по стандартным образцам влажности.
Влажность воздуха[править | править вики-текст]
Влажность воздуха — это величина, характеризующая содержание водяных паров в атмосфере Земли — одна из наиболее существенных характеристик погоды и климата.
Влажность воздуха в земной атмосфере колеблется в широких пределах. Так, у земной поверхности содержание водяного пара в воздухе составляет в среднем от 0,2 % по объёму в высоких широтах до 2,5 % в тропиках. Упругость пара в полярных широтах зимой меньше 1 мбар (иногда лишь сотые доли мбар) и летом ниже 5 мбар; в тропиках же она возрастает до 30 мбар, а иногда и больше. В субтропических пустынях упругость пара понижена до 5—10 мбар.
Абсолютная влажность воздуха (f) — это количество водяного пара, фактически содержащегося в 1 м³ воздуха. Определяется как отношение массы содержащегося в воздухе водяного пара к объёму влажного воздуха.
Обычно используемая единица абсолютной влажности — грамм на метр кубический, г/м³
Относительная влажность воздуха (φ) — это отношение его текущей абсолютной влажности к максимальной абсолютной влажности при данной температуре. Она также определяется как отношение парциального давления водяного пара в газе к равновесному давлению насыщенного пара.
| Температура t, °C | −30 | −20 | −10 | ||||||
| Максимальная абсолютная влажность fmax, (г/м³) | 0,29 | 0,81 | 2,1 | 4,8 | 9,4 | 17,3 | 30,4 | 51,1 | 83,0 |
Относительная влажность обычно выражается в процентах.
Относительная влажность очень высока в экваториальной зоне (среднегодовая до 85 % и более), а также в полярных широтах и зимой внутри материков средних широт. Летом высокой относительной влажностью характеризуются муссонные районы. Низкие значения относительной влажности наблюдаются в субтропических и тропических пустынях и зимой в муссонных районах (до 50 % и ниже).
С высотой влажность быстро убывает. На высоте 1,5-2 км упругость пара в среднем вдвое меньше, чем у земной поверхности. На тропосферу приходится 99 % водяного пара атмосферы. В среднем над каждым квадратным метром земной поверхности в воздухе содержится 28,5 кг водяного пара.
Реальные газы. Уравнение Ван-дер-Ваальса. Критическое состояние.
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Для получения уравнения состояния реального газа необходимо учесть собственный объем молекул и энергию взаимодействия молекул на расстоянии. Наличие собственного объема молекул приводит к уменьшению объема, предоставленного молекулам, на некоторую величину. Силы притяжения между молекулами газа вызывают уменьшение давления молекул газа на стенки сосуда на некоторую величину рi.
Это уравнение может получено путем соответствующего изменения уравнения Менделеева-Клапейрона путем внесения в него поправок.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля имеет вид:
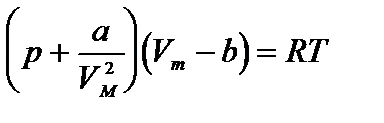
где р — давление, оказываемое на стенки сосуда, VМ – объем одного моля газа, а и b — постоянные Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. Поправка 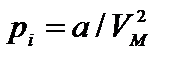
b= 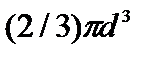
Уравнение Ван-дер-Ваальса для произвольной массы газа имеет вид:
Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа.
Уравнение Ван-дер-Ваальса после нескольких преобразований можно записать в виде:
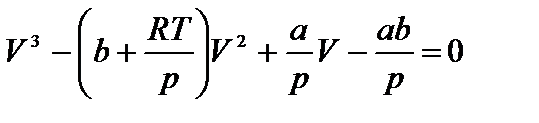
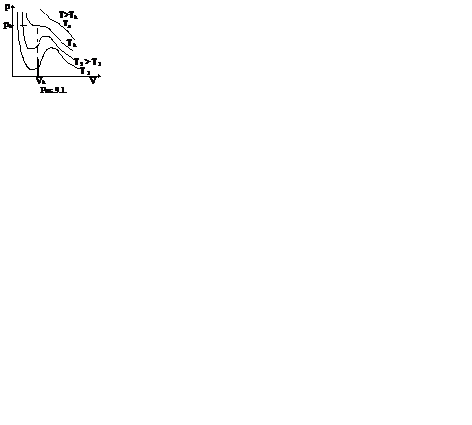
Это уравнение третьей степени относительно V. Кубическое уравнение может иметь либо три вещественных корня, либо один вещественный и два мнимых.
Первому случаю соответствуют изотермы при низких температурах – кривые для Т1 и Т2 (рис.9.1.) Второму случаю изотермы при высоких температурах (одно значение объема V отвечает одному значению давления р), то есть любая изотерма начиная от изотермы для Тк.
Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах (так как при этих условиях газ можно считать идеальным). Для семейства изотерм Ван-дер-Ваальса характерно так называемой критической изотермы (при температуре Тк) имеющий точку перегиба при некотором давлении рк и объеме Vк; при Т>Тк все изотермы идут монотонно, при Т
Уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
Дата добавления: 2015-04-01 ; просмотров: 18482 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://allrefrs.ru/3-34953.html
http://helpiks.org/3-368.html